β-内酰胺类抗生素中高分子杂质的研究和检测方法进展
侯玉荣 ,袁耀佐 ,张 玫 ,钱 文 ,杭太俊
1中国药科大学药物分析教研室,南京 210009;2江苏省食品药品检验所,南京 210008
β-内酰胺类抗生素是抗生素家族中使用最广泛的一类药物,其使用过程中的不良反应,尤其是过敏反应受到了医药界的高度重视。多年来的研究证明,引发过敏反应的过敏原是其中的高分子杂质[1-2],因此,对该类药物中高分子杂质的研究和控制,成为减少其不良反应的重要手段。
1 β-内酰胺类抗生素高分子杂质的定义、分类及结构特性
抗生素中的高分子杂质一般是指药物中相对分子质量大于药物本身的杂质的总称。按其来源可分为外源性杂质、内源性杂质和其他来源杂质:①蛋白、多肽、多糖等杂质,或抗生素与蛋白、多肽、多糖的结合物,一般于发酵过程中产生,即外源性杂质;②内源性杂质又称自身聚合类高分子杂质:在一定条件下,β-内酰胺可以开环产生自身的聚合反应[3];③其他来源的杂质:有部分杂质,并非药物分子间自身聚合产生,而是合成或使用过程中产生的高分子副产物或者高分子降解产物,如头孢唑肟钠样品中可能存在的杂质(图1)为头孢唑肟酸合成时的中间体与头孢唑肟反应的副产物[4]。
抗生素药物结构的复杂多样和不稳定性,使得其高分子杂质结构亦复杂多样。例如阿莫西林样品中的二聚体杂质,包括开环阿莫西林二聚体和闭环阿莫西林二聚体(图2);不同pH的溶液中可能产生不同方式的聚合[5];药物本身同分异构体的存在使得聚合反应多样,可发生同聚或异聚反应[6];溶液放置过程中也可发生不同程度的聚合或降解反应[7]。
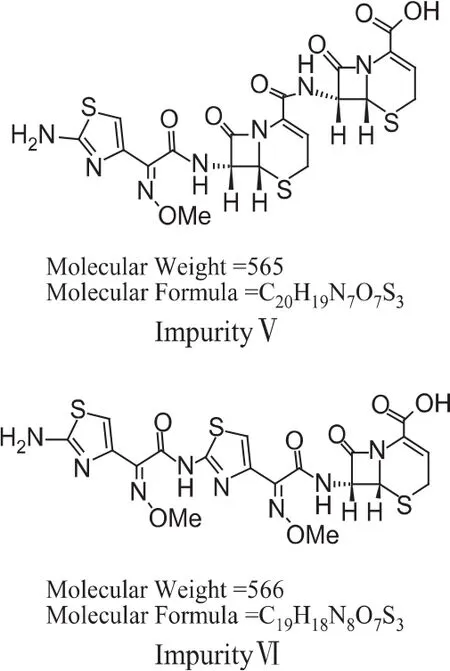
图1 头孢唑肟钠样品中的杂质[4]
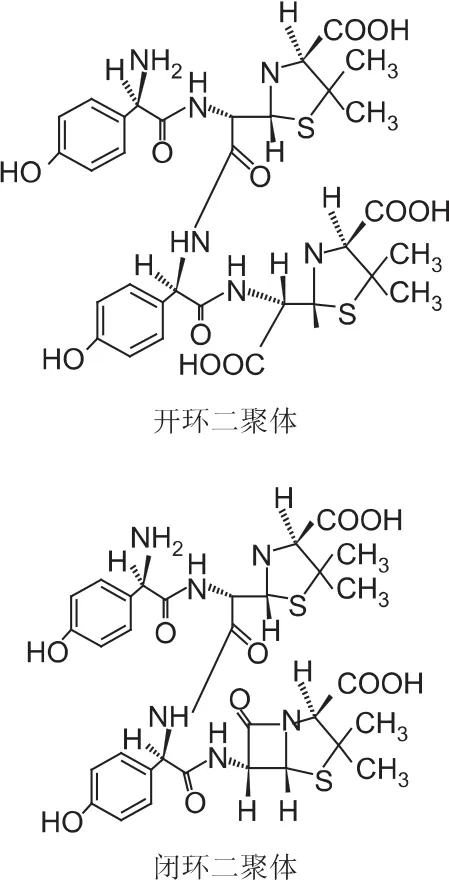
图2 阿莫西林的二聚体结构
2 过敏反应与抗原决定簇的结构特点
2.1 过敏反应
文献报道的β-内酰胺类抗生素引发的过敏反应多数为速发型过敏反应,也有少数迟发型过敏反应的报告[8]。人体内与过敏反应相关的特异性抗体为LgE抗体[9]。近年来,乔海灵等[10-12]研究发现,T细胞在青霉素类抗生素诱发的速发型、迟发型过敏反应中有重要作用。青霉素类抗生素特异性抗体由B细胞产生,该过程受不同的T淋巴细胞亚群调节和控制。细胞因子如IL-4、IL-10、IFN-Y等在过敏反应中发挥重要作用。
2.2 抗原决定簇结构特点与交叉过敏
青霉素抗原决定簇,包括主要和次要抗原决定簇、侧链抗原决定簇,分别位于青霉素内酰胺环、噻唑环及青霉素6位侧链;头孢菌素抗原决定簇结构主要和7位侧链结构有关[13]。头孢菌素7位侧链结构和青霉素6位侧链结构越相似,越易引发交叉过敏反应,若两者侧链结构完全不同,则可能不发生交叉过敏反应[14]。
3 影响高分子杂质产生的因素
3.1 生产工艺
高分子杂质的种类和数量与药物的生产工艺有关。研究结果显示,青霉素的结晶工艺条件是去除其致敏性高分子杂质的关键[15]。
3.2 贮存和放置条件
固体条件下,水份含量是控制头孢菌素聚合反应速度的关键因素。当贮存温度较低时,含水量差异对高分子杂质的含量影响不大,但高水份样本在贮存温度上升时,高分子杂质的含量迅速增加,而光照对高分子杂质的含量影响较小[16]。
溶液状态下,高分子杂质的聚合反应速度与放置的温度及酸碱度有关,聚合速度随放置时间延长增快,随温度升高增快[17]。图3为头孢唑肟钠水溶液中的高分子杂质与温度的关系。
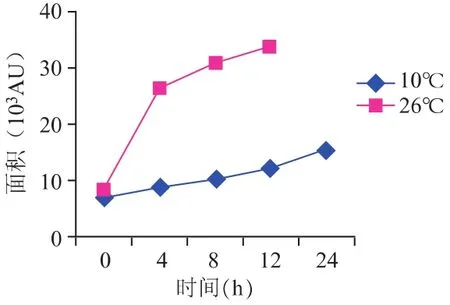
图3 头孢唑肟钠水溶液中的高分子杂质随时间和温度的变化曲线
4 β-内酰胺类抗生素高分子杂质的分析方法
4.1 现有分析方法
主要有:凝胶色谱法、反相色谱法、高效毛细管电泳法、离子交换色谱法、大孔树脂法。凝胶色谱法(分子排阻色谱法)是目前测定β-内酰胺类抗生素高分子杂质最常用的方法,针对本类抗生素中各种高分子杂质具有相似的生物学特性(如过敏性)这一特点,在质量控制中只需要控制其总量[18]。Sephadex G10凝胶是最易控制高分子杂质总量的通用型填料。
4.2 高效凝胶色谱、高效液相色谱等分析技术的联用
近年来,各种新型高效凝胶色谱柱应用于β-内酰胺类抗生素高分子杂质的分离测定中,较之Sephadex G10凝胶,高效凝胶色谱具有灵敏度高、分离度好、分析时间短的特点,因此其多应用于分析难以用Sephadex G10凝胶测定的品种,例如碳烯类抗生素、含酶抑制剂的双组分抗生素及水溶性较差的抗生素等。钟雅妮等[19]采用TSK G2500 PWXL色谱柱测定了替卡西林钠克拉维酸钾中的高分子杂质;赵晓冬等[20]采用Superdex peptide 10/300GL凝胶色谱柱测定了注射用头孢呋辛钠舒巴坦钠中的高分子杂质;朱美容等[21]采用TSK G2500PWXL凝胶色谱法测定了头孢地尼中的高分子杂质。用于分离β-内酰胺抗生素高分子杂质的常用凝胶色谱柱及性能比较见表1。
将高效凝胶色谱与不同类型的检测器相连,可以进一步研究分析此类杂质。如:与DAD检测器相连,可监测分离得到的杂质的光吸收行为;与柱切换装置相连,可将凝胶色谱分离得到的杂质逐一切换到HPLC-C18系统中,进一步分离和纯化杂质[22];将凝胶色谱系统或C18色谱系统与MS联用,可以测定杂质的相对分子质量,初步推定杂质的分子结构。
5 国际上对β-内酰胺类抗生素的高分子杂质控制的现状
5.1 国外药典对β-内酰胺类抗生素高分子杂质的检测情况
《美国药典》(USP)23版曾对头孢他啶中的高分子杂质进行检测,由于β-内酰胺类抗生素的高分子杂质非常不稳定,制备和标化杂质对照品非常困难,故难以供应杂质对照品而从药典中取消;《英国药典》(BP2011)在各论中对阿莫西林、氨苄西林、头孢噻肟钠等品种的高分子杂质进行控制,采用RPHPLC法,用相对保留时间定位、主成分自身对照法测定二聚体和三聚体的含量(见表2)。
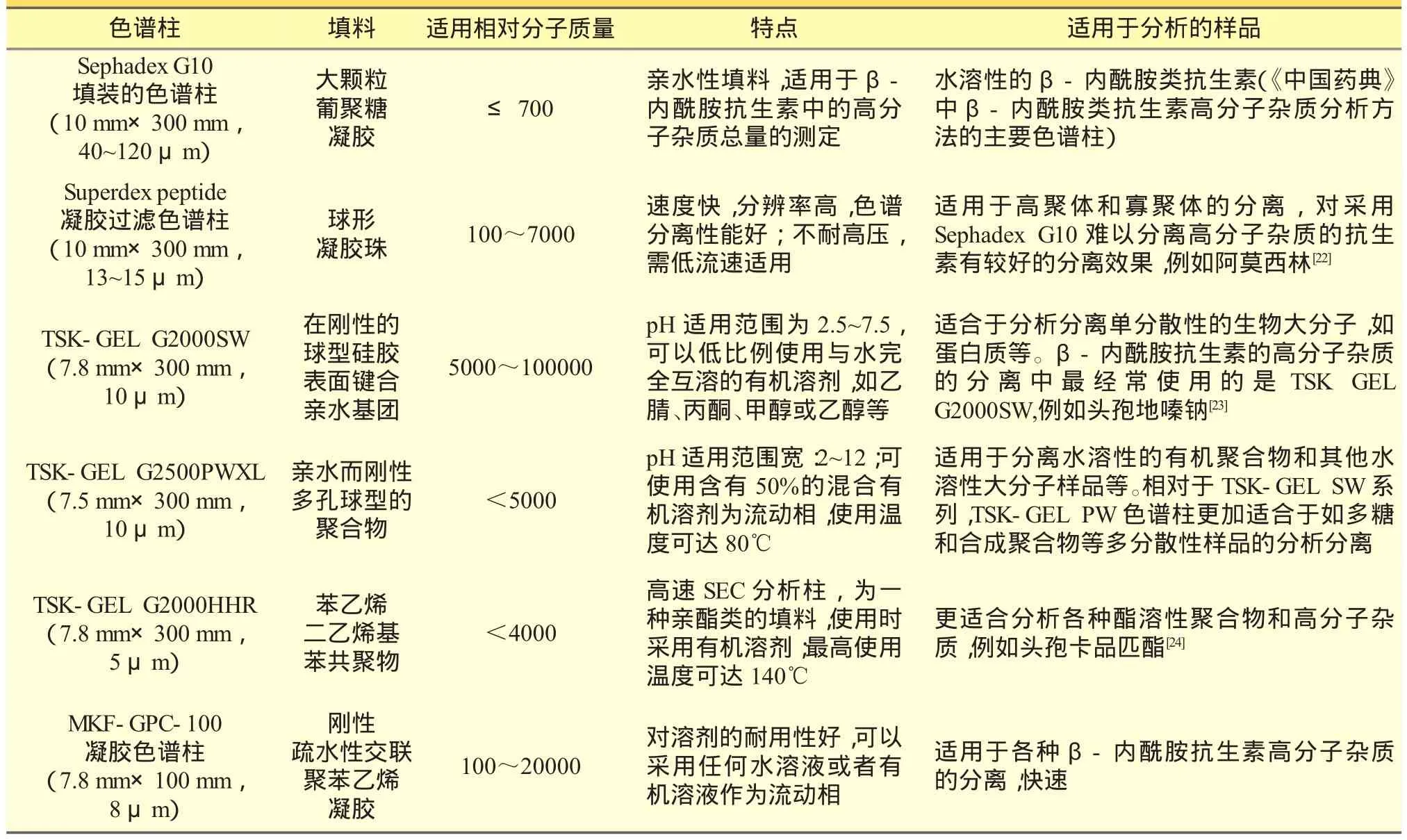
表1 用于分离β-内酰胺抗生素高分子的常用凝胶色谱柱及性能比较
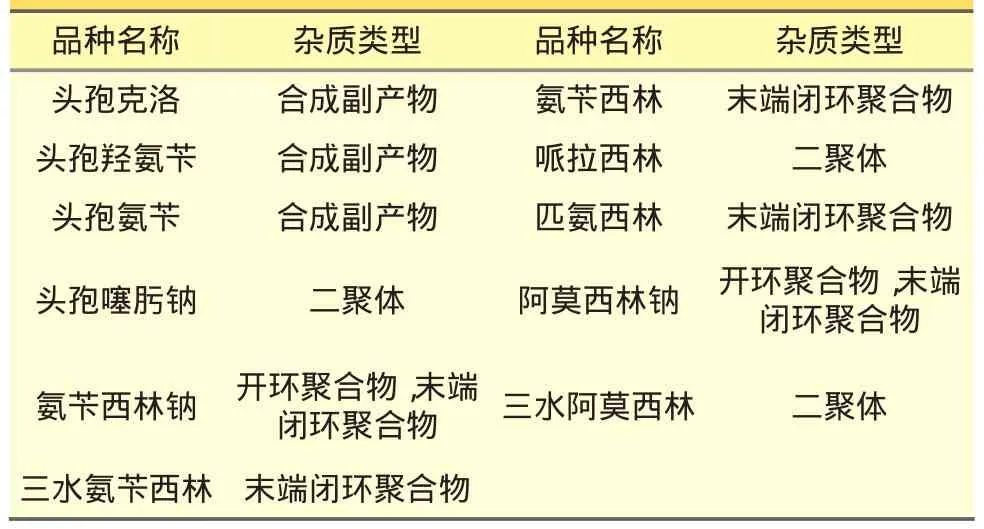
表2 BP2011中收录控制高分子杂质的β-内酰胺类抗生素品种(杂质结构式略)
5.2 《中国药典》中β-内酰胺类抗生素的高分子杂质检测方法的沿革
我国从20世纪70年代起就开始对β-内酰胺类抗生素的高分子杂质的化学结构和生物学特性进行研究。胡昌勤等[25-26]建立了根据分子量差异进行分离的分子排阻色谱法,根据β-内酰胺类抗生素在水溶液中具有缔合现象的特点,测定水系统中对照品缔合峰的峰面积,外标法计算样品中的杂质量。这一方法解决了RP-HPLC法分离模式中难以定位高分子杂质的难题,为β-内酰胺类抗生素的高分子杂质控制的常规化提供了可能。
《中国药典》从2000年版开始对头孢他啶等4个品种及8个相关制剂的标准进行控制;2005年版增加至7个品种13个制剂标准的高分子杂质控制;2010年版增加至22个品种43个制剂标准的控制。
6 当前β-内酰胺抗生素高分子杂质检测方法中存在的问题
6.1 葡聚糖凝胶Sephadex G10的局限性
柱效低、分离效果差;易受药物的开环物等小分子、辅料以及酶抑制剂的干扰;色谱柱填料亲水性,不能使用有机溶剂作为流动相,对药物水溶性要求高等。
6.2 β-内酰胺抗生素在凝胶介质中受多种作用影响
β-内酰胺抗生素在凝胶介质中受分子排阻、吸附作用的共同影响,不能简单地以保留体积判定β-内酰胺抗生素及其杂质的相对分子质量。蔡珊英等[27]为建立和优化β-内酰胺抗生素中高分子杂质的分离分析方法,通过研究β-内酰胺抗生素与Superdex peptide凝胶介质的相互作用,考察了8种β-内酰胺抗生素在Superdex peptide凝胶介质中不同色谱条件下的色谱行为。
6.3 HPLC-C18色谱法测定聚合物类杂质的难度
β-内酰胺类抗生素的高分子杂质具有高度的不均一性和不确定性,其聚合反应的多变多样性也给对高分子杂质的探索研究带来了难度。HPLC-C18色谱系统,是一种高效的专属性强的分离系统。由于β-内酰胺类抗生素高分子杂质对照品的制备和标准化都非常困难,《英国药典》(BP)虽采用相对保留时间定位高分子杂质峰的方法,但也需要先对高分子杂质的结构进行鉴定。实践证明,HPLC-C18方法的开发难度较大,主要问题除了制备杂质对照品困难外,还与高分子杂质复杂多样,样品中杂质量较低,在C18色谱柱上峰保留较强,较难洗脱,难以定位和鉴定色谱流出峰中哪些杂质是高分子杂质等有关。
7 抗生素高分子杂质深入研究的方向
7.1 分析的分离机制和验证机制的关联
β-内酰胺抗生素在凝胶色谱中各组分的洗脱顺序不一定完全按照相对分子质量大小排列,因此,随着高效凝胶色谱的广泛应用,需要对凝胶色谱分离得到的高分子杂质峰的专属性予以重视和验证。王成刚等[28]建立了高效分子排阻色谱法分析注射用头孢噻吩钠中的高分子杂质,并采用LC-MS的方法对分离的杂质峰进行了测定,得到响应值最大高分子杂质的质谱图,推测其为头孢羟氨苄的二聚体。
7.2 药理活性与致敏量的探索
国内经过大量病例的临床观察和试验研究发现,青霉素中高分子杂质含量与过敏反应率相关,杂质量高,过敏反应率高;金少鸿等首次明确提出在青霉素生产过程中应严格控制高分子杂质的含量[29],对于口服青霉素高分子杂质,原料药中应<0.1%,制剂中应<0.2%。良好的质量标准在于制订安全、有效、合理的质量控制限度,因此对高分子杂质的药理活性和致敏量的探索仍是非常重要的研究课题。
7.3 聚合反应机制的深度探索
降低杂质以降低使用抗生素副作用的危害,减少交叉过敏是提高国内抗生素产品质量和产品竞争力的基础。需要对各类抗生素的聚合反应的发生条件及影响因素作进一步的研究。
7.4 交叉过敏的深入探索
据报道,青霉素类抗生素与头孢菌素类抗生素间的交叉过敏反应率高达19.82%[12],头孢抗体对药物分子的识别具有较高的结构特异性,侧链结构在交叉过敏反应中起着不容忽视的作用。对相同侧链结构的青霉素和头孢菌素的过敏反应的深入研究,可以为抗生素药物联用提供重要信息,有巨大的现实意义。
7.5 多方位研究和重视兽用抗生素质量
有报道指出,β-内酰胺类抗生素的高分子杂质亦能引发牲畜的过敏反应[30-31],因此在研究药物疗效的同时,高分子杂质的药理毒理变化及其在产品中的残留可作为新的研究方向。
[1] 金少鸿,经 洁,郑昌亮.头孢噻肟中高分子杂质和过敏反应关系的研究Ⅰ:头孢噻肟中高分子过敏性杂质的分离和免疫学研究 [J].中国抗生素杂志,1986,11(5):409-13.
[2] 金少鸿,经 洁,郑昌亮.头孢噻肟中高分子杂质和过敏反应关系的研究Ⅱ:头孢噻肟中高分子过敏性杂质的本质探讨[J]. 中国抗生素杂志,1986,11(6):463-7.
[3] 胡昌勤.抗菌药中高分子杂质的特性及抗菌药过敏反应(上)[J]. 中国药师,2006,9(3):236-40.
[4] Bharathia Ch,Prasada ChS,Bharathia DV,etal.Structural identification and characterization of impurities in ceftizoxime sodium[J].J Pharm Biomed Anal,2007,43(2):733-40.
[5] 胡昌勤,金少鸿,孙学兰.头孢菌素结构和其聚合反应关系的探讨Ⅰ:结构对反应类型的影响[J].中国抗生素杂志,1991,16(1):25-8.
[6] 牛长群,祝仕清.氨苄西林、阿莫西林中相关物质的LCMS 分析[J]. 药学学报,2001,36(10):758-61.
[7] 胡昌勤,丁 宏,赵嘉才,等.氨苄青霉素、羧苄青霉素中寡聚物的分离分析[J].中国抗生素杂志,1994,19(3):210-4.
[8] 元玉莲.青霉素迟发性过敏性休克2例原因分析[J].中国社区医师·医学专业半月刊,2010,7(12):135.
[9] Romano A,Blanca M,Mayorga C,et al.Immediate hypersens itivity to penicillins.Studies on Italian subjects[J].Allergy,1997,52(1):89-93.
[10] 田 鑫,乔海灵.青霉素类抗生素过敏反应机制的研究[D].河南:郑州大学,2002.
[11] 李 志,乔海灵.T细胞在β-内酰胺类抗生素过敏反应中的作用 [J].国外医药·抗生素分册,2006,27(4):145-7.
[12] 刘相端,乔海灵.青霉素类与头孢菌素类药物交叉过敏反应及特异性抗体的研究 [D].河南:郑州大学,2007.
[13] 胡昌勤.抗菌药中高分子杂质的特性及抗菌药过敏反应(下)[J]. 中国药师,2006,9(4):321-2.
[14] 金少鸿,胡昌勤,孙学兰.头孢菌素抗原决定簇中抗体结合位点的分析 [J].中国抗生素杂志,1991,16(2):110-6.
[15] 汪开敏,赵建西,孙学兰.青霉素过敏反应研究[J].药物分析杂志,1983,3(2):71.
[16] 胡昌勤,孙学兰,金少鸿,等.固体状态下头孢菌素聚合反应的探讨 [J].中国抗生素杂志,1991,16(2):106-9.
[17] 胡昌勤,金少鸿,孙学兰,等.头孢菌素结构和其聚合反应关系的探讨Ⅱ:结构对反应速度的影响[J].中国抗生素杂志,1991,16(1):30-4.
[18] 顾立素,胡昌勤,金少鸿.安美汀中高分子杂质的分离分析与质量控制 [J].药物分析杂志,2001,21(1):14-6.
[19] 钟雅妮,刘俊华,林小洁,等.HPLC法测定替卡西林钠克拉维酸钾(15∶1)中的高分子杂质[J].药物分析杂志,2011,31(5):874.
[20] 赵晓冬,傅 蓉,王 坚,等.分子排阻色谱法测定注射用头孢呋辛钠舒巴坦钠中的高分子杂质 [J].药物分析杂志,2010,30(1):95-8.
[21] 朱美容,张 莉,刘俊华,等.TSK凝胶色谱法测定头孢地尼中高分子杂质含量 [J].今日药学,2011,21(4):213-6.
[22] Cia SY,Hu CQ,Xu MZ.Chromatographic determination of high-molecularweight impurities in amoxicillin[J].J Pharm Biomed Analy,2003,31(3):589-96.
[23] 国家药典委员会.中华人民共和国药典:二部 [S].北京:中国医药科技出版社,2010.
[24] Society of Japanese Pharmacopoeia.Japanese Pharmacopoeia[S].14 the dition Tokyo:Shibuya,2001:322-4.
[25] 胡昌勤,孙丽丽,金少鸿.β-内酰胺类抗生素在Sephadex G-10凝胶色谱中色谱行为的定量关系[J].药物分析杂志,1997,17(2):78-84.
[26] 胡昌勤,金少鸿.自身对照外标法定量β-内酰胺类抗生素中的高分子杂质 [J].中国抗生素杂志,1997,22(2):23-7.
[27] 蔡珊英,胡昌勤,冯 芳.β-内酰胺抗生素在Superdex peptide凝胶过滤色谱柱上的色谱行为[J].中国抗生素杂志,2002,27(3):157-61;119-22.
[28] 王成刚,王俊秋,张 喆,等.高效分子排阻色谱法测定头孢羟氨苄胶囊中的高分子杂质[J].中国药学杂志,2011,7(46):1027-30.
[29] 金少鸿,胡昌勤,仇士林,等.β-内酰胺类抗生素过敏反应的研究[J]. 医学研究通讯,2002,31(4):22.
[30] 陶 刚.一例奶牛青霉素过敏病例报告[J].中国奶牛,2009,(3):57.
[31] 王金邦,马玉苍.骡青霉素过敏 [J].中国兽医杂志,2002,38(12):15.