不同部位绝对不应期电刺激对正常猪心脏功能的影响
张若兰
(哈励逊国际和平医院心内科,河北衡水 053000)
不同部位绝对不应期电刺激对正常猪心脏功能的影响
张若兰
(哈励逊国际和平医院心内科,河北衡水 053000)
目的探讨正常猪心脏绝对不应期不同部位电刺激对心脏功能的影响及其发生机制,为临床心脏疾病的治疗提供参考。方法12只清洁级小型猪,随机分为对照组、右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组,经颈静脉置入刺激电极,分别检测4组电刺激后相关指标的差异。结果心肌绝对不应期电刺激(absolute refractory period electrical stimulation,ARPES)1h后,右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组收缩压、舒张压、平均动脉压、左心室内压峰值、左心室最大收缩/舒张速度比值、左心室舒张末压、校正后Q-T间期、12导联Q-T间期标准差、12导联中相邻Q-T间期之差的最大值、血清白细胞介素8、肿瘤坏死因子α、高敏C反应蛋白、血清脑钠肽均高于或低于对照组,差异有统计学意义(P<0.05);右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组3组间上述指标差异也具有统计学意义(P<0.05)。结论ARPES能够影响正常心脏的收缩及舒张功能,增强心肌收缩力,改善舒张能力,其可能通过影响心肌细胞的复极过程及调节体内炎性介质和心血管活性物质的表达发挥作用。
电刺激;不应期,电生理学;心脏;猪
心肌细胞和心肌组织的舒缩功能是维持心脏正常生理功能的基础,心肌细胞的机械收缩、舒张功能的实现有赖于其电生理功能的正常,心肌不应期是维持心肌正常舒张及收缩功能的保证,能够避免电冲动引起的强直收缩。目前动物研究结果[1]表明,在心室肌细胞动作电位绝对不应期给予外加的同频率适宜电刺激,可增强单个心室肌细胞缩短幅值,同时缩短和复长速度增加,这与心肌细胞正常的电生理学特征相一致。心肌绝对不应期电刺激(absolute refractory period electricalstimulation,ARPES)可使心肌细胞舒缩能力增强,这一点无疑为提高整体心脏舒缩功能的方法学开辟了一个新领域。迄今为止,虽然有在绝对不应期对心脏电生理干预治疗心脏传导性疾病的研究报道,但其深入机制即血流动力学研究尚少,因此,我们进行实验,探讨绝对不应期内在不同部位对心脏实施外加性电刺激对心脏功能的影响,并结合对细胞因子表达水平的检测,探讨其发挥作用的具体机制,旨在为临床治疗心脏疾病提供参考。
1 材料与方法
1.1 实验动物:清洁级小型猪12只,雌雄不拘,2月龄,体质量(10.0±1.5)kg,动物适应环境后随机分为对照组(先行电刺激检测相关指标),右心室心尖部刺激组,右心室流出道刺激组,左右心室同步刺激组,每组4只。
1.2 方法:各组应用阿托品(0.05mg/kg)、氯胺酮(20mg/kg)、安定(0.05mg/kg)肌内注射先作诱导麻醉。然后在X光机引导下经颈内静脉置入刺激电极,右心室心尖部刺激组电极放置到右心室心尖部,右心室流出道刺激组刺激电极放置到肺动脉根部,左右心室同步刺激组分别放置于左心室后侧壁及右心室心尖部。针灸针刺入四肢末端皮下组织,生理盐水导电,连接体表电极,心电监护仪全程记录心电图变化。采用DF-5A型心脏电生理刺激发放仪以500ms为基础刺激,心电图R期自动发放1 000ms强化刺激,连续刺激1h,分别检测刺激后收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压(mean arterial pressure,MAP)、左心室内压峰值(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左心室最大收缩/舒张速度比值(±dp/dt);计算各组心电图校正后Q-T间期(corrected QT interval,QTc)、12导联Q-T间期标准差(QT interval standard deviation,SDQT)、12导联中相邻Q-T间期之差的最大值(adjacent QT dispersion,ADQTD);采用双抗体夹心法检测血清白细胞介素8(interleukin 8,IL-8)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、高敏C反应蛋白(high sensitivity C reactive protein,hsCRP)浓度变化,采用荧光免疫反应法检测血清脑钠肽(brain natriuretic peptide,BNP)。比较各组间差异。
1.3 统计学方法:应用SPSS13.0统计软件完成数据处理,计量资料以±s表示,组间比较采用方差分析,组间两两比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
ARPES 1h后,右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组SBP、MAP均高于对照组,DBP低于对照组,差异有统计学意义(P<0.05);左右心室同步刺激组SBP、MAP均高于右心室心尖部刺激组及右心室流出道刺激组,DBP低于对照组,差异有统计学意义(P<0.05);右心室心尖部刺激组SBP、DBP、MAP与右心室流出道刺激组比较,差异也有统计学意义(P<0.05)。见表1。
ARPES 1h后,右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组LVSP、±dp/dt均高于对照组,LVEDP低于对照组,差异有统计学意义(P<0.05);左右心室同步刺激组LVSP、±dp/dt均高于右心室心尖部刺激组及右心室流出道刺激组,LVEDP低于右心室心尖部刺激组及右心室流出道刺激组,差异有统计学意义(P<0.05);右心室心尖部刺激组LVSP、±dp/dt高于右心室流出道刺激组,LVEDP低于右心室流出道刺激组,差异有统计学意义(P<0.05)。见表1。
ARPES 1h后,左右心室同步刺激组QTc、SDQT低于右心室心尖部刺激组、右心室流出道刺激组及对照组,差异有统计学意义(P<0.05);右心室心尖部刺激组SDQT低于对照组,差异具有统计学意义(P<0.05);对照组、右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组ADQTD依次降低,差异有统计学意义(P<0.05)。见表1。
ARPES 1h后,右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组血清IL-8、TNF-α、hsCRP均高于对照组,差异有统计学意义(P<0.05);左右心室同步刺激组IL-8、TNF-α、hsCRP均高于右心室心尖部刺激组及右心室流出道刺激组,差异有统计学意义(P<0.05);右心室心尖部刺激组IL-8、TNF-α、hsCRP与右心室流出道刺激组比较,差异也有统计学意义(P<0.05)。右心室心尖部刺激组、左右心室同步刺激组BNP均高于对照组及右心室流出道刺激组,左右心室同步刺激组BNP高于右心室心尖部刺激组,差异有统计学意义(P<0.05)。见表1。
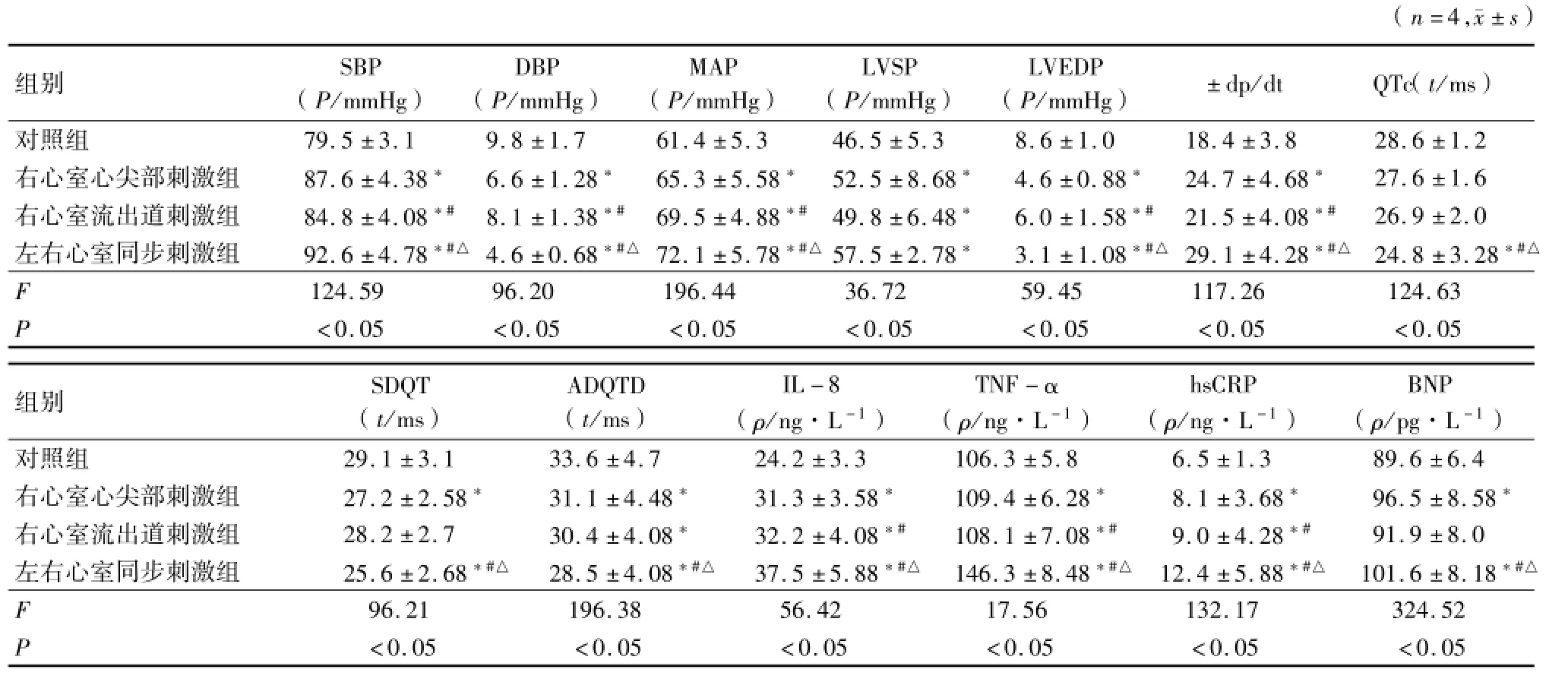
表1 4组SBP、DBP、MAP、LVSP、LVEDP、±dp/dt、QTc、SDQT、ADQTD、IL-8、TNF-α、hsCRP、BNP比较
3 讨 论
近年研究[2]显示,ARPES能够引起局部心肌细胞的收缩力增强,其发生的机制与电刺激对心肌细胞膜的钙离子转运变化有关。对心室肌的细胞实验[3-4]表明,正常心脏心室肌细胞动作电位绝对不应期在基础刺激的前提下给予适宜的强化刺激,可增强心肌细胞收缩力和心肌细胞收缩的长度,同时收缩和复长的速度加快,伴随心肌细胞内游离钙离子浓度增加,其增加的幅度与心肌细胞的收缩舒张速度变化及心肌细胞的收缩率的变化呈正相关,与心肌细胞正常电生理功能一致,说明外加刺激引起的钙离子浓度变化是心肌细胞电生理行为及机械功能变化的基础。对心脏乳头肌细胞的研究[5]证实,心脏收缩的ARPES可增强正常和衰竭心脏乳头肌的收缩力,单个心室肌细胞的舒缩能力的变化直接影响到整体心脏的收缩力。对心力衰竭的心肌细胞研究[6]显示,ARPES能够延心肌衰竭细胞的绝对不应期,该段时间内膜电位绝对值低,钠离子通道完全失活,发生于绝对不应期间的刺激不会引发再次兴奋,也表明ARPES对于心脏功能是安全的,并且证实绝对不应期的延长与2期钙内向离子流增强而延长有关。对心脏的功能研究[7]发现,ARPES能够增强心肌的收缩力,提高心脏左心室的收缩压,提高心脏的泵血功能。本研究结果显示,ARPES 1h后,各刺激组的LVSP、+dp/dt升高,LVEDP降低,表明心肌的收缩及舒张功能增强,而且SBP、MAP升高,DBP下降,表明ARPES引起的心脏功能变化,足以引起外周血流动力学的变化。但值得注意的是,在不同部位给予ARPES,对于心脏功能影响的强度不同,左右心室同步刺激引起的心脏功能的变化比右心室心尖部刺激和右心室流出道刺激更为明显。
本研究结果显示,ARPES 1h后,各组之间的QTc、SDQT、ADQTD存在差异,左右心室同步刺激组QTc、SDQT值最低,左右心室刺激组及右心室心尖部刺激组ADQTD低于对照组,其变化趋势与心功能指标存在同向性。因此,考虑ARPES引起的心功能改变与心肌细胞的生物电变化存在相关性。QT离散度是心肌细胞复极过程不一致性的心电图表现,心肌组织内层与外层细胞之间以及同层的细胞之间复极时限存在细微的差异,T波顶点代表的是心外膜的复极电活动,T波终点代表的是心肌细胞的中层点活动,投射到心电图上,即表现为Q-T间期的时限差异。SDQT是12导联Q-T间期的标准差,SDQT的离散程度能够反映心肌细胞复极的不一致性,左右心室同步刺激组的SDQT减小,说明左右心室同步刺激能够改变心肌细胞复极过程中的时间差异。ADQTC反映的是12导联中Q-T间期的最大差值,能反映局部的复极同步性。QTc是校正后的最大Q-T间期同最小QT间期的差异,能够在总体趋势上反映心肌复极的不一致性[8],左右心室同步刺激组QTc、SDQT、ADQTC均明显减小,低于其他各组,说明ARPES能够纠正正常心脏心肌细胞的的复极不同步性,使心肌细胞的电生理活动时间趋向一致,而心脏收缩期功能是单个细胞收缩功能的总和,心肌细胞的同步收缩,能够增强心脏的收缩功能,提高心脏的泵血功能。
心肌细胞正常生理活动的维持除了与生物电活动有关外,也受体内细胞因子的影响,TNF-α是一种体内广泛分布的多功能细胞因子,由激活的巨噬细胞产生,能够抑制心肌细胞的生长和分化,并能够促进白细胞介素6(interleukin 6,IL-6)等其他细胞因子的释放。心脏是合成TNF-α的主要场所之一,在心脏功能异常时,血清TNF-α表达升高,衰退的心肌表达TNF-α,而正常的心肌不表达,TNF-α具有局部细胞免疫活性作用,能够调节细胞、血管内皮细胞和血管平滑肌的代谢。研究[9-10]显示,TNF-α能够通过与心肌表面的TNFR结合,发挥负性肌力的作用,并且能够直接损伤心肌细胞。有研究[11]显示,TNF-α能够诱导心肌细胞一氧化氮合酶的mRNA表达,增加巨噬细胞、心肌细胞中诱生型一氧化氮合酶的mRNA表达升高,局部或全部心肌的诱生型一氧化氮合酶诱发后,能够诱导一氧化氮合成,发挥对心肌的活性作用。TNF-α能够诱导巨噬细胞对IL-8的释放[2],IL-8能够引发中性粒细胞释放大量氧自由基和花生四烯酸等代谢产物,并能够介导心肌细胞的凋亡,引起心肌损害[12]。CRP是一种急性时相反应蛋白,属于非特异性蛋白质,在组织损伤时多有高表达,CRP水平的升高可抑制血管生成及减少一氧化氮生成,引发心肌细胞坏死及纤维化等病理变化[10]。本研究结果显示,右心室心尖部刺激组、右心室流出道刺激组、左右心室同步刺激组TNF-α、IL-8、hsCRP均出现高表达,其中左右心室同步刺激组表达水平最高,考虑其可能与ARPES引发的心肌细胞损伤有关,但目前尚缺乏足够的证据,有待于进一步研究。
BNP主要由心脏合成和分泌,是一种心脏神经激素,主要来源于心室[13],只有在血容量增加和力超负荷的情况下才反应性地从心肌细胞内分泌。有研究[14-15]显示,对离体大鼠心肌细胞给予BNP治疗可以降低心肌肌浆网钙三磷酸腺苷酶的表达。本研究中BNP水平升高可能与心肌收缩力增强有关,其机制尚有待于进一步探讨。
[1] 赵晓静,崔长琮.绝对不应期电刺激对健康和衰竭豚鼠心室肌细胞舒缩及钙瞬变的影响[J].西安交通大学学报:医学版,2003,24(6):575-577.
[2] CALLANSDJ,FUCHSS,MIKA Y,et al.Global improvement in left ventricular perform ance observed with cardiac contractility mod ulation is the result of changes in regional contractility[J]. Heart Fail Rev,2001,6(1):35-44.
[3] DOGRU MT,SIMSEK V,SAHIN O,et al.Differences in automatic activity in individualswith optimal,normal,and highnormal blood pressure levels[J].Turk Kardiyol Dern Ars,2011,38(3):182-188.
[4] BURKHOFFD,FELZEN B,SHIMIZU J,et al.Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo[J].Heart Fail Rev,2001,6(1):27-34.
[5] 舒娟,赵晓静,王东琦,等.绝对不应期电刺激对心力衰竭豚鼠心室肌细胞钙离子流的影响[J].中国心脏起搏与心电生理杂志,2006,20(2):160-163.
[6] 赵晓静,张海柱,周忠,等.绝对不应期电刺激对健康兔心肌收缩功能的影响[J].西安医科大学学报,2002,23(2):113.
[7] 余盛华,李丽华,李世春.冠心病患者QT离散度变化及意义[J].山东医药,2009,49(15):105.
[8] BRADHAM WS,MOE G,WENDT KA,et al.TNF-alpha and myocar,dial matrix metalloproteinases in heart failure: relationship to LV remodeling[J].Am J Physiol Heart Circ Physiol,2002,282(4):1288-1295.
[9] TORRE-AMINOE G,KAPADIA S,LEE J,et al.Expression and functional significance of turor necrosis factor receptors in human myoeardium[J].Circulation,1995,92(6):1487-1493.
[10] MANABE I.Inflammatory process in atherosclerosis[J].Nippon Rinsho,2011,69(1):13-17.
[11] RUIXING Y,WENWU L,AI-GHAZALI R.Trimetazidine inhibits cardiomyocyte apoptosis in a rabbitmodel of ischemiarepefusion[J].Transl Res,2007,149(3):152-160.
[12] PAGLER TA,WANGM,MONDAL M,et al.Deletion of ABCA1 and ABCG1 impairsmacrophage migration because of increased Rac1 signaling[J].Circ Res,2011,108(2):194-200.
[13] 杨跃进.B2型利钠肽在心力衰竭诊断和治疗中的应用[J].中国循环杂志,2004,19(2):83-85.
[14] LIU Y,HUANG H,XIA W,et al.NADPH oxidase inhibitio ameliorates cardiac dysfunction in rabbitd with heart failure[J]. Mol Cell Biochem,2010,343(1/2):144-153.
[15] LIPSKAIA L,CHEM ALY ER,HADRI L,et al.Sarcoplasmic reticulum Ca2+ATPase as a therapeutic for heart failure[J]. Expert Opin Biol Ther,2010,10(1):29-41.
(本文编辑:刘斯静)
R331.38
B
1007-3205(2012)08-0923-04
2012-02-13;
2012-05-17
张若兰(1980-),女,河北衡水人,哈励逊国际和平医院主治医师,医学硕士,从事心血管疾病诊治研究。
10.3969/j.issn.1007-3205.2012.08.018

