神经肽
——抑郁症治疗的新靶标
郭庆军,尹 希(综述),史海水(审校)
(1.河北医科大学外科学总论教研室,河北石家庄 050017;2.河北医科大学第四医院功能科,河北石家庄 050011;3.河北医科大学基础医学院生物化学与分子生物学教研室,河北石家庄 050017)
神经肽
——抑郁症治疗的新靶标
郭庆军1,尹 希2(综述),史海水3*(审校)
(1.河北医科大学外科学总论教研室,河北石家庄 050017;2.河北医科大学第四医院功能科,河北石家庄 050011;3.河北医科大学基础医学院生物化学与分子生物学教研室,河北石家庄 050017)
抑郁症;应激;神经肽类;综述文献
抑郁症是一种严重危及人类身心健康的精神疾病,主要表现为快感缺乏、兴趣丧失,伴有焦虑、睡眠障碍等其他不同程度的心理和(或)躯体症状。抑郁症发病原因复杂,症状多样,发病机制至今未明[1]。神经肽(neropeptide)又称作脑-肠肽(brain-gut peptide),是一类主要存在于中枢神经系统和外周的小分子活性多肽,扮演着神经激素、神经递质、细胞因子和生长因子等多种角色,广泛参与应激反应、睡眠、情绪、痛觉、学习与记忆、免疫乃至神经分化和发育等生理病理过程[2]。以神经肽作为靶点进行抗抑郁治疗有望突破现有抗抑郁药物的局限性,成为抑郁症发病机制研究和开发新型抗抑郁药物的重要方向。
1 抑郁症的发病机制
抑郁症症状多变、病因复杂。目前认为,抑郁症发生是遗传因素和环境因素共同作用的结果,环境因素起着“扳机”的作用,抑郁症患者发病前大多有重要的生活事件。动物实验研究[1]表明,早期负性生活事件、不良经历(应激、母爱剥夺、饥饿等)均能诱发抑郁症。抑郁症涉及包括海马、皮层、杏仁核、下丘脑等多个脑区,共同组成了情绪调节的神经回路。
抑郁症的发病机制存在多种假说,主要包括神经元再生损伤假说、神经生长因子假说、下丘脑-垂体-肾上腺轴负反馈失调假说等。现有假说从不同层次、不同侧面解释了抑郁症的发生,但均不能全面阐述该病的发病机制:一方面,应激引起下丘脑-垂体-肾上腺轴活性增加和海马脑区神经营养因子损伤,进而引起海马神经发生损伤,诱发抑郁样行为;另一方面,长期抗抑郁药物、运动、电惊厥疗法(electro convulsive treatment,ECT)等通过改善海马神经营养因子损伤、促进海马神经发生,逆转抑郁样行为(图1)。目前抑郁症治疗主要以药物为主,尽管已有的抗抑郁药物治疗能缓解抑郁症状,但仍存在很大局限性,主要包括起效时间延迟(数周甚至数月)、不良反应大、断药后病情易复发和长期应用易产生耐受性等。开发快速、高效、安全的新型抗抑郁药物成为国内外研究的难点,内源性活性分子、细胞膜受体、胞内信号分子等成为研究靶标[3]。
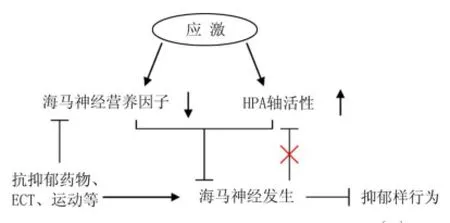
图1 应激诱导的抑郁行为发生机制示意图[4]
2 抑郁症相关的神经肽
神经肽,作为一类内源性小分子活性肽,在体内发挥广泛而又重要的调节作用,主要包括学习、记忆、情绪、应激反应、睡眠、摄食、免疫等,与抑郁症的发生发展关系密切[5-6]。
2.1 促肾上腺皮质激素释放激素(corticotropinreleasing factor,CRF):CRF是41肽,在下丘脑室旁核的小细胞含量最高,视上核、视交叉上核、视前核、乳头体核、室周核、弓状核和室旁核的大细胞部分以及大脑皮层、海马、小脑、丘脑、脑干中缝核和蓝斑也存在CRF表达[7]。童年时期的不幸经历如受虐或被忽视,成年后CRF水平较正常者高,且对抑郁症的易感性增加。抑郁症患者脑脊液中CRF的含量高于正常者,抑郁症患者的CRFmRNA表达也比正常人多,经抗抑郁药治疗后,随着抑郁症状的改善,脑脊液中CRF水平趋于正常。抑郁患者CRF神经元数量以及CRFmRNA表达均较高,提示抑郁症患者HPA轴功能异常。
2.2 促肾上腺皮质激素(adrerrmrticotropic hormone,ACTH):ACTH是腺垂体分泌的39肽肽类激素,抑郁症小鼠模型出现HPA轴持续活化现象,在长期活化过程中,ACTH对外源CRF的反应显得很迟钝,这是抑郁患者HPA轴异常的表现之一。Young等[8]报道,阻断肾上腺可的松分泌的药物可以使该反应恢复,说明ACTH分泌迟钝可能是皮质酮水平升高所致,也可能是长期的CRF功能亢进导致了CRF受体功能下降。
2.3 神经肽Y(neuropeptide Y,NPY):NPY是36肽,由于该肽类仅在神经元中表达且末端为酪氨酸(编码氨基酸的首字母为Y),故而得名。NPY主要分布在边缘系统和神经内分泌系统,以海马内浓度最高。NPY在边缘系统具有控制情绪整合的作用[9]。抑郁症患者脑脊液中NPY的浓度明显降低。抑郁症大鼠海马NPY表达下降。应用抗抑郁药可明显提高额叶和下丘脑NPY浓度。锂盐、抗抑郁剂或电休克处理后,正常大鼠纹状体NPY浓度及其mRNA水平也相应增加。抗抑郁药氟西汀引起NPY浓度增加的作用与NPY受体Y1有关,而与Y2无明显关系。脑室注射NPY能够降低强迫游泳实验中小鼠的不动时间,具有显著的抗抑郁样作用。抗抑郁药物和NPY可能通过共同的通路介导抗抑郁效应,提示NPY系统作为应激相关的焦虑和抑郁治疗的潜在靶标[10]。
2.4 甘丙肽(galanin,GAL):甘丙肽是由29~30个氨基酸残基组成的多肽,因其分子结构中N末和C末端分别由甘氨酸和丙氨酸残基组成而得名。GAL广泛存在于人和哺乳动物的胃肠道等外周神经系统、中枢神经系统和内分泌系统。表达GAL的中枢神经系统包括下丘脑、海马、杏仁核、中缝背核、前脑基底皮层、室下带、嗅球以及脊髓背根神经节等。GAL与5-羟色胺和NE神经递质系统共定位,并对后两者进行调节。GAL受体包括GALRl、GALR2和GALR3,主要定位于下丘脑、中缝背核和蓝斑。GAL通过其受体介导而广泛参与认知、记忆、痛觉、情绪、摄食活动、神经内分泌调节以及神经性障碍等。
关于GAL的功能研究存在差异脑室或腹侧背盖区注射GAL能显著增加强迫游泳实验中的大鼠不动时间,前者致抑郁效果可被GAL非选择性受体拮抗剂阻断。GAL的致抑郁作用可能与其抑制中脑边缘多巴胺神经元活性进而降低伏隔核多巴胺释放有关。刺激GAL1或GAL3受体也可引起抑郁样行为,GAL3拮抗剂SNAP37889可降低强迫游泳实验中大鼠的不动时间,增加游泳时间。而腹腔注射GAL非肽类激动剂galnon能够降低强迫游泳实验中的不动时间,表现出抗抑郁作用。Christianse等[11]发现电惊厥刺激能影响小鼠不同脑区GAL及其受体的表达。静脉给予GAL具有快速抗抑郁效果,并且能增加快动眼睡眠的潜伏期。
2.5 P物质(substance P):P物质是11肽,与神经激肽A、神经激肽B共同组成哺乳动物的速激肽家族,通过G蛋白偶联速激肽受体广泛参与炎症、疼痛、消化道和呼吸道功能调节、应激等生理病理过程。重症抑郁患者脑脊液中P物质含量增加;动物研究[12]提示,持续阻滞激肽受体可增强5-羟色胺及NE神经传递功能,这种作用很可能与其抗抑郁作用有关。
2.6 精氨酸加压素(arginine vasopressin,AVP):AVP是第1个被发现的环肽,含有9个氨基酸残基,主要分布于下丘脑视上核和室旁核的大细胞性神经元以及室旁核的小细胞性神经元,从大细胞性神经元合成的AVP可经过垂体前叶释放入血,通过体循环调节外周系统。AVP的主要通过协同CRF作用易化ACTH调节HPA轴的功能,室旁核AVP能神经元与精氨酸加压素参与情绪和社会行为的调节,主要包括攻击、社会行为、记忆、应激、焦虑和抑郁等行为。抑郁症患者血中AVP含量升高,这种升高能够被抗抑郁药物治疗所逆转。抑郁症患者下丘脑室旁核增多CRF释放神经元中AVP表达神经元也显著增加。不同脑区(杏仁核、侧间隔)急性给予或长期腹腔注射AVP1b受体拮抗剂(SSR149415)均能够显著降低强迫游泳测试中大鼠的漂浮不动时间。2.7 催产素(oxytocin):催产素是由下丘脑室旁核(paraventricular nucleus,PVN)和视上核(supraoptic nucleus)大细胞性神经元分泌的包含9个氨基酸残基的环肽,下丘脑脑区神经元投射非常广泛,可投射到包括海马、丘脑、杏仁核和中脑的蓝斑核(locus coeruleus)和脊核(raphe nucleus)。重性抑郁患者脑脊液中催产素水平增加,而外周血中催产素水平差异无统计学意义,每天鼻吸催产素能显著改善抑郁症状[13]。重性抑郁患者血中催产素水平与其焦虑评分呈负相关。催产素与抑郁症之间存在关联,给予动物应激知觉刺激能增加血中和脑脊液中催产素含量,而急性腹腔注射0.25~1.0mg/kg催产素能显著降低强迫游泳中大鼠的漂浮不动时间。慢性给药表现出更强的药效,利用习得性无助模型,连续8d 0.5mg/kg腹腔注射具有显著的抗抑郁效果。中枢或系统给予催产素能显著降低小鼠悬尾不动时间,但这种效应不能被催产素受体抑制剂WAY-162720抑制,而催产素受体激动剂能明显减轻动物焦虑行为。和野生型小鼠相比,心理应激能更显著增加催产素基因敲除小鼠的焦虑行为[14]。
2.8 瘦素(leptin):瘦素又叫消脂素,是一类由肥胖基因编码的肽类激素,相对分子质量为16 000,主要由脂肪细胞表达,能够通过特定的渗透机制穿越血脑屏障发挥其中枢调节作用。瘦素通过不同组织表达的多种形式的瘦素受体,向中枢和外周多个位点传递信号,与下丘脑-垂体-靶腺轴组成闭合的双向环路参与机体多种生理功能和代谢通路的调节。除白色脂肪组织外,脑组织也是瘦素合成的场所之一,瘦素作为神经肽可以在中枢神经系统合成和释放,以负反馈的方式调节神经元的兴奋性和突触功能。Gayza等[15]通过建立慢性应激大鼠模型,发现长期慢性应激可降低大鼠血中瘦素水平,外周和中枢给予瘦素可以逆转由CUS导致的快感缺失、行为绝望和神经再生的损伤。前脑谷氨酸能神经元介导了瘦素抗抑郁的作用过程[16]。
2.9 促食素(ghrelin):促食素是28肽,主要是由胃肠内分泌细胞合成,促食素可以通过活化生长激素促泌素受体(growth hormone secratgogue receptor,GHSR)诱导潜在的摄食行为。其受体广泛分布于下丘脑、垂体、海马、腹测被盖区、黑质(substantia,SN)、背缝神经核等。促食素广泛参与了学习记忆、奖赏与动机、焦虑、抑郁和神经保护作用的调节[17-18]。抑郁症患者血中促食素水平下降,西酞普兰治疗能增加抑郁症患者血中促食素水平。Lutter等[19]利用EPM和FST动物模型研究发现,采用皮下注射促食素或者热量摄入限制的方法能产生抗焦虑和抑郁效果,长期社会失败应激(chronic social defeat stress,CSDS)能增加促食素的水平,Ghsr基因敲除小鼠表现为对慢性应激的反应增强,提示促食素与慢性应激诱发的抑郁症的发生发展密切相关。
2.10 阿立新(orexin):最早被认定为是两类孤儿G蛋白耦联受体的配基多肽,主要由肽段裂解翻译后加工修饰而成。该家族主要包括2个成员,orexin-A(OX-A)、orexin-B(OX-B)。临床研究表明,重症抑郁患者脑脊液中orexin含量降低[20]。在强迫游泳大鼠试验中,脑室内注射OX-A具有抗抑郁样作用,这种作用可能与其促进海马齿状回神经元细胞增殖有关[19]。长期社会失败应激通过表观遗传机制下调orexin前体蛋白mRNA表达[21]。
2.11 其他:除上述外,生长抑素,胆囊收缩素,β-内啡肽,孤啡肽,血管生长因子、表皮生长因子、血管表皮生长因子等与抑郁症密切联系[22-23]。
3 展 望
尽管已有充足的证据表明神经肽在抑郁症发病过程中发挥重要作用,以神经肽为靶点的抗抑郁药物开发业已展开,但问题依然存在:①某些神经肽对抑郁症发生发展的研究结果不一致;②神经肽与5-羟色胺、NE等神经递质的关系仍不完全清楚;③与抑郁症关系密切的新的神经肽及其功能需要明确;④神经肽参与抑郁症发生尤其是发挥快速抗抑郁作用的分子机制亟待阐明。以上问题的解决,对于揭示抑郁症发生本质和开发高效、快速的新型抗抑郁药物至关重要。
[1] KRISHNAN V,NESTLER EJ.Linking molecules to mood:new insight into the biology of depression[J].Am JPsychiatry,2010,167(11):1305-1320.
[2] ALLDREDGE B.Pathogenic involvement of neuropeptides in anxiety and depression[J].Neuropeptides,2011,44(3):215-224.
[3] LIN,LEE B,LIU RJ,etal.mTOR-dependentsynapse formation underlies the rapid antidepressant effects of NMDA antagonists[J].Science,2010,329(5994):959-964.
[4] KUNUGI H,HORI H,ADACHI N,et al.Interface between hypothalamic-pituitary-adrenal axis and brain-derived neurotrophic factor in depression[J].Psychiatry Clin Neurosci,2010,64(5):447-459.
[5] 王韶轩,王金轩.脑肠肽与消化及神经系统基础与临床[M].济南:山东大学出版社,2010:93-142.
[6] SQUIRE LR.神经科学百科全书:神经肽与神经营养因子[M].北京:科学出版社,2010:42-132.
[7] DE SOUZA EB,INSEL TR,PERRIN MH,et al.Corticotropinreleasing factor receptors are widely distributed within the rat central nervous system:an autoradiographic study[J].J Neurosci,1985,5(12):3189-3203.
[8] YOUNG EA,RIBEIRO SC.Sex differences in the ACTH response to 24hmetyrapone in depression[J].Brain Res,2006,1126(1):148-155.
[9] GARCIA FD,COQUEREL Q,DO REGO JC,et al.Antineuropeptide Y plasma immunoglobulins in relation to mood and appetite in depressive disorder[EB/OL].[2012-02-23]. http://www.sciencedirect.com/science/article/pii/ S0306453012000522.
[10] WU G,FEDER A,WEGENER G,et al.Central functions of neuropeptide Y in mood and anxiety disorders[J].Expert Opin Ther Targets,2011,15(11):1317-1331.
[11] CHRISTIANSEN SH.Regulation of the galanin system in the brainstem and hypothalamus by electroconvulsive stimulation inmice[J].Neuropeptides,2011,45(5):337-341.
[12] BLIER P,GOBBIG,HADDJERIN,et al.Impact of substance P receptor antagonism on the serotonin and norepinephrine systems:relevance to the antidepressant/anxiolytic response[J].J Psychiatry Neurosci,2004,29(3):208-218.
[13] OZSOY S,ESEL E,KULA M.Serum oxytocin levels in patients with depression and the effects of gender and antidepressant treatment[J].Psychiatry Res,2009,169(3):249-252.
[14] ROTZINGER S,LOVEJOY DA,TAN LA.Behavioral effects of neuropeptides in rodent models of depression and anxiety[J]. Peptides,2010,31(4):736-756.
[15] GARZA JC,GUO M,ZHANG W,et al.Leptin restores adult hippocampal neurogenesis in a chronic unpredictable stressmodel of depression and reverses glucocorticoid-induced inhibition of GSK-3beta/beta-catenin signaling[EB/OL].[2011-12-21].http://www.nature.com/mp/journal/vaop/ncurrent/full/ mp2011161a.htm l.
[16] GUOM,LU Y,GARZA JC,etal.Forebrain glutamatergic neurons mediate leptin action on depression-like behaviors and synaptic depression[J].Transl Psychiatry,2012,2.pii:e83.
[17] CARLINIVP,MACHADO DG,BUTELER F,et al.Acute ghrelin administration reverses depressive-like behavior induced by bilateral olfactory bulbectomy in mice[J].Peptides,2012,35(2):160-165.
[18] FRAGO LM,BAQUEDANO E,ARGENTE J,et al. Neuroprotective actions of ghrelin and growth hormone secretagogues[EB/OL].[2011-09-28].http://www. frontiersin.org/Molecular_Neuroscience/10.3389/fnmol.2011. 00023/abstract.
[19] LUTTER M,KRISHNAN V,RUSSO SJ,et al.Orexin signaling mediates the antidepressant-like effect of calorie restriction[J]. JNeurosci,2008,28(12):3071-3075.
[20] BRUNDIN L,BJORKQVIST M,PETERSEN A,et al.Reduced orexin levels in the cerebrospinal fluid of suicidal patients with major depressive disorder[J].Eur Neuropsychopharmacol,2007,17(9):573-579.
[21] LUTTER M,SAKATA I,OSBORNE-LAWRENCE S,et al.The orexigenic hormone ghrelin defends against depressive symptoms of chronic stress[J].Nat Neurosci,2008,11(7):752-753.
[22] ELSAYED M,BANASR M,DURIC V,et al.Antidepressant effects of fibroblast growth factor-2 in behavioral and cellular models of depression[EB/OL].[2012-04-10].http://www. biologicalpsychiatryjournal.com/article/S0006-3223(12)00219-3/abstract.
[23] FOURNIERNM,DUMANRS.Role ofvascularendothelialgrowth factor in adult hippocampal neurogenesis:implications for the pathophysiology and treatment of depression[J].Behav Brain Res,2012,227(2):440-449.
(本文编辑:刘斯静)
R749.42
A
1007-3205(2012)08-0985-04
2012-02-22;
2012-05-15
郭庆军(1981-),男,河北沧州人,河北医科大学助教,医学学士,从事外科学总论教学研究。
*通讯作者。E-mail:shshhdsh@163.com
10.3969/j.issn.1007-3205.2012.08.046

