血红素加氧酶-1在门静脉高压性胃病大鼠中的表达及意义
路新卿,刘志军,李桂英,李校天,姜慧卿
(1.河北工程大学附属医院消化内科,河北邯郸 056002;2.河北医科大学第二医院消化内科,河北石家庄 050000)
血红素加氧酶-1在门静脉高压性胃病大鼠中的表达及意义
路新卿1,刘志军1,李桂英1,李校天1,姜慧卿2*
(1.河北工程大学附属医院消化内科,河北邯郸 056002;2.河北医科大学第二医院消化内科,河北石家庄 050000)
目的探讨血红素加氧酶-1(heme oxygenase 1,HO-1)在门静脉高压性胃病(portal hypertensive gastropathy,PHG)大鼠中的表达以及一氧化碳(carbonmonoxide,CO)在PHG中的可能作用。方法将SD大鼠随机分成PHG组(n=16)与假手术组(n=12),采用HE染色观察胃黏膜组织的形态学表现,八道生理记录仪测量门静脉压力(portal venous pression,PVP),中性红清除率方法测量胃黏膜血流量(gastric mucosal blood flow,GMBF),应用免疫组织化学测定HO-1的表达定位,Western blot方法测定HO-1蛋白含量。结果PHG大鼠在光镜下可见胃黏膜层毛细血管扩张,管腔内有大量红细胞,同时有大量红细胞逸出血管外;黏膜基底层和黏膜下层微静脉管壁增厚,管腔明显扩大,无炎症细胞浸润;与假手术组相比,PHG组PVP水平显著增高[(16.02±2.78)mmHg vs(7.83±1.05)mmHg,P<0.01],PHG组GMBF也显著增加[(10.36±8.30)m L/h vs(4.68±3.88)mL/h,P<0.05];PHG大鼠HO-1阳性细胞明显增多,HO-1主要在胃黏膜固有层表达;HO-1蛋白的表达水平比假手术组亦明显升高;胃黏膜HO-1蛋白表达量与GMBF呈正相关(r=0.564,P<0.05)。结论HO-1在PHG大鼠中表达明显增高,参与了PHG的发生。
高血压,门静脉;血红素加氧酶-1;一氧化碳;大鼠
门静脉高压性胃病(portal hypertensive gastropathy,PHG)是肝硬化的常见并发症,其产生机制尚不十分清楚,除门静脉高压(portal hypertension,PHT)外,可能与扩血管物质增多而引起血管扩张有关[1]。一氧化碳(carbon monoxide,CO)是继一氧化氮(nitric oxide,NO)之后又一新的细胞信使分子,生理作用类似NO,可介导多种病理、生理过程,它由血红素加氧酶(heme oxygenase,HO)催化血红素降解过程中产生,在细胞功能和通讯的调节中发挥着信号转导作用[2]。目前认为NO参与了PHG的形成,而CO是否参与了PHG的发生,目前尚乏研究。本文通过对PHG大鼠胃组织HO-1的表达及血流动力学指标的研究,旨在探讨HO-1在PHG中的作用。
1 材料与方法
1.1 实验动物:纯种、雄性、健康Sprague Dawley大鼠,体质量250~300g,由河北医科大学实验动物中心提供,医动字第04057号。随机分为2组,假手术组12只;PHG组16只。按清洁大鼠的要求饲养,自由进食水,实验前禁食24h,但不禁水。
1.2 PHG大鼠模型的制备:按照段进东等[3]方法建立PHG模型,具体方法操作如下。盐酸氯氨酮腹腔注射麻醉大鼠,给药剂量为100mg/kg;无菌条件下做腹正中切口,暴露并游离门静脉主干;PHG组沿其纵轴方向外置20G的钝性针头,于近肝门处用
3.0丝线结扎门静脉主干及外置针头后,拔出针头,复位内脏,逐层缝合腹壁切口。假手术组仅游离门静脉主干,不结扎,余步骤同PHG组。手术2周后进行各项指标实验测定。
1.3 实验试剂与主要仪器:兔抗大鼠HO-1多克隆抗体为北京中山生物技术公司产品,兔SP试剂盒购自北京中山生物技术公司,中性红购自上海试剂二厂。八道生理记录仪购自中国成都,微量注射泵为德国产品,DYY-Ⅲ28C垂直电泳槽和DYY-Ⅲ40B垂直转膜槽为北京市六一仪器厂产品。
1.4 门静脉压力(portal venous pressure,PVP)测定:大鼠禁食24h后,经盐酸氯胺酮腹腔麻醉后,腹正中切口进入腹腔,分离门静脉主干及回结肠静脉,应用一细塑料管经回结肠静脉插入门静脉主干,另一端连接八道生理记录仪,测量PVP。
1.5 胃黏膜血流量(gastric mucosal blood flow,GMBF)测定:沿左腹股沟切开皮肤及皮下组织,分离股动、静脉,用一细塑料管插入股静脉,接微量输液泵,供输注中性红溶液用。同时经十二指肠向胃插入另一细塑料管,收集胃液0.5m L,作为空白对照。然后从股静脉注射中性红(4mg/kg)2m L,约4min,再以恒速输注维持量中性红(4mg·kg-1· h-1),收集胃液,15min收集1次,共8次。实验末收集血液4mL。采用中性红清除率方法测定GMBF[4],测定收集的胃液和血液标本中的中性红浓度,计算胃黏膜对中性红的清除率。计算公式,GMBF=单位时间胃液分泌量×胃液中性红浓度/血液中性红浓度。
1.6 形态学检查:胃组织用中性福尔马林固定,常规制成石蜡切片,行苏木素-伊红染色,光镜下观察胃黏膜的形态学改变。
1.7 免疫组织化学染色检测:石蜡包埋的胃组织以5μm的厚度连续切片→二甲苯脱蜡,酒精梯度水化→3%H2O2室温孵育30min→0.01mol/L枸橼酸盐缓冲液(pH6.0)抗原修复→10%正常山羊血清封闭→滴加特异性HO-1抗体,4℃过夜→滴加生物素化二抗→滴加1∶200稀释的过氧化物酶标记的链霉亲和素→二氨基联苯胺-H2O2显色→苏木素复染→酒精脱水,二甲苯透明,中性树胶封片。以磷酸缓冲盐溶液(phosphate-buffered saline,PBS)代替一抗进行上述染色作为空白对照,结果为阴性。棕褐色为阳性染色。
1.8 Western blot分析:①胃组织蛋白提取,取100mg胃体组织,用冰冷的PBS漂洗2次,置于匀浆管中,加入1mL改良的RIPA裂解缓冲液(50mmol/L Tris-HCl,pH 7.5;150mmol/L NaCl;1%多聚仙梨醇;0.5%脱氧胆酸钠;0.1%SDS;1mmol/L乙二胺四乙酸;100mg/L PMSF;10mg/LLeupeptin;100mmol/L原钒酸钠),制成匀浆,冰上静置30min,4℃10 000g离心10min,取上清采用考马斯亮蓝G-250法测定蛋白含量。②SDS-聚丙烯酰胺凝胶电泳和印迹,以150μg/孔上样,在10% SDS-聚丙烯酰胺凝胶电泳中进行凝胶分离,电转移法将蛋白质从SDS-聚丙烯酰胺凝胶转移至硝酸纤维素膜,在含5%脱脂奶粉的Tween20-Tris缓冲盐溶液(tween20 tris buffered saline,TTBS)中37℃封闭过夜,加入兔抗大鼠HO-1抗体(1∶500),4℃孵育过夜,TTBS充分漂洗(10min×3次),加入辣根过氧化物酶标记的兔抗山羊IgG二抗(1∶5 000),室温孵育2h,TTBS充分漂洗(10min×3次),ECL显色后观察。
1.9 统计学方法:应用SPSS10.0软件进行统计分析,计量资料以±s表示,组间比较采用t检验;两参数之间关系采用直线相关回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PHG胃黏膜大体形态变化:沿胃大弯打开胃腔,若发现胃黏膜有散在的红点和小瘀斑,即认为黏膜损伤阳性;假手术组12例中仅1例黏膜损伤阳性,而PHG组18例中有10例黏膜损伤阳性,PHG大鼠胃黏膜损伤率明显高于假手术组。见表1。

表1 2组大鼠胃黏膜损伤比较Table 1 Com parion of gastric mucosa injury between sham-operated and portal hypertensive rats
2.2 血流动力学指标测定:①PHG大鼠PVP为(16.02±2.78)mmHg,假手术组为(7.83±1.05)mmHg,PHG大鼠组PVP明显高于假手术组(P<0.01)。②PHG大鼠GMBF为(10.36±8.30)mL/h,假手术组为(4.68±3.88)mL/h,PHG大鼠组GMBF明显高于假手术组(P<0.05)。
2.3 胃组织学表现:光镜下,可见PHG大鼠胃黏膜层毛细血管扩张,腔内有大量红细胞,并有大量红细胞逸出血管外;黏膜肌层和黏膜下层微静脉管壁增厚,管腔明显扩大;黏膜下层增厚,无炎症细胞浸润(图1)。

图1 假手术组和门脉高压性胃病组大鼠的组织学变化(HE×100)A.假手术组;B.门脉高压性胃病组Figure 1 Histopathological feature changes in gastricmucosa of shamoperated and portal hypertensive rats(HE×100)A.Sham operated group;B.PHG group
2.4 HO-1在胃组织中的免疫组织化学定位:正常大鼠胃组织中仅在黏膜层有少量表达,而在PHG大鼠HO-1阳性细胞明显增多,主要在黏膜固有层表达。PHG大鼠胃组织HO-1的阳性面积(45.60±9.17)%显著高于假手术组(11.70± 3.89)%(P<0.05),见图2。
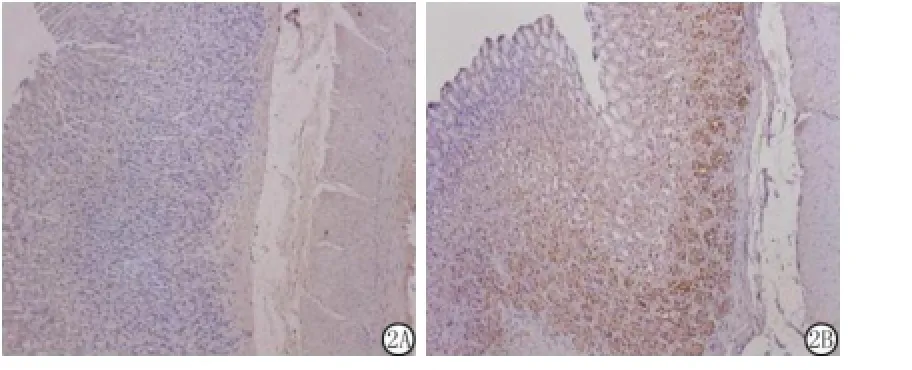
图2 HO-1在假手术组和门脉高压性胃病组大鼠的组织中的免疫组织化学表达(DAB×100)A.假手术组;B.门脉高压性胃病组Figure 2 The expression of HO-1 in gastric mucosa from shamoperated and portal hypertensive rats by immunohistochemistry(DAB× 100)A.Sham operated group;B.PHG group
2.5 HO-1在胃组织中的表达:从杂交信号的强度便知,PHG组HO-1的蛋白表达明显高于假手术组,见图3。

图3 HO-1在假手术组和门脉高压性胃病组大鼠的组织中的蛋白表达Control:假手术组;PHG:门脉高压性胃病组Figure 3 The expression of HO-1 protein in sham-operated and portal hypertensive ratsControl:Sham operated group;PHG:PHG group
2.6 胃黏膜HO-1表达量与胃黏膜血流量的相关性:通过相关回归发现HO-1与GMBF呈显著性正相关(r=0.564,P<0.05),直线回归方程为y= 0.008 7x+0.363 7。表明随着HO-1蛋白表达增加,GMBF增高亦愈明显。
3 讨 论
CO是继NO之后又一重要的第二信使介质,参与神经冲动的传递、松弛血管平滑肌及阻止血小板聚集等生理作用[5]。内源性CO有2种来源:一种为有机物的氧化(如生物膜的脂质过氧化);另一种为血红素的生理降解,此为CO的主要来源。血红素在HO的作用下,生成等摩尔数的CO、Fe和胆绿素,后者很快还原为胆红素。HO是微粒体酶,已发现有HO-1、HO-2和HO-3三种亚型。HO-1为诱导型,是在缺氧、内毒素、NO、肿瘤坏死因子[6]等作用下产生;HO-2为结构型,主要分布在脑组织及肝脏中,调节神经递质的释放及维持肝窦的低张力状态;HO-3功能尚不清楚。
Godn等[7]研究发现,在肝脏受到损伤时,HO-1表达明显增多,同时CO浓度也升高。已有研究证实CO是肝窦的主要生理调节介质,为一内源性舒张因子,能明显降低肝窦的紧张度,对维持肝脏血流发挥重要作用[8]。有研究[9]表明,在PHT动物模型中,小肠、肠系膜及大肠等组织HO-1也呈高表达,导致其下游产物CO生成增加,在PHT高血流动力学紊乱中起着一定作用。而应用HO-1的抑制剂N-乙酰半胱氨酸抑制CO的合成,可以防止肝硬化门静脉高压高动力循环状态的发生[10]。因此,CO具有明显扩张血管的作用。本研究结果显示,PHG大鼠黏膜层毛细血管明显扩张,且PVP、GMBF水平同时升高,表明PHG存在高灌注状态。免疫组织化学及Western blot结果显示,HO-1在PHG大鼠中表达明显增高。HO-1的表达升高,导致其下游产物CO生成增多,CO可以直接引起胃黏膜血管扩张,而且增多的CO可使血管对收缩物质敏感性下降,抑制了后者收缩血管的作用。因此,作为血管扩张剂的CO能够部分解释PHG胃黏膜和黏膜下血管扩张这种形态学和血流动力学的改变。
本研究还显示,GMBF与HO-1的表达量呈明显正相关,支持胃黏膜组织HO-1增加有可能导致GMBF增多和紊乱的观点。同时由于PHG胃组织动静脉交通支开放,GMBF增加,黏膜处于缺氧状态,使HO-1蛋白表达升高,CO生成增多,后者使血管扩张,PHG加重,形成一种恶性循环状态。因此,CO促进了PHG的发展。
CO的作用机制基本同NO,激活可溶性鸟苷酸环化酶,使环磷酸鸟苷升高,产生平滑肌松弛等生理效应[9];此外还可通过调节K+通道的活性传递生理信息。CO过量产生的原因尚不清楚,可能由于PHG时,NO升高[11]、缺氧等刺激使HO-1表达升高,其下游产物CO可能相应增加,当然关于CO的确切作用还有待进一步研究。
[1] SUEMATSU M,ISHIMURA Y.The heme oxygenase-carbon monoxide system:a regulator of hepatobiliary function[J]. Hepatology,2000,31(1):3-6.
[2] ZHU X,FANWG,LIDP,et al.Heme oxygenase-1 system and gastrointestinal inflammation:a short review[J].World J Gastroenterol,2011,17(38):4283-4288.
[3] 段进东,管洪庚,陈易人,等.一期门静脉缩窄法复制大鼠门静脉高压性胃病模型[J].中华实验外科杂志,2000,17(4):356-357.
[4] 乐桥良,张捷,许其增,等.一氧化氮和前列腺素在门脉高压性胃病大鼠胃黏膜灌注中的作用[J].中华肝脏病杂志,2001,9(4):232-234.
[5] DURANTE W.Protective role of heme oxygenase-1 against inflammation in atherosclerosis[J].Front Biosci,2011,17(6):2372-2388.
[6] ELBIRT KK,BONKOVSKY HL.Heme oxygenase:recent advances in understanding its regulation and role[J].Proc Assoc Am Physicians,1999,111(5):438-447.
[7] GODN A,SUZUKI K,NAITO M,et al.Distribution of heme oxygenase isforms in rat liver:topographic basis for carbon monoxide-mediated microvascular relaxion[J].JClin Invest,1998,101(3):604-612.
[8] KOETTING M,LEUVENINK H,DOMBROWSKI F,et al. Gaseous persufflation with carbon monoxide during ischemia protects the isolated liver and enhances energetic recovery[J]. Cryobiology,2010,61(1):33-37.
[9] CARVALHO PG,BRANCO LG,PANISSICR.Involvement of the heme oxygenase-carbon monoxide-cGMP pathway in the nociception induced by acute painful stimulus in rats[J].Brain Res,2011,1385(4):107-113.
[10] FERNANDO B,MARLEY R,HOLT S,et al.N-Acetyleysteine prevent development of the hyperdynamic circulation in the hypertensive rat[J].Hepatology,1998,28(3):689-694.
[11] DURANTEW,KROLLMH,CHRISTODOULIDESN,et al.Nitric oxide induces heme oxygenase-1 gene expression and carbon monoxide production in vascular smooth muscle cells[J].Circ Res,1997,80(4):557-564.
(本文编辑:刘斯静)
EXPRESSION AND SIGNIFICANCE OF HEM E OXYGENASE-1 IN PORTAL HYPERTENSIVE GASTROPATHY RATS
LU Xinqing1,LIU Zhijun1,LIGuiying1,LIXiaotian1,JIANG Huiqing2*
(1.Department of Gastroenterology,Affiliated Hospital of Hebei University of Engineering,Handan 056002,China;
2.Department of Gastroenterology,the Second Hospital of HebeiMedical University,Shijiazhuang 050000,China)
ObjectiveTo explore the expression of heme oxygenase-1(HO-1)in gastric mucosa from sham-operated and portal hypertensive rats and the possible role of carbon monoxide(CO)in portal hypertensive gastropathy(PHG).MethodsThe Sprague Dawley rats were randomly divided into two groups,sham operation and model group(PHG).Fourteen days after a portal ligation or sham operation,the portal venous pressure was measured with physiology recorder,and the gastric mucosal blood flow volume wasmeasured with the neutral red clearance method.Histopathological changes were evaluated by hematoxylin and eosin staining,the expression of HO-1 in gastric mucosal specimens was immunohistochemically assessed,and expression ofHO-1 protein was assessed by Western blotanalysis. Results Fourteen days after the surgery,morphology studies showed a number ofmucosal capillaries and submucosal veins were dilated markedly without any inflammation.The portal pressure(16.02±2.78)mmHg in the PHG rats was significantly greater than that in the control rats(7.83±1.05)mmHg(P<0.01).Gastric mucosal blood flow(GMBF)(10.36±8.30)mL/h in the PHG rats was significantly greater than that in the control rats(4.68±3.88)mL/h(P<0.05).On the 14th day,the level of HO-1 protein in gastric organswas significantly higher in PHG than that in sham-operated animals. The expression of HO-1 protein in PHG group had a positive correlation with GMBF(r=0.564,P<0.05).ConclusionHO-1 is up-regulated in the gastricmucosal areas in PHG rats,whichmay play a role in PHG.
hypertension,portal;heme oxygenase-1;carbonmonoxide;rats
R657.34
A
1007-3205(2012)08-0877-04
2012-02-21;
2012-05-19
河北省自然科学基金项目(303483)
路新卿(1975-),男,河北馆陶人,河北工程大学附属医院副主任医师,医学博士,从事消化内科疾病诊治研究。
*通讯作者。E-mail:huiqingjiang@yahoo.com.cn
10.3969/j.issn.1007-3205.2012.08.004

