肌肉增强子因子2对猪肌肉生长抑制素启动子活性的调节
李佳,邓捷,张军林,成德,王华岩
西北农林科技大学动物医学院 动物生物技术系,陕西 杨陵 712100
肌肉生长抑制素 (Myostatin,Mstn) 又称生长分化因子8 (Growth differentiation factor 8,GDF8),属于转化生长因子 ß (Transforming growth factor beta,TGF-ß) 超家族,是在骨骼肌中广泛表达并且功能专一的一种糖蛋白。Mstn基因在发育早期及成熟期的骨骼肌及乳腺中高表达[1],在心肌、脂肪组织和肝脏中低表达[2-3]。高表达 Mstn的转基因动物会出现肌肉萎缩的现象[4-5];在小鼠、牛、人等动物上,抑制Mstn的表达,则会出现骨骼肌明显增生、肌肉尺寸显著增加等现象[6-8]。因此,该基因是骨骼肌生长的抑制因子。研究该基因的转录调控机制,对提高动物产肉率方面具有重要意义。
相比于 Mstn的基因与蛋白结构和生物学功能,对 Mstn基因转录和表达的调控机制研究较少。在小鼠、人类、牛和羊等动物上,只完成对Mstn基因启动子一些初步的功能预测,发现启动子序列上存在糖皮质激素受体结合元件 (GRE)、肌肉调控因子结合元件 (E-box)、叉头蛋白结合元件 (FOXO-box) 和肌肉增强子因子2 (MEF2)等因子的结合位点,它们对 Mstn基因的转录和表达起到一定的调控作用[7,9-11]。但是,由于Mstn基因的转录调控模式在不同动物间存在差异,这些调控元件在不同物种间,对 Mstn启动子的调控作用和具体机制还需要继续深入研究[10,12]。早期研究表明,MEF2可能通过结合Mstn启动子的相关位点调节肌纤维类型相互转换[13];在心肌细胞内,MEF2与 Mstn启动子的结合可以抑制心肌细胞增殖[14]。但在骨骼肌中,MEF2怎样调控猪 Mstn启动子活性尚不清楚;如果调控机制确实存在,还需要进一步确定激活Mstn启动子的MEF2亚型和具体的结合位点。
本研究首先通过PCR方法扩增出1 969 kb猪Mstn的启动子序列,利用生物信息学方法分析出启动子全序列中所有的MEF2的结合位点;其次,比较了5个长度不等的启动子在C2C12细胞中的活性。本实验还选取含有 MEF2位点的启动子片段,与MEF2C或MEF2A的表达载体共同转入C2C12细胞,检测启动子活性的变化,确定 MEF2的主要结合位点。最后探讨 2个MEF2亚型对Mstn mRNA水平和蛋白水平的影响。
1 材料与方法
1.1 材料
C2C12细胞系为西北农林科技大学动物医学院干细胞中心保存;pGEM-T Easy、pGL3-Basic、pCMV-Renilla、Dual Luciferase Reporter Assay、System kit、KpnⅠ、XhoⅠ、SacⅠ、BamHⅠ、SalⅠ、质粒提取试剂盒购自 Promega公司;T4 DNA连接酶购自 TaKaRa公司;LipofectamineTM2000脂质体购自 Invitrogen公司;RevertAidTMFrist Strand cDNA Synthesis Kit和Taq DNA聚合酶购自MBI公司;兔抗鼠Mstn抗体购自Abcam公司;兔抗鼠 b-actin抗体购自Sigma公司;辣根过氧化物酶标记羊抗兔抗体购自SantaCruz公司;BCA Protein Assay Kit、ECL Western Blotting Substrate购自Pierce公司。
1.2 方法
1.2.1 Mstn基因启动子片段的克隆
按照Promega基因组提取试剂盒说明书,常规提取八眉猪肌肉组织基因组 DNA,检测核酸浓度及纯度。根据Mstn启动子5′端序列 (GenBank Accession No. AY208121),设计带有酶切位点KpnⅠ和 XhoⅠ的启动子上下游引物并扩增启动子片段为1 969 bp。PCR采用25 μL体系,反应条件: 95 ℃变性5 min;94 ℃ 30 s,56 ℃45 s,72 ℃ 90 s,35个循环;最后72 ℃延伸10 min。PCR产物连接在pGEM-T Easy克隆载体上,经测序验证后克隆到pEGFP-1和pGL3-Basic表达载体中,分别命名为 pE2.0和 pL2.0。以 PCR产物为模板,分别设计带有酶切位点 KpnⅠ和XhoⅠ的上下游引物,扩增852 bp、466 bp、218 bp和 137 bp的启动子片段,测序后克隆到pGL3-Basic表达载体中,分别命名为 pL0.8、pL0.4、pL0.2和pL0.1。引物序列见表1。
1.2.2 MEF2A和MEF2C真核表达载体的构建
PCR引物根据GenBank中猪MEF2A的序列设计,带有XhoⅠ和EcoRⅠ或SalⅠ的酶切位点,上下游引物序列见表1。按照常规RT-PCR方法从C2C12细胞中获取cDNA。按上述PCR条件扩增MEF2A及MEF2C片段。经测序验证后,将两个片段克隆到pEGFP-C1表达载体中,分别命名为pE-MEF2A和pE-MEF2C。
1.2.3 细胞培养及瞬时转染
C2C12成肌细胞 (Myoblast),NIH3T3细胞用含10%胎牛血清的DMEM培养液,在37 ℃、含有5% CO2的细胞培养箱内培养,实验时取对数生长期细胞。C2C12肌管细胞 (Myotube) 是将C2C12细胞培养在含2%马血清的DMEM培养液中24 h后获得。按照Lipofectine 2000使用说明,首先将pE2.0启动子分别转入C2C12成肌细胞和3T3细胞,转染后30 h在荧光显微镜下观察绿色荧光。其次,将 C2C12成肌细胞或肌管细胞按2.4×104/孔接种于48孔培养板中,待细胞完全贴壁覆盖率至 50%~60%时,将 pL2.0、pL0.8、pL0.4、pL0.2或pL0.1启动子荧光报告载体 500 ng和 pCMV-Renilla表达载体 (内参) 50 ng共同转入细胞,30 h后收集细胞并进行荧光素酶活性检测。最后,将上述荧光报告载体分别同MEF2A或MEF2C表达载体 (4 μg) 共同转入成肌细胞或肌管细胞,48 h后检测荧光素酶活性。每种质粒做3次独立实验,每次3个复孔。
1.2.4 实时荧光定量PCR
转染MEF2A或MEF2C表达载体60 h后,Trizol提取细胞总RNA,按照RevertAidTMFrist Strand cDNA Synthesis Kit相关说明进行反转录获得cDNA,并设计qMstn和qGAPDH (内参) 引物。荧光定量PCR反应体系如下:2×SYBR Green Mix 10 μL,25 mmol/L dNTPs 1 μL,上、下游引物各 0.5 μL (10 pmol/L),模板cDNA 1 μL,去离子水7 μL,共20 μL。每个样本设3个重复,另设不加模板对照组 (以等体积的去离子水替代)。反应条件为:95 ℃ 30 s;95 ℃ 10 s,56 ℃ 30 s,共40个循环;95 ℃ 10 s,56 ℃退火阶段收集荧光信号。实时荧光定量PCR引物序列见表1。
1.2.5 Western blotting检测
转染后 72 h收集细胞,采用细胞裂解液(Promega公司) 提取总蛋白。将蛋白样品与等量的2×上样缓冲液混合,100 ℃变性5 min,冰上完全冷却后上样,进行 10%聚丙烯酰胺凝胶电泳。恒压80 V转PVDF膜4 h,用含5%脱脂奶粉的PBST封闭1 h后,1:500稀释的Mstn抗体作用于4 ℃摇床过夜,或以1:2 000稀释的β-actin抗体室温作用1 h,PBST洗膜3次后,将膜与1:5 000稀释的羊抗兔IgG-HRP室温孵育1 h,PBST洗膜3次后,加入ECL化学发光试剂,室温孵育5 min,暗室曝光,显影定影。

表1 引物序列Table 1 Primer sequences
1.2.6 统计学分析
所有数据均用平均值±标准偏差表示,并经双尾t-test检验差异是否具有统计学意义。*表示P<0.05,**表示P<0.01。
2 结果与分析
2.1 猪Mstn启动子的构建及相关转录因子位点分析
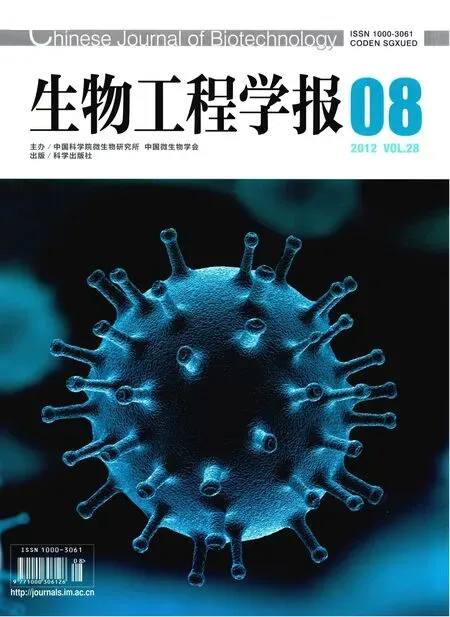
从猪的基因组DNA克隆了1 969 bp的Mstn基因启动子片段,并通过生物信息学分析猪Mstn启动子上潜在的转录因子结合位点 (图 1A)。在Mstn的5'端侧翼50 bp以内存在2个独立的TATA框;在-71 bp到-66 bp存在1个CAAT框;整个启动子包括 16个 E-box,它的识别位点为CANNTG 序列,可以结合成肌分化抗原(MyoD),生肌调节因子5 (MYF5)和生肌调节因子 6 (MYF6)等参与肌肉生长发育调节的转录因子。该启动子上还包括3个潜在的MEF2结合位点 (TA(A/T)4TA),一个近端的位点位于-189 bp到-206 bp (MEF2-1);两个远端的位点分别位于-441 bp到-449 bp (MEF2-2),-620 bp到-628 bp (MEF2-3)。
2.2 猪Mstn启动子在C2C12及NIH 3T3细胞中的活性
首先,将pE2.0启动子缺失报告载体分别转入C2C12细胞和3T3细胞,30 h后在荧光显微镜下观察细胞。结果显示,部分C2C12细胞表达绿色荧光而 3T3细胞没有荧光蛋白的表达(图1B)。这一结果证实了Mstn启动子在肌细胞中表达的特异性。然后,将5个不同长度的启动子片段分别转入C2C12成肌细胞和肌管细胞中,观察这些启动子的活性。在成肌细胞中,转入不同的 Mstn启动子后,荧光素酶水平是转入pGL3-Basic对照载体细胞的20~60倍,进一步证实该启动子在肌细胞中充分激活 (图2)。研究检测的5个启动子,它们的活性在成肌细胞中比在肌管细胞中要高2~3倍 (图2),这可能是因为成肌细胞中高表达一系列限制肌肉分化发育的转录因子,对Mstn启动子发挥了一定的协同激活作用。
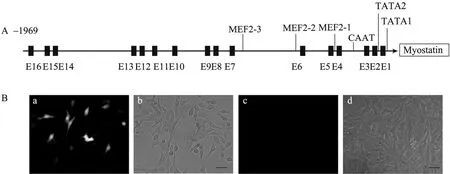
图1 猪Mstn启动子的序列分析及启动子缺失载体pE2.0在C2C12细胞和NIH 3T3细胞中的激活Fig. 1 Sequence analysis of porcine Mstn promoter and the activation of promoter-less vector pE2.0 in C2C12 cells and NIH 3T3 cells. (A) The 1 969 bp porcine Mstn promoter was analyzed by MatInspector software. 16 E-Boxes were indicated by black box. (B) C2C12 (a and b) and NIH 3T3 cells (c and d) were transfected with pE2.0 constructs. a and c are fluorescent images; b and d are phase-contrast images. Scale bars=10 mm.

图2 不同片段猪Mstn启动子在成肌细胞及肌管细胞的活性检测Fig. 2 Luciferase activity of five constructs with different sized Mstn promoter in myoblasts and myotubes.
基于荧光素酶检测的结果,研究发现在1 969 bp Mstn基因启动子片段中,包含了5个活性调控区域,包括 3个活性上调区 (1 bp至-137 bp、-137 bp至-218 bp、-218 bp至-466 bp和-466 bp到-852 bp) 和 1个活性下调区域(-852 bp至-1 969 bp)。其中,在第一个区域,结果显示仅 137 bp的启动子片段 (pL0.1) 足以激活启动子活性 (该片段活性是对照载体的 15倍)。在-137 bp至-218 bp区域和-466 bp至-852 bp区域,荧光素酶活性显著增加。在成肌细胞和肌管细胞中,报告载体pL0.2的活性分别是pL0.1的2倍和4倍,表明在-137 bp到-218 bp这一区域有重要的正调控转录因子参与 Mstn启动子活性调节。从-218 bp至-466 bp,启动子活性没有明显改变,提示这一区域可能不是 Mstn启动子的关键调控区。
2.3 MEF2对猪Mstn启动子活性的影响
在 C2C12细胞上,进一步探讨了转录因子MEF2对猪 Mstn启动子活性的调控。分别将MEF2A和 MEF2C两个亚型的表达载体与不同的启动子片段共同转染成肌细胞或肌管细胞,60 h后检测荧光素酶活性。分析发现,在高表达MEF2C基因后,含有MEF2结合位点的启动子片段 (pL2.0、pL0.8、pL0.4和pL0.2) 活性明显增强,不含有 MEF2结合位点的启动子片段(pL0.1) 活性没有显著变化 (图3A、B)。其中,含有MEF2-1位点的pL0.2活性变化最为明显:在成肌细胞和肌管细胞,启动子活性分别升高了6倍和5倍。含有全部3个MEF2位点的pL2.0和pL0.8,在加入MEF2C表达载体后,活性也显著上升了2~3倍;含有MEF2-1和MEF2-2位点的pL0.4片段,其活性的增加只有pL0.2片段的50%。该结果表明,不同的MEF2结合位点对MEF2C的易感性不同,以近端的MEF2-1位点最为敏感,是MEF2C调节Mstn启动子活性的重要位点。而高表达MEF2A基因后,各启动子活性没有明显变化,说明MEF2A亚型可能在调控猪Mstn启动子活性方面作用较为薄弱。
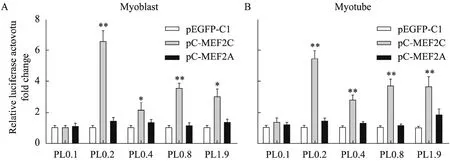
图3 MEF2A和MEF2C对不同片段的猪Mstn启动子活性的影响Fig. 3 Luciferase activity of different porcine Mstn promoter fragment response to MEF2A or MEF2C overepression in myoblasts and myotubes.
2.4 MEF2对猪Mstn转录水平及蛋白水平的调控
将MEF2A和MEF2C的表达载体分别转染C2C12成肌细胞和肌管细胞,检测Mstn的mRNA水平和蛋白水平的变化。结果显示,在成肌细胞中,转入MEF2C后,Mstn的mRNA水平只升高了约0.5倍,蛋白水平也变化不明显 (图4A);在肌管细胞中,mRNA水平升高了4~5倍,而且蛋白水平也有显著上调 (图 4B)。与前面的结果相似,转入MEF2A表达载体后,在两种细胞中,Mstn的转录水平及蛋白水平都没有明显改变(图 4A、4B)。以上结果提示,在肌肉发育过程中,特别是在分化为肌管细胞的过程中,MEF2C可能通过调节 Mstn启动子活性从而增加其mRNA转录和蛋白翻译。

图4 转染pC-MEF2A或pC-MEF2C后Mstn的mRNA水平和蛋白水平Fig. 4 Mstn mRNA and protein level after transfection of pC-MEF2A or pC-MEF2C in myoblasts and myotubes.
3 讨论
在本研究中,我们首先构建了猪 Mstn启动子,并把它克隆到启动子缺失载体pEGFP-1中。pE2.0启动子导入非肌肉细胞后,猪Mstn启动子不表达。该结果证实 Mstn启动子的在肌肉细胞内特异性表达。这与以前在人和羊上Mstn启动子的报道一致[15]。
然后,我们发现 MEF2C的表达对猪 Mstn启动子活性有显著上调的作用。MEF2 (MEF2A、MEF2B、MEF2C和MEF2D) 是成肌细胞分化为肌肉特异性基因的转录因子[16]。在成年小鼠,MEF2C的表达仅限于骨骼肌、脑和脾;而MEF2A、MEF2B和MEF2D则广泛表达于身体各个组织[17-18]。已有的报道发现,MEF2广泛存在于肌肉细胞中,是最早被称为具有肌肉特性的DNA结合活性因子,可与大多数肌肉特定基因,特别是碱性螺旋-环-螺旋蛋白家族成员 (Basic helix-loop-helix protein,BHLH protein) 的启动子或增强子直接结合,激活骨骼肌相关基因的活性[19]。近期的研究发现,MEF2可以与一些负调控肌肉生长发育基因的启动子相结合并增强该启动子的活性,例如 Mstn[13]和 TRIM72[20]。在猪Mstn基因启动子上,MEF2C结合位点的发现以及MEF2C增强Mstn转录活性的证据表明,该因子可以通过影响Mstn的表达来参与骨骼肌生长和分化的调节。此前,有报道证实,MEF2可以通过调节Mstn基因的表达改变小鼠骨骼肌肌纤维类型的组成[13]。而在心肌细胞的研究证实,MEF2通过与Mstn的启动子DNA结合抑制心肌细胞增殖,并降低心脏重量[14]。在本实验中,我们发现MEF2C是骨骼肌中发挥该调控机制的亚型。在成肌细胞中和肌管细胞中,高表达MEF2C后,猪Mstn启动子活性增加了3~4倍。与此相对应的 mRNA转录水平和蛋白水平在成肌细胞中只升高了0.5倍左右,实际上不具有真正的生理学意义。该结果提示,在成肌细胞中,MEF2C还可能激活了其他信号通路,调控Mstn表达;而在肌管细胞中,mRNA转录水平和蛋白水平升幅程度与启动子活性的激活程度相似,提示MEF2C可能在肌管发育期对Mstn的影响更为重要。由于Mstn的作用是限制骨骼肌生长发育,在肌管细胞内,MEF2C激活Mstn启动子的现象可能是该因子负反馈调节抑制肌细胞增生的机制之一[20]。
总之,本研究克隆和分析了猪 Mstn基因启动子序列,首次发现了并确定了该序列有 3个MEF2结合位点。其中,近端的MEF2-1位点最为重要,它是MEF2C在C2C12细胞中上调Mstn启动子活性的重要结合位点。而且,在肌细胞中,MEF2C还可以通过上调Mstn启动子活性增强该基因的转录和蛋白翻译。本研究结果提示,MEF2C可以通过激活Mstn调节猪肌肉生长和发育,这将为以后通过调控 Mstn基因控制动物肌肉产量等方面提供新的理论依据。
[1] McPherron AC, Lawler AM, Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-p superfamily member. Nature, 1997, 387(6628): 83−90.
[2] Sharma M, Kambadur R, Matthews KG, et al. Myostatin, a transforming growth factor-β superfamily member, is expressed in heart muscle and is upregulated in cardiomyocytes after infarct. J Cell Physiol, 1999, 180(1): 1−9.
[3] Sundaresan NR, Saxena VK, Singh R, et al. Expression profile of myostatin mRNA during the embryonic organogenesis of domestic chicken (Gallus gallus domesticus). Res Vet Scis, 2008, 85(1): 86−91.
[4] Reisz-Porszasz S, Bhasin S, Artaza JN, et al. Lower skeletal muscle mass in male transgenic mice with muscle-specific overexpression of myostatin. Am J Physiol Endocrinol Metab, 2003, 285(4): E876−E888.
[5] Zhu XY, Topouzis S, Liang LF, et al. Myostatin signaling through Smad2, Smad3 and Smad4 is regulated by the inhibitory Smad7 by a negative feedback mechanism. Cytokine, 2004, 26(6): 262−272.
[6] Grobet L, Martin LJR, Poncelet D, et al. A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle. Nature Genetics, 1997, 17: 71−74.
[7] Seoane J, Le HV, Shen LJ, et al. Integration of Smad and forkhead pathways in the control of neuroepithelial and glioblastoma cell proliferation. Cell, 2004, 117(2): 211−223.
[8] Mosher DS, Quignon P, Bustamante CD, et al. A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs. PLoS Genetics, 2007, 3(5): e79.
[9] Sandri M, Sandri C, Gilbert A, et al. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell, 2004, 117(3): 399−412.
[10] Spiller MP, Kambadur R, Jeanplong F, et al. The myostatin gene is a downstream target gene of basic helix-loop-helix transcription factor MyoD. Mol Cell Biol, 2002, 22(20): 7066−7082.
[11] Stitt TN, Drujan D, Clarke BA, et al. The IGF-1/PI3K/Akt pathway prevents expression of muscle atrophy-induced ubiquitin ligases by inhibiting FOXO transcription factors. Mol Cell, 2004, 14(3): 395−403.
[12] Du R, An XR, Chen YF, et al. Some motifs were important for myostatin transcriptional regulation in sheep (Ovis aries). J Biochem Mol Biol, 2007, 40(4): 547−553.
[13] Hennebry A, Berry C, Siriett V, et al. Myostatin regulates fiber-type composition of skeletal muscle by regulating MEF2 and MyoD gene expression. Am J Physiol Cell Physiol, 2009, 296(3): C525−C534.
[14] Wang BW, Chang H, Kuan PL, et al. Angiotensin II activates myostatin expression in cultured rat neonatal cardiomyocytes via p38 MAP kinase and myocyte enhance factor 2 pathway. J Endocrinol, 2008, 197(1): 85−93.
[15] Huang ZQ, Chen XL, Chen DW. Myostatin: a novel insight into its role in metabolism, signal pathways, and expression regulation. Cell Signal, 2011, 23(9): 1441−1446.
[16] Bryantsev AL, Baker PW, Lovato TL, et al. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Dev Biol, 2012, 361(2): 191−207.
[17] Sekiyama Y, Suzuki H, Tsukahara T. Functional gene expression analysis of tissue-specific isoforms of mef2c. Cell Mol Neurobiol, 2012, 32(1): 129−139.
[18] Potthoff MJ, Olson EN. MEF2: a central regulator of diverse developmental programs. Development, 2007, 134(23): 4131−4140.
[19] Olson EN, Perry M, Schulzr RA. Regulation of muscle differentiation by the MEF2 family of MADS box transcription factors. Dev Biol, 1995, 172(1): 2−14.
[20] Jung SY, Ko YG. TRIM72, a novel negative feedback regulator of myogenesis, is transcriptionally activated by the synergism of MyoD (or myogenin) and MEF2. Biochem Biophys Res Commun, 2010, 396(2): 238−245.