恒细胞密度发酵策略提高重组毕赤酵母生产碱性果胶酶的表达效率
王辉林,李江华,刘龙,宋江宁,堵国成,4
1 中科院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308
2 中科院天津工业生物技术研究所 系统微生物工程中科院重点实验室,天津 300308
3 江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
4 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122
碱性果胶酶 (Alkaline polygalacturonate lyase,PGL,E.C.4.2.2.2) 是一类能在碱性条件下高效分解植物组织中果胶质 (由 D-半乳糖醛酸以 α-1,4糖苷键连接形成的直链状聚合物) 的酶的总称[1]。它是纺织用酶的一种,主要应用于棉织物的生物精炼,除去棉纤维中的果胶等杂质。与传统高能耗、高污水排放的碱处理法相比,酶处理法具有条件温和、环境友好、低能耗、易实现清洁生产等优势[2-4],也可提高棉织物的品质[5-6]。因此,以碱性果胶酶为主的酶处理法取代传统高温高碱的化学工艺具有重要意义。
甲醇营养型毕赤酵母 (The methylotrophic Pichia pastoris) 从上世纪70年代被开发应用于外源蛋白的表达开始,现在已经成为研究和使用最广泛的表达系统之一[7]。超过500种重组蛋白在毕赤酵母中表达成功[8],外源蛋白表达水平可达到胞外蛋白的80%或总蛋白的30%[9]。毕赤酵母表达系统的改造及高效表达是目前生化工程研究的热点[10]。表达系统改造方面,Mehmet Inan等[11]通过过量表达蛋白质二硫键异构酶,促进毕赤酵母翻译后修饰与胞外分泌。Brigitte Gasser等[12]构建生物素原养型毕赤酵母,使发酵过程不再需要添加生物素。在发酵优化方面,研究主要集中在高密度发酵、诱导条件优化、甲醇流加控制策略等方面。双碳源混合流加、低温诱导、富氧培养、降低蛋白酶降解作用等也常作为优化策略以提高外源蛋白的表达效率。
本研究室诸葛斌等[13]扩增出野生芽胞杆菌Bacillus sp. WSHB04-02的碱性果胶酶编码基因,并成功表达于P. pastoris GS115中。王芸等[14-15]应用高密度培养和低温诱导等策略,使碱性果胶酶产量达到国际领先水平。但是,高密度发酵在工业化放大生产过程中,易出现供氧不足、冷凝水能耗过大、发酵高粘度、高死亡率和高蛋白酶分泌等问题[16]。这些不利因素容易导致生产失败。在3 L和30 L发酵罐中,PGL的产量可分别达到890 U/mL和1 425 U/mL。但是,在5 t工业发酵罐进行放大后,酶活仅为504 U/mL[16]。因此,为了进一步提高 PGL的生产强度并寻找适合于工业化生产的发酵新模式,本文系统研究了细胞密度对重组毕赤酵母分批补料发酵和连续培养生产 PGL的影响,并发展出恒细胞密度发酵表达PGL的新策略。
1 材料与方法
1.1 菌种
宿主为P. pastoris GS115,同时具有Mut+和的His+表型,整合了来自Bacillus sp. WSHB04-02中的PGL基因,拷贝数为2~3个,本实验室保藏[13]。
1.2 培养基
1.2.1 YPD种子培养基
1%酵母膏(Yeast extract),2%蛋白胨(Peptone),2%葡萄糖(Glucose)。
1.2.2 甘油分批发酵培养基 (Batch media)
甘油 (Glycerol) 40.0 g/L,K2SO418.2 g/L,CaSO40.93 g/L,MgSO4·7H2O 14.9 g/L,85% H3PO426.7 mL/L,KOH 4.13 g/L,微量元素溶液(PTM1)[16]4.35 mL/L,115 ℃灭菌15 min,再用25% NH4OH调pH至5.5。
1.2.3 甘油补料生长培养基
含12 ml/L PTM1的 50% (W/V) 的甘油溶液。
1.2.4 发酵诱导培养基
分批补料诱导培养基:含12 mL/L PTM1的100%甲醇溶液 (分析纯) 。
连续培养诱导培养基:w1% (W/V) CCM (Continuous culture media, 即为5倍含量的 (除甘油、氨水、PTM1外) 的Batch media培养基) + w2% (W/V)甲醇 (分析纯) + w3% ( W/V) PTM1,其中w1~w3的值参见3.1.2。
1.3 培养方法
1.3.1 种子摇瓶培养
种子甘油管于-80 ℃保藏,从甘油管中接1 mL菌液于50 mL YPD培养基中 (摇瓶装液量为10%),于30 ℃、200 r/min摇床培养24 h,OD600为8~16。
1.3.2 高密度发酵培养
将种子培养液接入 3 L全自动发酵罐(LiFlus GM BioTRON, Korea) 中,接种量为10%。初始培养条件为:装液量800~1 000 mL,起始搅拌转速为300 r/min,通气量2 vvm。生长阶段温度为30 ℃,采用搅拌关联控制使DO维持在 (30±5)%,搅拌转速最高值设置为950 r/min。采用30%的磷酸溶液和25%的浓氨水控制pH在5.5。
当甘油耗尽时 (DO迅速上升至60%以上),采用指数流加方式补加50% (W/V) 的甘油。通过控制指数流加时间以实现不同诱导初始细胞密度。指数流加结束后,待甘油再次耗尽,DO再次反弹至60%以上时,开始流加诱导培养基,并将诱导温度降低至22 ℃。通过控制诱导培养基的流加速度,使培养基中甲醇浓度迅速达到并维持在1.8% (V/V),此时,FC2002型甲醇检测流加控制器的甲醇残留浓度值为1.8% (V/V)。发酵过程使用发酵罐控制系统软件自动控制与数据采集[16]。
1.4 测定方法
1.4.1 菌体干重的测定
准确移取10 mL 发酵液于50 mL离心管中,先经过10 000 r/min冷冻离心5 min,弃上清,再用蒸馏水重悬,重复洗涤离心2次。然后将菌体放在恒温烘箱105 ℃烘干至恒重。最后,称量并计算干重 (DCW,g/L)。
1.4.2 碱性果胶酶活性的测定
一个标准酶活单位 (IU) 定义为:每分钟使聚半乳糖醛酸裂解产生1 μmol的不饱和聚半乳糖醛酸的酶量[17]。
1.4.3 醇氧化酶AOX活力的测定
取发酵液放置于干冰中迅速冷冻后转移到-80 ℃超低温冰箱中。测定时,将样品置于冰水中解冻,于4 ℃、10 000 r/min离心5 min,用50 mmol/L磷酸缓冲液 (pH 7.0) 洗涤2次,再用缓冲液重悬。然后,将重悬菌液进行超声波破碎处理,破碎时间为10 min,再离心收集上清酶液。
AOX测定标准分析混合液 (3 mL):甲醇200 μmol,4-氨酰安替比林1 μmol,PBS (pH 7.0) 100 μmol,苯酚4.3 μmol,辣根过氧化物酶15 U和稀释后的待测酶液。反应体系于可控温的UV2450分光光度计 37 ℃下动态测定吸光度变化斜率,通过公式计算出醌的变化量来表示AOX的酶活力。AOX酶活的定义为:在上述条件下,每分钟生成1 μmol H2O2需要的酶量[18]。
1.4.4 细胞活力和出芽率测定
细胞活性 (或死亡率) 采用台盼蓝染色细胞存活率检测试剂盒进行检测。取一定量样品用50 mmol/L磷酸缓冲液 (pH 7.0) 洗涤2次,再用细胞稀释液稀释重悬。吸取100 μL细胞悬液到离心管内,加入100 μL台盼蓝染色液,混合均匀,染色3~5 min (时间不宜过长),然后于血球计数板计数。由于健康的酵母细胞能够排斥台盼蓝,台盼蓝不进入细胞;而死亡的细胞,丧失膜的完整性,通透性增加,台盼蓝将细胞染成蓝色。因此显微镜下蓝色细胞为死亡细胞,透明细胞为活性细胞。为了得到更高的准确率,每个样品将进行500个细胞以上的计数。
另外,每个样品都测定其出芽率。如果芽体大于母细胞的一半体积则计为1个细胞,否则不计为细胞。
1.4.5 胞外蛋白酶测定
发酵液经过10 000 r/min离心10 min,收集上清液作为待测样品。胞外的总蛋白酶酶活力采用Pierce Colorimetric QuanticleaveTM的蛋白酶检测试剂盒进行测定[19]。
2 结果与分析
2.1 控制诱导初始细胞密度对分批补料发酵生产碱性果胶酶的影响
高密度发酵技术是提高重组毕赤酵母表达外源蛋白效率的一种重要技术手段。高密度发酵能有效地提高目的产物的浓度,降低下游分离纯化成本。细胞密度是毕赤酵母发酵过程的重要控制参数,尤其在工业化放大过程中,基于细胞密度的放大对于发酵的成败至关重要。因此,在发酵过程中,控制合理的细胞密度,对于实现异源蛋白的高效表达具有重要意义。
根据王芸等[20]采用甘油指数流加方法,实现毕赤酵母生长阶段的高密度培养。通过控制甘油的流加,即分别进行5 h、9 h、14 h的流加,诱导初始细胞密度可分别达到56.7 g/L、83.4 g/L、124.9 g/L。
在诱导表达阶段,甲醇不但是启动子(pAOX1) 的诱导剂,也为菌体生长提供碳源和能源。因此,在诱导阶段,毕赤酵母表达外源蛋白的同时,菌体密度也在不断增加。如图1所示,3种不同诱导初始细胞密度 (分别为 56.7 g/L、83.4 g/L、124.9 g/L) 诱导120 h后,最终菌体密度分别达到115 g/L、140 g/L、155 g/L。低诱导初始细胞密度发酵 (56.7 g/L) 的菌体生长最快,比生长速率最高可达到0.029 h-1。菌体密度影响产品的总收率:发酵结束时细胞密度越高,总上清液与总发酵液的比例越小,固液分离操作过程中的产品的收率越低。酶液的回收率与发酵液的细胞密度呈线性负相关 (y=-0.0026x+0.999, R2=0.9966,数据未显示)。此外,过高的细胞密度也加大工业化后处理的操作困难。
如图 1D所示,细胞密度与比生长速率 (μ)密切相关,菌体密度限制了细胞生长。μ随着细胞密度的增大而下降,当细胞干重达到130 g/L以上,菌体生长缓慢,μ约为0.008 h-1。而细胞密度为75 g/L时,μ可高达0.029 h-1。
在相同的发酵条件下,增加诱导初始细胞密度,发酵过程的溶氧水平下降。当初始菌体浓度为56.7 g/L时,发酵过程的DO值维持在20%以上。而诱导初始细胞浓度为83.4 g/L和124.9 g/L时,发酵过程的DO仅分别为10% (维持在8%~15%) 和5% (维持在3%~6%)。表明这两种高细胞密度的发酵出现了供氧不足的现象。
如图 1和表 2所示,当初始细胞密度为56.7 g/L,诱导77 h,酶活为691.4 U/mL。而当初始菌体密度增加到124.9 g/L,诱导101 h,酶活可达到961.4 U/mL,比初始菌体密度为56.7 g/L提高了39.1%。但是,初始细胞密度为56.7 g/L的单位菌体生产强度 (Average specific enzyme production rate,QX) 和单位发酵液体积生产强度 (PGL productivity,QV) 可分别达到了44.3 U/(g·h)、5.09 U/(g·h)。该过程的QX值比初始时的 83.4 g/L (35.1 U/(g·h))、124.9 g/L (27.9 U/(g·h)) 分别高出26.2%、58.8%。QV也分别比另外两种发酵策略 (4.56 U/(mL·h)、4.30 U/(mL·h)) 高出11.6%、18.4%。QX随着诱导初始细胞密度的升高而下降,说明控制合理细胞密度发酵有利于提高QX。
一般来说,利用重组毕赤酵母发酵生产外源蛋白的发酵周期较长 (如高密度对照组的发酵周期为137 h)。而初始细胞密度为56.7 g/L的发酵方式的周期比高密度对照组缩短了39 h,发酵总周期仅为98 h。
2.2 恒细胞密度发酵策略动力学参数的确定
上述结论表明,细胞密度是影响重组毕赤酵母高效表达 PGL的关键因素,合理地控制细胞密度能有效地提高 PGL的表达效率。因此,本文进一步研究细胞密度对连续培养过程 PGL表达的影响,并提出恒细胞密度 (Constant cell concentration by methanol feeding,简称为CCCM)发酵策略以提高PGL的表达效率。
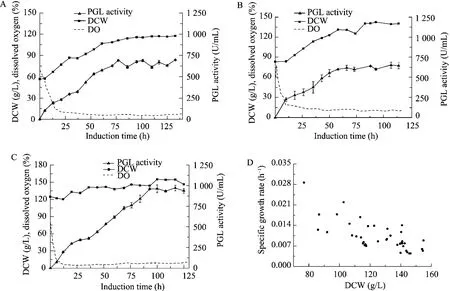
图1 控制诱导初始细胞密度对PGL表达过程的影响Fig. 1 Time evolution of biomass (Dry cell weight, DCW), dissolve oxygen, PGL activity under different cell concentrations in the prior-induction phase. (A) 56.7 g/L. (B) 83.4 g/L. (C) 124.9 g/L. (D) The relationship between the specific growth rate and biomass.
在诱导阶段,传统的诱导方式采用流加100%的甲醇,导致诱导阶段细胞密度不断上升。因此,为了准确控制诱导阶段的细胞密度,必须调控甲醇流加的比例。本研究通过分析恒细胞密度发酵策略的动力学方程,并确定了动力学参数,使之更好地指导甲醇的流加。在连续培养过程中,使用25%氨水和30%磷酸调节pH,使体系的pH控制在 5.5,氨水和磷酸的补料体积相比甲醇补料培养基可忽略不计

其中,F为补料流速,Fccm为连续培养基本补料培养基的流速,Fm为甲醇培养基 (含PTM1的甲醇溶液) 的流速,w1、w2(见公式4) 分别为CCM、甲醇补料比例,单位为% (W/V)。D为稀释率,V为发酵液体积,μ为比生长速率。w1的值是根据单位菌体对基本补料培养基 (CCM)的需求量 (本文中每克细胞干重需1.3 mL CCM培养基),确定其流加比例。PTM1的添加量参考分批补料流加,即12 mL PTM1/1 000 mL甲醇。
恒细胞密度发酵过程,通过控制流加甲醇的速率和比例,使甲醇残留浓度维持在 1.8% (V/V)。因此需要准确计算出 w2的预期值,以实现恒细胞密度培养。当发酵过程不考虑细胞维持系数,则:

式 (3) 中,wt为培养基中甲醇的残留浓度,即为1.8% (V/V)。在毕赤酵母高密度发酵的诱导过程中,甲醇不仅为菌体提供碳源;也可被氧化,为细胞提供能量,维持细胞的能量代谢。因此,细胞维持系数并不可忽略,则:
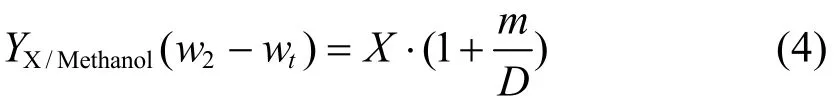
在恒细胞密度发酵过程中,发酵过程可以分成2个阶段,即适应期 (Adaption stage) 与稳定期 (Stable stage)。在适应期,甲醇消耗速度较慢;而在稳定期,甲醇消耗速率较快,并趋于稳定。通过多次发酵求解可以得到:

如表1所示,在恒细胞密度发酵过程中,w2的计算值与实际控制值极为接近,说明上述动力学参数求解值能很好地反应发酵过程的真实情况。因此,可以根据上述公式和参数值,计算出恒细胞密度发酵过程的甲醇流加方式。
2.3 恒细胞密度发酵策略提高碱性果胶酶表达效率和发酵适应性
2.3.1 恒细胞密度发酵对重组毕赤酵母生长与产酶的影响
通过对恒细胞密度培养的流加策略和动力学研究,本研究预设了3种不同的细胞密度,分别为DCW 55 g/L、75 g/L和105 g/L。如图2所示,通过3种不同流加策略实现恒细胞密度培养,其发酵过程的细胞密度都能够很好地维持在预设值。在诱导的适应期 (0~10 h),甲醇代谢途径的关键酶开始表达,此时甲醇的利用速率较慢。在稳定期 (>10 h),甲醇代谢途径关键酶维持在相对稳定的高水平,甲醇被快速利用,为细胞生长和代谢提供所需的碳源和能源。与 Fed-batch culture (FBC) 相比,CCCM培养的菌体生长速率更快,稳定期的平均 μ值分别达到 0.018 h-1(DCW 55 g/L)、0.017 h-1(DCW 75 g/L) 和0.012 h-1(DCW 105 g/L)。恒细胞密度培养稳定期的出芽率分别维持在23% (DCW 55 g/L)、21% (DCW 75 g/L) 和17% (DCW 105 g/L),说明该培养模式下细胞稳定地快速生长。
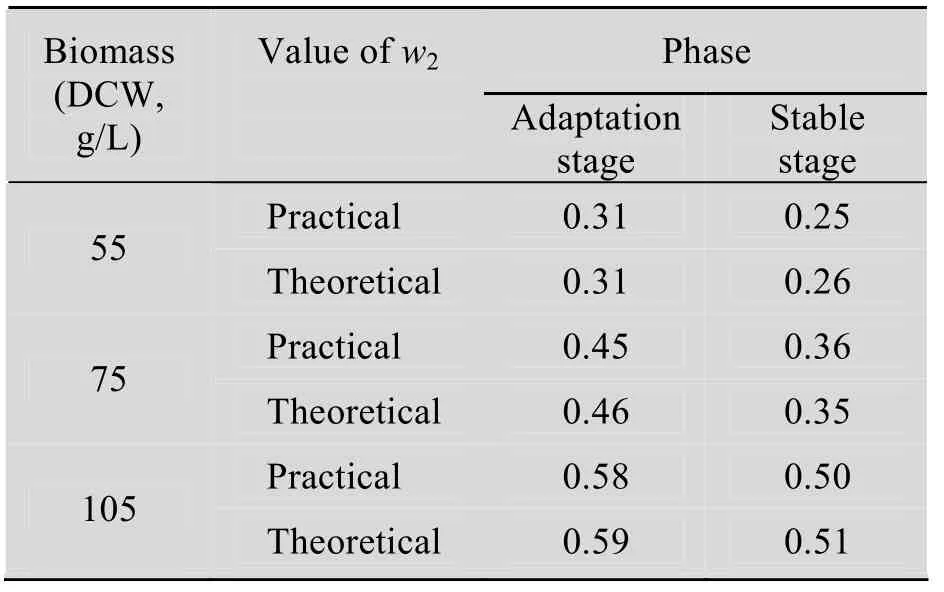
表1 恒细胞密度发酵过程w2流加理论值和实际值的比较Table 1 Comparison of the theoretical and practical values of w2 for methanol feeding in the CCCM culture
由于CCCM策略很好地控制细胞密度维持在合理水平,氧气的需求量降低,不同程度地避免了供氧限制,因此该模式下的溶解氧维持在较高水平。CCCMDCW 55 g/L、CCCMDCW 75 g/L和CCCMDCW105g/L的DO值分别为30%、15%和10%。当溶解氧小于15%时,预示着供氧不足,不利于产酶。溶解氧是发酵过程一个重要的参数,富氧培养有利于促进氧化磷酸化和 ATP的再生,提高外源蛋白表达效率,促进发酵过程的适应性[21]。甲醇代谢途径有两条途径,分别为氧化途径和生长途径。氧化途径需消耗大量的氧气,最终产生大量的能量。而生长途径需要的氧气量较少,甲醇最终转化为生物质 (如下化学式[1-2])。CCCM控制相比FBC,耗氧量少 (高DO值),菌体生长速率快 (高μ值);说明CCCM策略的甲醇生长途径比例上升,而氧化途径的比例降低。因此 CCCM发酵模式降低了代谢产热,有利于缓解工业化冷却压力。
根据C平衡[22],甲醇代谢途径:
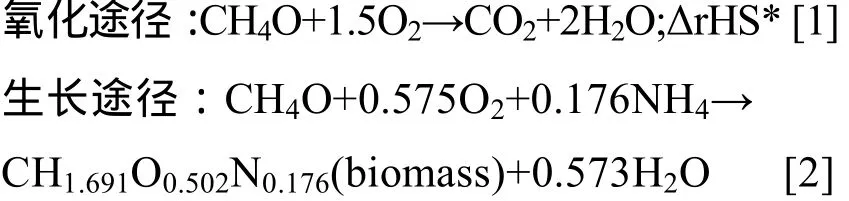
在CCCM培养中,PGL酶活力随着细胞密度的增加而升高,3种控制策略PGL酶活可分别达到305.9 U/mL、441.9 U/mL和528.7 U/mL,并于诱导45 h后达到稳定水平。如图2中虚线所示,这表明 CCCM培养过程维持较为稳定的产酶速率。
如表2所示,相比于FBC,虽然CCCM培养方式的最终酶活力较低,但是该发酵策略的生产强度更高。在CCCM培养中,QX值随着细胞密度的增加而降低,特别是当细胞密度大于75 g/L。CCCMDCW55g/L和CCCMDCW75g/L的QX分别高达 84.5 U/(g·h) 和 81.5 U/(g·h),比CCCMDCW105g/L高出85.7%和79.1%,也分别比分批补料高密度发酵策略 (FBCDCW124.9g/L) 提高了202.9%和192.1%。相比于不控制细胞的传
统发酵方式 (FBCDCW 56.7 g/L和FBCDCW 83.4 g/L),
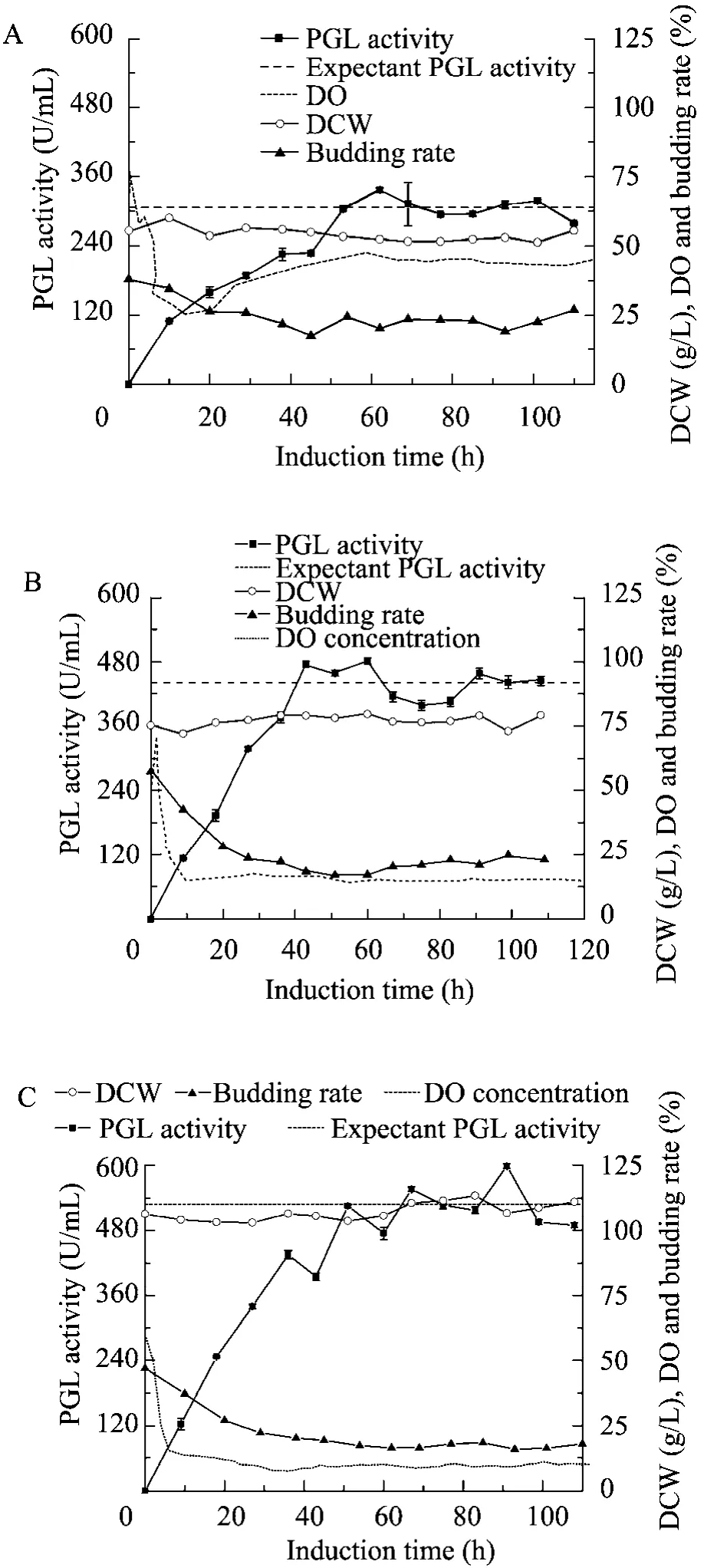
图2 恒细胞密度发酵过程曲线Fig. 2 Time evolution of dissolve oxygen, biomass (Dry cell weight, DCW), budding rate and PGL activity using CCCM culture with different cell concentrations in the post-induction phase. The dash lines are the expectant values of PGL activity in CCCM cultures. (A) 55 g/L. (B) 75 g/L. (C) 105 g/L.
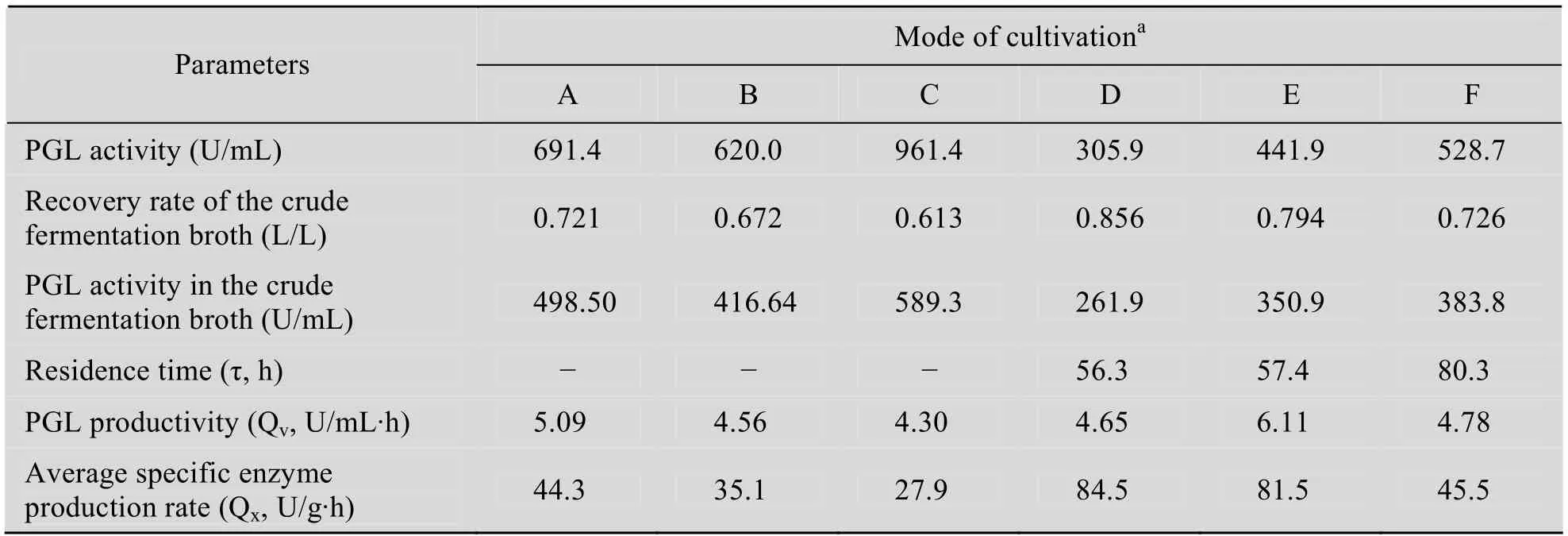
表2 两种不同发酵策略表达 (Fed-batch culture和CCCM culture) PGL过程参数的比较Table 2 Comparison of parameters in PGL production by the recombinant P. pastoris during fed-batch culture and constant cell concentration cultrures by methanol feeding (CCCM cultures)
这两种发酵过程的 QX值也分别高出 90.7%和 132.2%。在限定的发酵条件下,高密度培养易导致供氧不足并导致生化条件的恶化,影响了外源蛋白的表达效率。因此,合理控制细胞密度对于提高发酵的表达效率是非常有意义的。另外,从QV方面105 g/L考虑,DCW为75 g/L的CCCM策略的 QV最高,达到 6.11 U/(mL·h),比CCCMDCW75g/L、CCCMDCW105g/L高出31.4%、27.8%,也分别比 CCCM 比高密度对照组(FBCDCW124.9g/L) 提高了 42.1%。因此,CCCM发酵策略有利于提高单位发酵液体积的产酶效率,既提高了发酵罐的利用效率,又更好发挥重组菌的产酶潜力。
综合考虑以上的各个参数,如菌体比产酶速率 (QX)、发酵液单位体积比产酶速率 (QV) 和PGL酶活等,研究认为DCW为75 g/L的CCCM培养为最优的发酵策略。
2.3.2 恒细胞密度培养对AOX酶活的影响
重组P. pastoris表达外源蛋白受AOX1启动子 (pAOX1) 调控,在 Mut+型中,AOX的表达水平可作为启动子效率与外源蛋白表达水平的一个指标[23]。如下图3所示,采用CCCM控制比 FBC的胞内 AOX表达量更高,也说明了CCCM发酵策略的PGL的表达效率比FBC策略高。CCCMDCW55g/L的平均AOX酶活为180.8 U/L,比FBCDCW56.70g/L的平均AOX酶活77.2 U/L高出1.34倍。CCCMDCW75g/L和CCCMDCW105g/L也
分别比FBCDCW 83.39 g/L和FBCDCW 124.90 g/L的AOX
表达水平高。AOX是甲醇代谢途径的第一个酶,因此AOX的高效表达有利于CCCM培养过程菌体的快速生长。在传统的分批补料发酵,AOX酶活在发酵后期开始下降,特别是诱导90 h后。说明此时菌体的产酶能力下降甚至菌体不产酶。而CCCM发酵策略稳定期的AOX维持在相对恒定的水平,说明菌体处于长期的高效表达的状态。因此,CCCM发酵模式有利于重组毕赤酵母延长高效产酶的发酵周期。
2.3.3 应用恒细胞密度发酵策略提高细胞活性
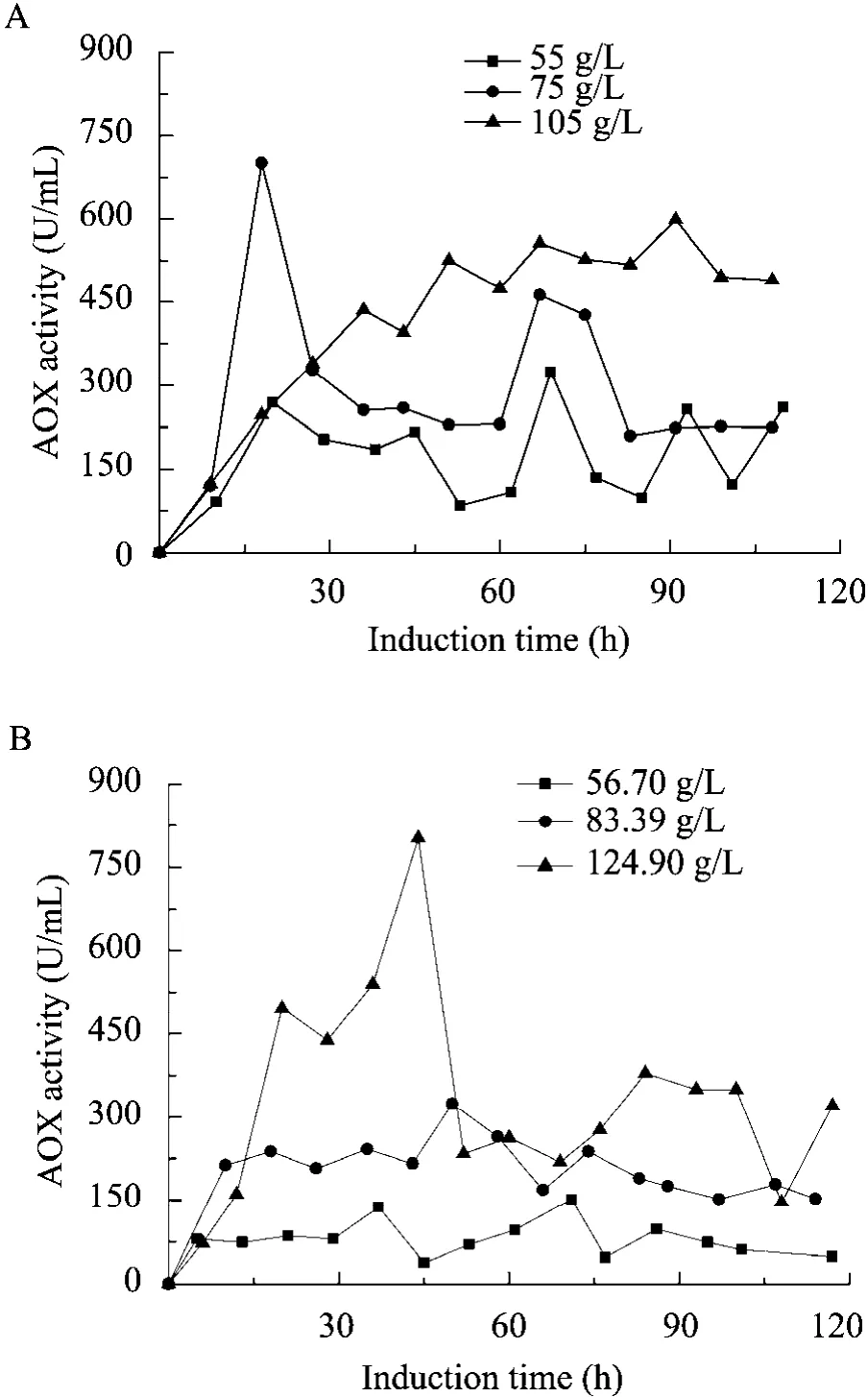
图3 比较两种不同发酵策略 (分批补料发酵和连续培养) 的AOX酶活Fig. 3 Comparison of the AOX activities under two different fermentation strategies in the post-induction phase. (A) CCCM cultures. (B) Fed-batch cultures with different initial cell concentration.
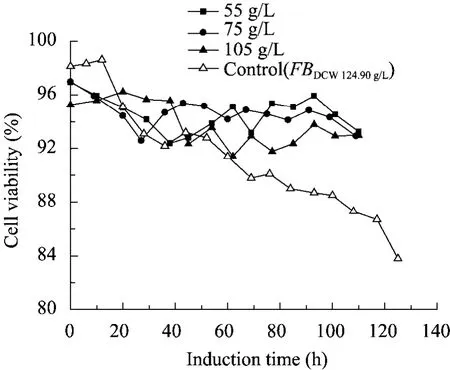
图4 恒细胞密度培养的细胞活性变化曲线Fig. 4 Time evolution of cell viability in the CCCM cultures with different cell concentrations in the post-induction phase.
外源蛋白的表达效率与细胞活性密切相关。传统毕赤酵母发酵后期,细胞活性往往低于70%,说明细胞承受着各种环境压力[24]。甲醇代谢途径的中间代谢产物 (H2O2、甲酸、甲醛等)对细胞具有毒害作用,导致细胞的死亡。尤其是高密度发酵,菌体死亡更为明显,而高死亡率将影响PGL的表达和稳定性。CCCM发酵策略可以有效地提高酵母细胞的活性。如图 4所示,3种不同的恒细胞密度培养方式维持高的细胞活性,细胞存活率都在 92%以上。特别是 DCW 55 g/L和75 g/L的控制策略,存活率在94%以上。相比之下,传统高密度发酵的细胞活力下降很快,诱导120 h后细胞活性仅为83.8%。CCCM培养实现菌体的高活性,主要的原因可能是:1) CCCM 是一种连续培养过程,菌体生长速度快,具有高的稀释率,菌体不断被更新。一部分衰老和死亡细胞被洗出,并被新细胞所取代。CCCM 培养能较好地维持发酵液新老细胞的更替。2) 细胞受到各种压力胁迫下,容易引起菌体死亡。CCCM培养控制细胞密度维持在较为合理水平,细胞受到的由于高密度发酵引起的压力得到缓解。因此,细胞处于较为舒适的外界环境,死亡率下降。
2.3.4 应用恒细胞密度培养降低胞外蛋白酶的降解作用
胞外蛋白酶对异源蛋白的降解作用,一直是重组毕赤酵母高效生产外源蛋白的难题,尤其是发酵后期。因此,很多发酵策略被应用于降低蛋白酶的降解作用,如低温诱导、添加蛋白酶竞争抑制剂等。
CCCM培养具有更高的细胞活性,降低了细胞死亡裂解的蛋白酶的释放水平,因此 CCCM培养的胞外蛋白酶的含量降低。如图 5所示,DCW为55g/L和75 g/L的CCCM发酵策略,诱导120 h后,胞外总蛋白酶分别为1.4 mg/L和1.9 mg/L (Pierce QuantiCleaveTMProtease Assay Kit,胰蛋白酶当量酶活单位)。而传统高密度发酵策略120 h的胞外总蛋白酶达到12 mg/L。胞外蛋白酶总含量随着发酵的进行,不断积累,特别是发酵后期尤为严重。过量胞外蛋白酶的存在,不利于发酵液 PGL的积累,也影响酶的稳定性。
3 讨论
利用基因工程菌重组表达碱性果胶酶是该酶最主要的生产方法[25-26]。在前期发酵优化的基础上,已实现了该酶的工业化生产[14]。本研究以毕赤酵母表达 PGL为模式,研究了细胞密度对重组毕赤酵母表达异源蛋白的影响,并发展了恒细胞密度发酵的新策略。研究表明,细胞密度是影响 PGL生产强度的一个关键因素。合理地控制细胞密度能有效地提高 PGL的表达效率,并提高发酵的适应性。在分批补料培养中,控制合适的诱导初始细胞密度有利于提高 PGL的生产强度,缩短发酵周期。恒细胞密度培养是一种连续培养过程。相比于传统的高密度分批补料发酵,恒细胞密度发酵模式极大地提高了单位菌体和单位体积的生产强度。此外,该发酵策略还具有提高细胞活性和降低胞外蛋白酶的降解作用等优势。因此,恒细胞发酵策略是一种具有潜在价值的重组毕赤酵母工业规模生产 PGL的新方法。虽然恒细胞密度发酵有诸多的优势,但是最终的产物浓度较低,一定程度上制约了该模式的应用。
汪志浩等[27]报道山梨醇作为辅助碳源,能够有效提高碱性果胶酶在重组毕赤酵母中的表达能力。因此,应用双碳源流加以实现恒细胞密度发酵,可作为研究 PGL在毕赤酵母中高效表达的新策略。
[1] Kalantzi S, Mamma D, Christakopoulos P, et al. Effect of pectate lyase bioscouring on physical, chemical and low-stress mechanical properties of cotton fabrics. Bioresour Technol, 2008, 99(17): 8185−8192.
[2] Etters JN. Cotton preparation with alkaline pectinase: an environmental advance. Text Chem Color Am Dyestuff Rep, 1999, 1(3): 33−36.
[3] Agrawal PB, Nierstrasz VA, Warmoeskerken MMCG. Enhanced bioscouring performance. In: Proceedings of the 4th Autex conference. 2004:165−173.
[4] Lenting HBM, Zwier E, Nierstrasz V. Identifying important parameters for a continuous bioscouring process. Text Res J, 2002, 72(9): 825−831.
[5] Hartzell MM, Hsieh YL. Enzymatic scouring to improve cotton fabric wettability. Text Res J, 1998, 68(4): 233−241.
[6] Csiszár E, Losonczi A, Szakács G, et al. Enzymes and chelating agents in cotton pretreatment. J Biotechnol, 2001, 89( 2/3): 271−279.
[7] Potvina G, Ahmada A, Zhang Z. Bioprocess engineering aspects of heterologous protein production in Pichia pastoris: a review. Biochem Eng J, 2012, 64: 91−105.
[8] Plantz BA, Sinha J, Villarete L, et al. Pichia pastoris fermentation optimization: energy state and testing a growth-associated model. Appl Microbiol Biotechnol, 2006, 72(2): 297−305.
[9] Cregg JM, Vedvick TS, Raschke WC. Recent advances in the expression of foreign genes in Pichia pastoris. Nat Biotechnol, 1993, 11(8): 905−910.
[10] Guan B, Jin J, Li HZ. Genetic engineering of Pichia pastoris expression system for improved secretion of heterologous proteins-a review. Acta Microbiol Sin, 2011, 51(7): 851−857.关波, 金坚, 李华钟. 改良毕赤酵母分泌表达外源蛋白能力的研究进展. 微生物学报, 2011, 51(7): 851−857.
[11] Inan M, Aryasomayajula D, Sinha J, et al. Enhancement of protein secretion in Pichia pastoris by overexpression of protein disulfide isomerase. Biotechnol and Bioeng, 2006, 93(4): 771−778.
[12] Gasser B, Dragositsa M, Mattanovich D. Engineering of biotin-prototrophy in Pichia pastoris for robust production processes. Metab Eng, 2010, 12(6): 573−580.
[13] Zhuge B, Du GC, Shen W, et al. Expression of a Bacillus subtilis pectate lyase gene in Pichia pastoris. Biochem Eng J, 2008, 40(1): 92−98.
[14] Wang Y, Hua ZZ, Liu LM, et al. High-level production of alkaline polygalacturonate lyase in recombinant Pichia pastoris. Chin J Biotech, 2008, 24(4): 635−639.王芸, 华兆哲, 刘立明, 等. 重组毕赤酵母高密度发酵生产碱性果胶酶的策略. 生物工程学报, 2008, 24(4): 635−639.
[15] Wang Y, Wang ZH, Xu QL, et al. Lowering induction temperature for enhanced production of polygalacturonate lyase in recombinant Pichia pastoris. Process Biochem, 2009, 44(9): 949−954. [16] Wang Z. Feeding strategies and Large-scale production of alkaline polygalacturonate lyase by recombinant Pichia pastoris[D]. Wuxi: Jiangnan University, 2010.汪志浩. 重组毕赤酵母生产碱性果胶酶的流加策略及工业化放大[D]. 无锡:江南大学,2010.
[17] Zhang JH, Li Y, Liu H, et al. Isolation, phylogenetic analysis of a bacterium with high yield of alkaline pectate lyase and optimization of its culture conditions. Chin J Appl Environ Biol, 2005, 11(3): 354−358.张健红, 李寅, 刘和, 等. 一株碱性果胶酶高产细菌的分离、系统发育分析和产酶条件的初步优化. 应用与环境生物学报, 2005, 11(3): 354–358.
[18] Suye SI, Ogawa A, Yokoyama S. Screening and identification of Candida methanosorbosa as alcohol oxidase-producing methanol using yeast. Agric Biol Chem, 1990, 54(5): 1297−1298.
[19] Tian MY, Huitema E, Da Cunha L, et al. A Kazal-like extracellular serine protease inhibitor from Phytophthora infestans targets the tomato pathogenesis-related protease P69B. J Biol Chem, 2004, 279(25): 26370−26377.
[20] Wang Y, Wang Z, Du G, et al. Enhancement of alkaline polygalacturonate lyase production in recombinant Pichia pastoris according to the ratio of methanol to cell concentration. Bioresour Technol, 2009, 100(3): 1343−1349.
[21] Jin H, Liu GQ, Ye XF, et al. Enhanced porcine interferon-α production by recombinant Pichia pastoris with a combinational control strategy of low induction temperature and high dissolved oxygen concentration. Biochem Eng J, 2010, 52(1): 91−98.
[22] Jungo C, Schenk J, Pasquier M, et al. A quantitative analysis of the benefits of mixed feeds of sorbitol and methanol for the production of recombinant avidin with Pichia pastoris. J Biotechnol, 2007, 131(1): 57−66.
[23] Inan M, Meagiher MM. Non-repressing carbon sources for alcohol oxidase (AOX1) promoter of Pichia pastoris. J Biosci Bioeng, 2001, 92(6): 585−589.
[24] Hohenblum H, Borth N, Mattanovich D. Assessing viability and cell-associated product of recombinant protein producing Pichia pastoris with flow cytometry. J Biotechnol, 2003, 102(3): 281−290.
[25] Liu L, Wang ZH, Zhang DX, et al. Advances in microbial production of alkaline polygalacturonate lyase and its application in clean production of textile industry. Chin J Biotech, 2009, 25(12): 1819−1828.刘龙, 汪志浩, 张东旭, 等. 碱性果胶酶的生物制造及其在纺织工业清洁生产中的应用研究进展. 生物工程学报, 2009, 25(12): 1819−1828.
[26] Wang XF, Sun YC, Shen XG, et al. Expression of a pectin lyase A gene from Aspergillus niger in Pichia pastoris GS115. Chin J Biotech, 2011, 27(12): 1755−1764.汪小锋, 孙永川, 申旭光, 等. 毕赤酵母中表达透明颤菌血红蛋白提高重组脂肪酶的表达. 生物工程学报, 2011, 27(12): 1755−1764.
[27] Wang ZH, Zhang DX, Li JH, et al. Effects of mixed carbon sources in cultivation of recombinant Pichia pastoris for polygalacturonate lyase production. Chin J Biotech, 2009, 25(12): 1955−1961.汪志浩, 张东旭, 李江华, 等. 混合碳源流加对重组毕赤酵母生产碱性果胶酶的影响. 生物工程学报, 2009, 25(12): 1955−1961.