过表达miR-103促进猪前体脂肪细胞分化
李美航,仇杨,刘帅,董培越,宁小敏,李艳杰,杨公社,孙世铎
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
MicroRNA是19~24个核苷酸长度的单链非编码RNA,它能够特异性识别其靶基因mRNA的 3¢UTR序列,以不完全互补配对方式与之结合,从而在转录后水平抑制靶基因表达。microRNA参与生长发育、细胞增殖、疾病发生等几乎所有的生物学过程,在动植物中发挥广泛的调节基因表达的作用[1]。研究表明一些microRNA 在脂肪细胞中发挥重要作用,如miR-27a/b、miR-138等是抑制成脂的microRNA,而Let-7、miR-335、miR-143、miR-122和miR-378等能够促进脂肪细胞分化[2-9]。
MiR-103是机体中重要的 microRNA,Graziano Martello等发现miR-103/107靶作用于microRNA成熟所必需的Dicer酶,miR-103/107表达变化对其他 microRNAs产生广泛的影响,其表达上调还能促进肿瘤的形成与迁移[10];Mirko Trajkovski等证实抑制miR-103导致糖耐量和胰岛素敏感性升高[11];Bernard等预测miR-103可能参与细胞内乙酰辅酶A和脂质的代谢[12]。但miR-103在猪前体脂肪细胞成脂分化中的作用尚不明确。另外,本实验室提取3日龄与180日龄荣昌猪背部脂肪组织 RNA进行 solexa测序分析。在129个表达量差异显著microRNA中,miR-103在大猪中是小猪的3.4倍,且在大猪小猪的脂肪组织中均有较高的表达丰度,预示着 miR-103在脂肪细胞的发育过程中存在作用。
本研究检测了 miR-103在猪原代前体脂肪细胞分化过程中的表达模式,构建了miR-103的腺病毒超表达载体,用其侵染猪原代前体脂肪细胞并进行诱导分化,使用无靶位点的乱序miRNA——miR-NTC (miR-nontargeting control)作为对照,采用Real-time PCR和Western blotting手段检测脂肪细胞成脂标记基因 PPARγ与 aP2的 mRNA及蛋白水平变化,进而明确 miR-103在猪前体脂肪细胞分化中的作用。PPARγ (过氧化物酶体增殖物激活受体 γ) 主要表达于脂肪组织及免疫系统,具有脂肪组织特异性。PPARγ在许多脂肪细胞基因转录激活前被脂肪酸及外源性过氧化物酶体增殖剂诱导,对脂肪细胞分化具有重要作用[13-17];aP2/FABP4 (脂肪细胞型脂肪酸结合蛋白) 是一些小的、存在于细胞内的蛋白质, 主要在脂肪细胞和巨噬细胞中表达,参与炎症反应与脂类代谢,是 PPARγ的直接下游靶基因[18-21]。PPARγ、aP2是除 C/EBPα、C/EBPβ、SREBP1c等之外,目前常用的脂肪沉积标记基因,被广泛用作验证目的基因成脂功能的检测指标[22-24]。
1 材料与方法
1.1 材料
1.1.1 实验动物、细胞株与载体
猪原代前体脂肪细胞取自杨凌光明猪场健康长白仔猪,由于3日龄仔猪体内含有较多的前体脂肪组织,故选其为实验动物。293A细胞系购于中国科学院上海生命科学研究院。293A (293Adhere)含有腺病毒基因组E1A和E1B区域,使得缺失E1基因的腺病毒重组载体得以在其中包装出毒,且293A细胞具有倾向于形成单层细胞,便于空斑计数测定病毒滴度,转染效率高,易产生高滴度腺病毒等优点,是腺病毒的包装扩繁的常用细胞。pAdmiR-NTC (miR-nontargeting control)、pAdTrack-CMV及骨架载体pAd-easy均为实验室保存。
1.1.2 主要试剂与仪器设备
胎牛血清购自Hyclone公司;Lipofectamine 2000、PVDF 膜均购自 Invitrogen公司;DMEM/F12培养基、I型胶原酶购于Gibco;油红O染料,aP2、β-actin一抗购自Santa Cruz公司;Real-time PCR试剂盒、反转录试剂盒购于TaKaRa公司;地塞米松、IBMX、胰岛素均购自Sigma公司;PPARγ、aP2与GAPDH实时定量引物购于生工生物工程 (上海) 有限公司;miR-103与内参U6的实时定量引物由广州锐博生物科技有限公司设计合成。
所用仪器设备有:Bio-Rad PCR仪、iQ5 Multicolor Real-Time PCR Detection System、Molecular Imager ChemiDocTMXRS+凝胶成像系统 (美国Bio-Rad公司);REVOC CO2细胞培养箱,Olympus IX71倒置相差显微镜;NIKON Microscope Digital Camera Model DP71显微成像系统及荧光显微镜 (日本NIKON)。
1.2 方法
1.2.1 miR-103的序列查询及同源性比对
miRbase (http://www.mirbase.org/index.shtml)是microRNA的信息数据库,记录了microRNA在基因组中的定位、亚型、前体序列、成熟序列等完整信息。截止到目前,miRbase共收录了168个物种的18 226种前体microRNA和21 643种成熟microRNA。登陆miRbase数据库,查询猪miR-103的前体 (pre-miR-103) 序列,使用primer5.0设计带有限制性内切酶XhoⅠ与KpnⅠ序列的引物,并搜索人、鼠、猪、牛、马、狗等哺乳动物的miR-103成熟序列,进行同源性比对。
1.2.2 猪 MiR-103腺病毒的载体构建、包装与扩繁
用带有限制性内切酶XhoⅠ与KpnⅠ序列的引物扩增miR-103前体,之后连接到腺病毒穿梭载体pAdTrack-CMV中,经PmeⅠ线性化后,与Easy骨架载体重组,最后进行PacⅠ酶切鉴定和测序鉴定。构建好的质粒载体用PacⅠ酶切线性化后,乙醇沉淀纯化。将293A细胞以2×104细胞/cm2的密度接种于60 mm培养皿,待细胞融合至70%~80%时,参考Lipofectamine 2000说明书,用纯化的腺病毒质粒载体转染293-A细胞进行包装。待7~14 d,整皿细胞都出现荧光,细胞部分飘起时,将细胞收集到冻存管中,加入1 mL培养基于-80 ℃和37 ℃反复冻融3~4次,收集上清,-80 ℃保存。将293A细胞以5×106细胞/cm2的密度接种于100 mm培养皿中,待细胞融合至90%加入病毒上清进行扩繁,36~48 h后收集细胞,以同样的方法收集病毒上清,用于后续实验使用。
1.2.3 猪原代脂肪细胞的培养与腺病毒侵染
实验室已建立完善的原代细胞取材与培养方法:将3日龄仔猪在含有新吉尔灭的温水中清洗30 min,电击致死。于无菌工作台中取仔猪后颈、肩胛及背部皮下脂肪组织,PBS清洗3次,用眼科剪剪成 1 mm3大小的碎块。用胶原酶在37 ℃水浴振荡锅中消化1 h;消化结束后用等体积的完全培养液 (含 10%胎牛血清的DMEM/F12培养基) 中和消化液,消化物依次通过孔径为100 mm和25 mm的尼龙筛,收取过滤液,离心10 min (2 000 r/min)。弃上清液,加入红细胞裂解液,吹打均匀,室温静置10 min。离心5 min (2 000 r/min),弃上清液;再用完全培养液重悬细胞,再离心1~2次。然后,将消化分离出的细胞稀释,吹打均匀后以5×104细胞/cm2的密度接种于60 mm培养皿,加入3 mL含完全培养液,置于含有5% CO2的37 ℃恒温培养箱培养。次日将细胞用PBS清洗3次后换液,之后隔天换液[25]。待接种的细胞融合至70%~80%,弃去培养基,加入miR-103腺病毒上清300 μL培养3 h,之后换成10%胎牛血清DMEM/F12培养基培养至完全融合。
1.2.4 油红O染色
待猪原代脂肪细胞融合后,采用鸡尾酒诱导液 (配方:以DMEM/F12完全培养基为基础并含有10%胎牛血清,1 μmol/L地塞米松,0.5 mmol/L IBMX,10 μmol/L胰岛素) 诱导脂肪细胞分化,在诱导第8天进行油红O染色。首先配制油红O原液,称取油红O粉末0.5 g溶于100 mL异丙醇,60 ℃水浴至完全溶解,即为油红O原液,4 ℃可长期储存。按原液与去离子水3∶2的比例混匀后用滤纸过滤3遍,室温静置10 min使杂质沉淀,即为油红O染液。将需染色的细胞带出细胞间,弃去培养基并用PBS清洗3次,加入2 mL的4%多聚甲醛37 ℃固定45 min,缓慢加入PBS清洗3次,然后加入适量预先准备好的油红O染液,37 ℃静置30 min,再用PBS清洗直至无杂质残留。置于显微镜下观察、拍照。
1.2.5 实时荧光定量PCR (Real-time PCR)
用PBS清洗细胞,使用DEPC水处理过的枪头及离心管用 Trizol法提取细胞总 RNA,DEPC处理水溶解,分别用1%琼脂糖凝胶电泳和核酸定量仪检测总RNA的质量及浓度,-80 ℃保存。成脂标记基因PPARγ、aP2与microRNA分别用Oligo (dT) 随机引物和microRNA特异性反转录引物反转。参照TaKaRa公司的Real-time PCR说明书,采用20 μL体系对PPARγ、aP2和miR-103进行定量分析,引物见表1。
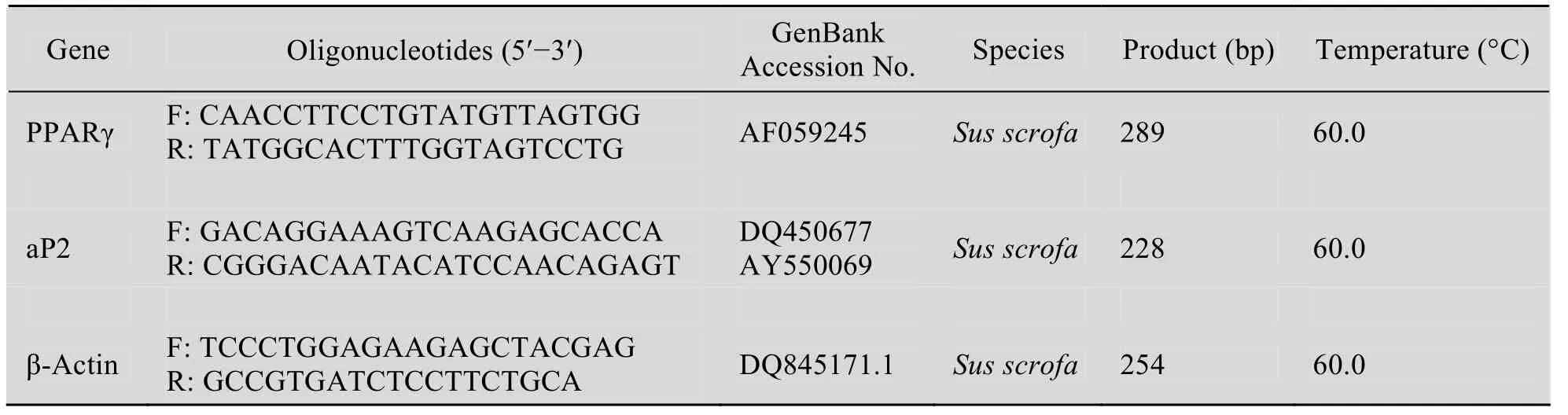
表1 实时定量PCR相关基因的引物序列及参数Table 1 Primer sequences and parameters for real-time PCR of related genes
1.2.6 Western blotting
在细胞间内弃去培养皿中的培养基,PBS清洗3次,用胰酶将细胞消化下来,收集到1.5 mL离心管中,带出细胞间,加入1 mL PBS吹打均匀,5 000 r/min离心3 min,弃上清,-80 ℃保存。使用时,加入200 mL含1% PMSF (蛋白酶抑制剂) 的细胞裂解液,4 ℃、12 000 r/min离心5 min,取上清,用BCA法绘制标准曲线将蛋白定量。加入适量含1% PMSF的细胞裂解液调整蛋白浓度,使样品浓度均一化。按与上清 1∶1的比例加入2×上样缓冲液,100 ℃煮沸10 min,分装后保存。配制蛋白质电泳胶,吸取20 μL蛋白样品上样,电泳分离,然后转移到PVDF膜 (硝酸纤维素膜) 上,5%脱脂奶粉封闭2 h,用aP2与β-actin的一抗孵育过夜,次日再用二抗孵育2 h,Bio-Rad GS-800曝光系统显示结果,使用Quantity One Manuel软件换算成数值,绘制柱形图。
1.2.7 统计学分析
采用SPSS 11.5统计软件One-way ANOVA进行方差分析与显著性检验。实验数据以±s表示。P<0.05时差异显著。
2 结果
2.1 miR-103的引物设计与同源性比对
在miRbase数据库中查询可知,miR-103定位于猪PANK3基因的第5个内含子中。随后在多个物种中查询miR-103序列,结果显示,虽然miR-103的前体序列不尽相同,但其成熟序列在猪、人、小鼠、大鼠、牛、马、狗等哺乳动物中高度保守,同源性达100% (图1)。
2.2 pre-miR-103腺病毒超表达载体构建
2.2.1 pre-miR-103腺病毒质粒载体构建
用带有 XhoⅠ和 KpnⅠ酶切位点的引物从Pgenesile1.2质粒载体上克隆长为100 bp、带酶切位点序列的pre-miR-103 (图2A);将回收的目的片段插入到pAdTrack-CMV载体中,转化大肠杆菌DH5α后测序鉴定;含pre-miR-103的穿梭载体与Easy骨架载体重组。经PacⅠ酶切后,出现一条4.5 kb的小片段和一条23 bp的大片段,说明重组成功 (图 2B),测序鉴定 (正反向测序拼接) 结果显示,所测得序列与miRbase中序列完全一致 (图2C)。
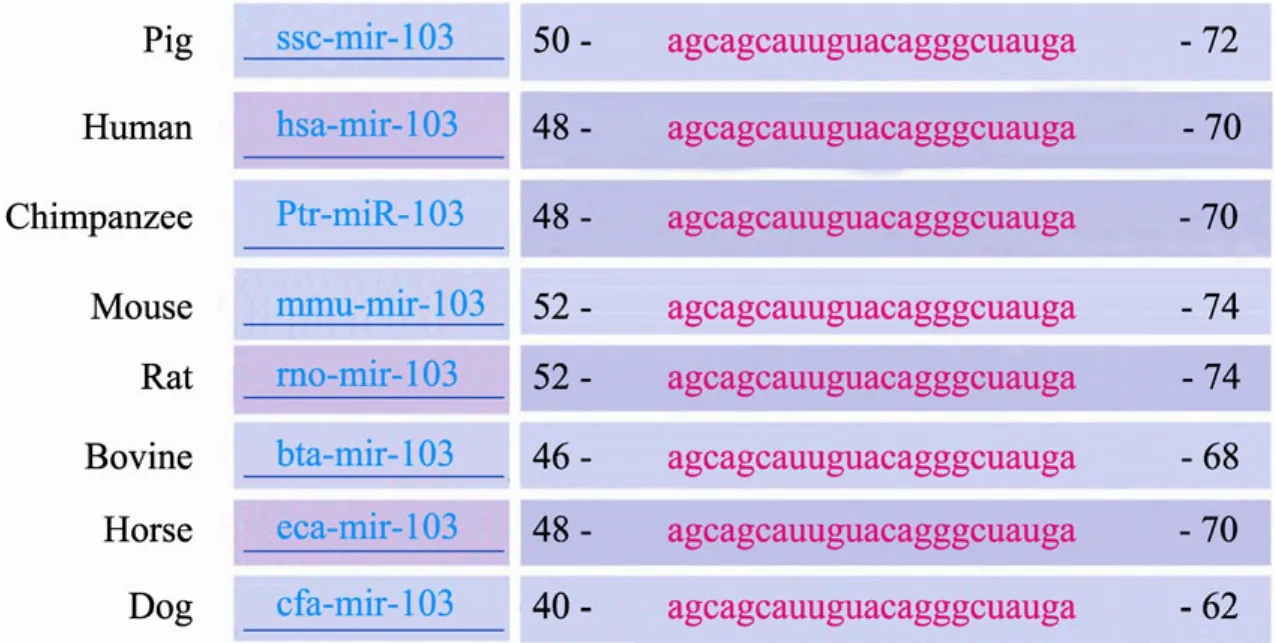
图1 miR-103成熟序列的同源性比对Fig. 1 Homologous comparison of mature sequence of miR-103. When compared swine miR-103 mature sequence with that of human, chimpanzee, mouse, rat, bovine, horse and dog, apparent consistency can be seen.
2.2.2 pre-miR-103腺病毒的包装与扩繁
将构建好的重组腺病毒载体 pAd-premiR-103用PacⅠ酶切后,乙醇沉淀纯化,用脂质体2000转化约70%融合的293A细胞。荧光显微镜下观看,第1天有少量的细胞表达GFP荧光 (图 3A-B),第 3天隐约可见成簇的荧光存在 (图 3C),第 5天时已有大量的荧光表达(图 3D),到第 7天荧光最亮处的细胞大片飘起(图3E),表明腺病毒已经成熟。收集病毒进行扩繁 (图3F)。

图2 pre-miR-103腺病毒质粒载体的构建Fig. 2 Construction of pre-miR-103 adenovirus plasmid vector. (A) Clone the sequence of pre-miR-103 from Pgenesile-1.2. M: marker; 1: pre-miR-103. After the construction of adenovirus plasmid vector was done, digested with Pac I. (B) M: Hind III marker; 1: easy vector contains pre-miR-103 digested with Pac I. (C) Sequencing map of recombinant adenovirus vector pAd-pre-miR-103. (a) shows part of nucleotides of reverse sequencing, which are exactly identical with sequence of pre-miR-103 from 1 to 43 bp; (b) is part of nucleotides of forward sequencing, which are identical with pre-miR-103 sequence from 38 bp to the end. These two parts jointly proved the accuracy of the inserted pre-miR-103 sequence.
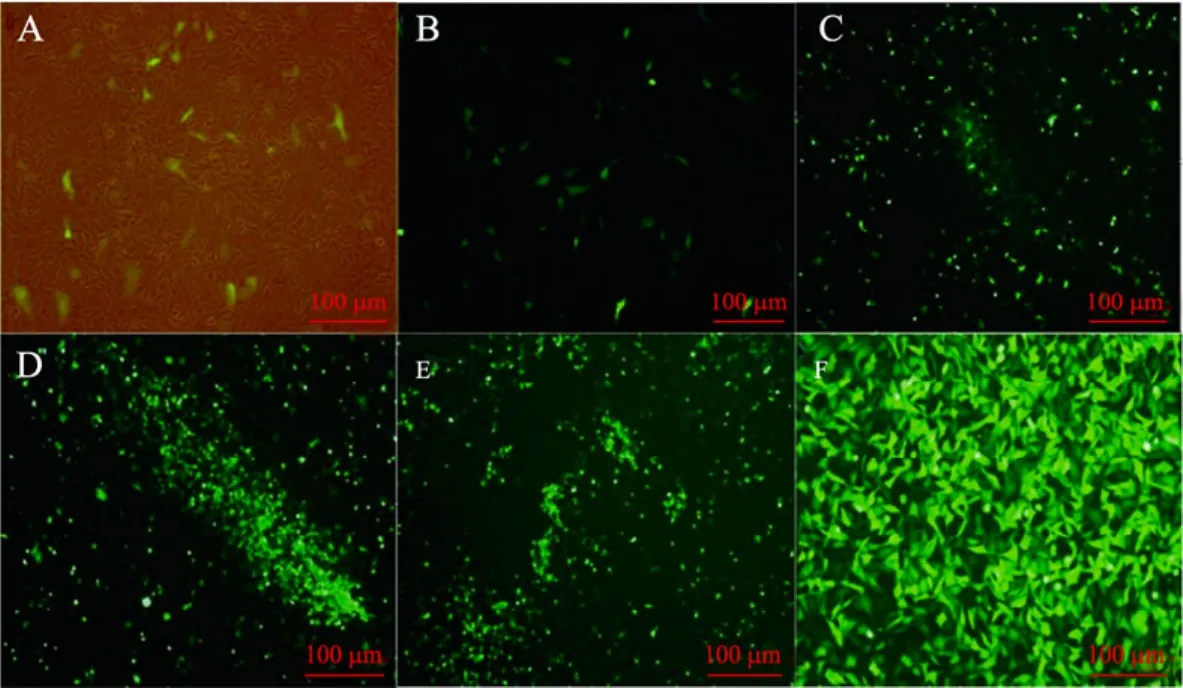
图3 重组腺病毒载体pAd-pre-miR-103的包装Fig. 3 The package of recombinant adenovirus vector pAd-pre-miR-103. (A-B) The first day after 293A cells transfected with pAd-pre-miR-103, few cells expressed EGFP. (C) In the third day, we can indistinctly see clusters of cells fluoresced. (D) In the fifth day, the EGFP expression increased rapidly, and the shape of EGFP was like a comet tail. (E) In the seventh day, above 95% of 293A cells expressed EGFP, and cells that fluoresced first, began to float. (F) PAd-miR-103 proliferated in 293A cells.
2.3 miR-103超表达促进猪原代脂肪细胞分化
培养猪原代脂肪细胞,分别在诱导成脂的0、2、4、6、8 d收集细胞,提取总RNA。Real-time PCR分析miR-103与PPARγ的表达水平,结果显示,miR-103的表达趋势变化与成脂基因一致(图4E)。pAd-miR-NTC与pAd-miR-103分别侵染猪原代脂肪细胞 (图4A-B),48 h后提取细胞总 RNA,用特异性反转录引物反转成 cDNA,Real-time PCR结果显示,超表达miR-103后其表达量升高了 3.7倍 (P<0.05) (图 4F)。收集pAd-miR-103侵染后,诱导成脂0、2、4、6、8 d的细胞,Real-time PCR结果显示,从第2天起,成脂标记基因 PPARγ、aP2的表达量与pAd-miR-NTC转染组相比显著升高 (P<0.05) (图 4H-I);与 Real-time PCR检测结果一致,pAd-miR-103侵染的细胞成脂分化8 d后提取总蛋白,Western blotting检测结果表明,aP2蛋白水平表达明显增加 (P<0.05) (图4G);油红O染色可见miR-103侵染后脂滴聚集增多 (诱导后第8天) (图4C-D)。说明miR-103可促进猪前体脂肪细胞成脂。
3 讨论
近年来,随着人们生活水平的提高,肥胖引起的代谢类疾病如糖尿病、高血压、冠心病等逐渐成为影响人类健康的又一结症。研究表明,MicroRNA是一种由内源基因编码的,长约22 nt的非编码RNA,在转录后水平抑制靶基因mRNA的翻译[26]可在脂肪细胞的分化与代谢中发挥重要作用,如miR-27b、miR-27a可通过抑制PPARγ的表达抑制脂肪细胞分化[2-3],miR-378可促进甘油三酯形成[5]等。因此继续寻找新的影响脂肪细胞分化代谢的microRNA成为科研工作者研究的新目标。
猪与人的基因组有83%相似,且与其他动物相比,猪的器官与人的大小最为相近[27-29],因此,近年来猪被作为研究人类疾病和器官移植的模式生物而广泛研究。本实验室提取3日龄与180日龄荣昌猪背部脂肪组织RNA进行solexa测序分析,拟在筛选猪脂肪细胞发育过程中重要的microRNA。分析结果显示有 129 个 microRNA表达量差异显著,其中miR-103在大猪中是小猪的3.4倍,且在大猪小猪的脂肪组织中均有较高的表达丰度,预示着miR-103在脂肪细胞的发育过程中存在作用,因此选择miR-103作进一步深入研究。
实验中 miR-103的超表达使用了腺病毒作为载体,其与逆转录病毒和慢病毒相比,具有安全性高、易扩繁、滴度高、靶细胞种类多、侵染效率高、不整合到宿主基因组中等优点,是基因治疗研究的首选载体[30]。本实验室李国喜博士早期使用miR-103抑制剂 (miR-103 inhibitor) 研究miR-103对成脂的作用[31],inhibitor与腺病毒相比,侵染效率远不如后者。因此本实验使用腺病毒超表达的方法研究 miR-103对猪前体脂肪细胞分化的作用,不仅是对李国喜博士miR-103干扰实验的补充,同时也更具说服力。从图3C可看出,经293A细胞包装扩繁的腺病毒几乎100 %感染猪前体脂肪细胞,侵染效率极高。在MicroRNA的Real-time PCR实验中选择了茎环结构的microRNA特异性反转录引物,这是由于microRNA的3¢末端没有类似mRNA的Poly (A)尾巴,而反转录中普遍使用的Oligo (dT) 引物是通过与mRNA 3¢端的Poly (A) 尾互补结合,进而反转出完整 cDNA[32],因此不适合于缺乏Poly (A) 尾的 microRNA。本实验使用茎环结构的microRNA特异性反转录引物,替代了普通的Oligo (dT) 引物,有效提高反转录的效率和特异性[33]。
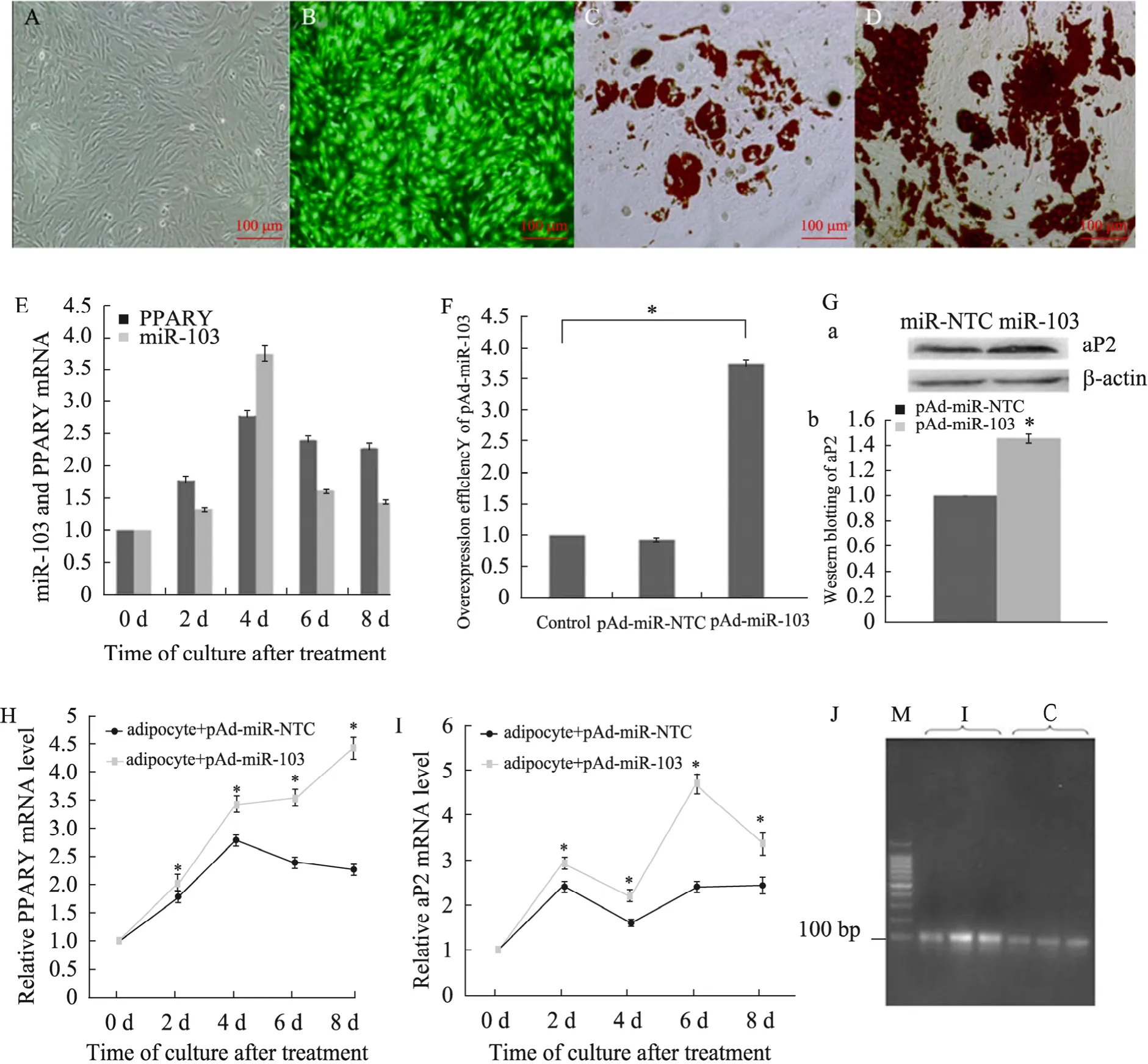
图4 MiR-103促进猪前体脂肪细胞分化Fig. 4 MiR-103 promote adipogenesis of porcine preadipocyte. (A) Porcine preadipocyte before being infected by pAd-pre-miR-103. (B) Porcine preadipocyte after being infected by pAd-pre-miR-103. (C-D) Oil red O stain of porcine adipocyte after 8days’ induction which infected with pAd-miR-NTC and pAd-pre-miR-103. (E) Real-time PCR(n=3) showed similar tendency of expression level of miR-103 and PPARγ mRNA during adipocyte differentiation of porcine preadipocyte. (F) The overexpression efficiency of miR-103 was detected by real-time PCR (n=3) after 48 h after being infected. The resource of control was the mRNA of porcine preadipocyte without any treatment, and cultivated for the same days and (J) is the picture of the agarose gel electrophoresis after real-time PCR. M: 100 bp ladder; I: pAd-pre-miR-103 infected preadipocyte; C: preadipocyte without any treatment. (G) In the 8th day, aP2 expression was tested by Western blotting (a is the exposure picture, b is quantitative result). (H−I) The detection of PPARγ and aP2 mRNA expression level using real-time PCR(n=3). Their expression level in pAd-miR-NTC infected porcine preadipocyte was significantly higher than that in pAd-miR-103 infected cells in day2, 4, 6, 8 after induced differentiation (*P < 0.005).
总之,本实验成功地构建了miR-103重组腺病毒载体pAd-pre-miR-103,并用其以几乎100%的侵染效率感染原代培养的猪前体脂肪细胞。检测发现成脂标记基因PPARγ和aP2的mRNA与蛋白水平均有显著上升,油红O染色后显微镜下可见更多的脂滴聚集;在 miRbase中查找miR-103成熟序列,发现其在猪、人、黑猩猩、小鼠、大鼠、牛、马、狗等哺乳动物中同源性达到100%。以上结果共同证明miR-103能够促进脂肪细胞分化,鉴于其在哺乳动物中的高保守性,miR-103亦可为治疗人类由肥胖引起的代谢疾病提供新的思路。
[1] Ambros V. The functions of animal microRNAs. Nature, 2004, 431(7006): 350−355.
[2] Karbiener M, Fischer C, Nowitsch S, et al. microRNA miR-27b impairs human adipocyte differentiation and targets PPARγ. Biochem Biophys Res Commun, 2009, 390(2): 274−251.
[3] Kim SY, Kim AY, Lee HW, et al. miR-27a is a negative regulator of adipocyte differentiation via suppressing PPARγ expression. Biochem Biophys Res Commun, 2010, 392(3): 323−328.
[4] Nakanishi N, Nakagawa Y, Tokushige N, et al. The up-regulation of microRNA-335 is associated with lipid metabolism in liver and white adipose tissue of genetically obese mice. Biochem Biophys Res Commun, 2009, 385(4): 492−496.
[5] Gerin I, Bommer GT, McCoin CS, et al. Roles for miRNA-378/378* in adipocyte gene expression and lipogenesis. Am J Physiol Endocrinol Metab, 2010, 299(2): E198−E206.
[6] Esau C, Davis S, Murray SF, et al. miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting. Cell Metab, 2006, 3(2): 87−98.
[7] Takanabe R, Ono K, Abe Y, et al. Up-regulated expression of microRNA-143 in association with obesity in adipose tissue of mice fed high-fat diet. Biochem Biophys Res Commun, 2008, 376(4): 728−732.
[8] Yang Z, Bian CJ, Zhou H, et al. MicroRNA hsa-miR-138 inhibits adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells through adenovirus EID-1. Stem Cells Dev, 2011, 20(2): 259−267.
[9] Sun TW, Fu MG, Bookout AL, et al. MicroRNA let-7 regulates 3T3-L1 adipogenesis. Mol Endocrinol, 2009, 23(6): 925−931.
[10] Martello G, Rosato A, Ferrari F, et al. A microRNA targeting dicer for metastasis control. Cell, 2010, 141(7): 1195−1207.
[11] Trajkovski M, Hausser J, Soutschek J, et al. MicroRNAs 103 and 107 regulate insulin sensitivity. Nature, 2011, 474(7353): 649−653.
[12] Wilfred BR, Wang WX, Nelson PT, et al. Energizing miRNA research: a review of the role of miRNAs in lipid metabolism, with a prediction that miR-103/107 regulates human metabolic pathways. Mol Genet Metab, 2007, 91(3): 209−217.
[13] Desvergne B, Wahli W. Peroxisome proliferator-activated receptors: nuclear control of metabolism. Endocr Rev, 1999, 20(5): 649−688.
[14] Kliewer SA, Forman BM, Blumberg B, et al. Differential expression and activation of a family of murine peroxisome proliferator-activated receptors. Proc Natl Acad Sci USA, 1994, 91(15): 7355−7359.
[15] Zhu Y, Alvares K, Huang Q, et al. Cloning of a new member of the peroxisome proliferator-activated receptor gene family from mouse liver. J Biol Chem, 1993, 268(36): 26817–26820.
[16] Rosen ED, Spiegelman BM, et al. PPARγ: a nuclear regulator of metabolism, differentiation, and cell growth. J Biol Chem, 2001, 276 (41): 37731−37734.
[17] Rosen ED, Sarraf P, Troy AE, et al. PPARγ is required for the differentiation of adipose tissue in vivo and in vitro. Mol Cell, 1999, 4(4): 611−617.
[18] Chmurzyñska A. The multigene family of fatty acid-binding proteins (FABPs): function, structure and polymorphism. J Appl Genet, 2006, 47(1): 39−48.
[19] Adida A, Spener F. Adipocyte-type fatty acid-binding protein as inter-compartmental shuttle for peroxisome proliferator activated receptor γ agonists in cultured cell. Biochim Biophys Acta, 2006, 1761(2): 172−181.
[20] Matarese V, Bernlohr DA. Purification of murine adipocyte lipid-binding protein. characterization as a fatty acid- and retinoic acid-binding protein. J Biol Chem, 1988, 263(28): 14544−14551.
[21] Tontonoz P, Hu E, Graves RA, et al. mPPAR gamma 2: tissue-specific regulator of an adipocyte enhancer. Genes Dev, 1994, 8(10): 1224−1234.
[22] Kajimoto K, Naraba H, Iwai N. MicroRNA and 3T3-L1 pre-adipocyte differentiation. RNA, 2006, 12(9): 1626−1632.
[23] Yang Z, Bian CJ, Zhou H, et al. MicroRNA hsa-miR-138 inhibits adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells through adenovirus EID-1. Stem Cells Dev, 2011, 20(2): 259−267.
[24] Sun TW, Fu MG, Bookout AL, et al. MicroRNAlet -7 regulates 3T3-L1 adipogenesis. Mol Endocrinol, 2009, 23(6): 925−931.
[25] Qu CQ, Zhang GH, Chen FF, et al. Primary culture of porcine preadipocyte. J Agric Biotechnol, 2005, 13(5): 649−653.屈长青, 张国华, 陈粉粉, 等. 猪前体脂肪细胞的原代培养. 农业生物技术学报, 2005, 13(5): 649−653.
[26] Lee Y, Jeon K, Lee JT, et al. MicroRNA maturation: stepwise processing and subcellular localization. EMBO J, 2002, 21(17): 4663−4670.
[27] Frönicke L, Chowdhary BP, ScherthaN H, et al. A comparative map of the porcine and human genomes demonstrates ZOO-FISH and gene mapping-based chromosomal homologies. Mamm Genome, 1996, 7(4): 285−290.
[28] Shah G, Azizian M, Bruch D, et al. Cross-species comparison of gene expression between human and porcine tissue, using single microarray platform-preliminary results. Clin Transplant, 2004, 18(S12): 76−80.
[29] Ibrahim Z, Busch J, Awwad M, et al. Selected physiologic compatibilities and incompatibilities between human and porcine organ systems. Xenotransplantation, 2006, 13(6): 488−499.
[30] Wilson JM. Adenoviruses as gene-delivery vehicles. N Engl J Med, 1996, 334(18): 1185−1187.
[31] Li GX. Identification of microRNAs related to the swine adipose tissue development and primary research on the biological roles of miR-103[D]. Yangling: Northwest A&F University, 2011.李国喜. 猪脂肪组织发育相关 miRNA的鉴定及miR-103生物学功能的初步研究[D]. 杨凌: 西北农林科技大学, 2011.
[32] Okayama H, Berg P. High-efficiency cloning of full-length cDNA. Mol Cell Biol, 1982, 2(2): 161−170.
[33] Chen CF, Ridzon DA, Broomer AJ, et al. Real-time quantification of microRNAs by stem-loop RT-PCR. Nucleic Acids Res, 2005, 33(20): e179.