重组海洋细菌漆酶Lac15脱色人工合成纺织染料的潜力
房伟,方泽民,常飞,彭惠,张学成,肖亚中
1 安徽大学生命科学学院,安徽 合肥 230039
2 安徽省微生物与生物催化工程技术研究中心,安徽 合肥 230039
合成染料 (Synthetic dye) 在纺织工业的规模化应用中产生了大量的染料废水,造成了严重的环境污染问题。印染废水的处理方法有物理法、化学法及生物法等,但是物理法、化学法不能完全破坏难降解染料化合物的结构,易产生二次污染[1-2]。生物法具有脱色率高、运行成本低、绿色环保的优势,是处理印染废水的有效手段[3-4]。
生物法处理难降解染料主要依靠各类微生物转化酶,如漆酶、锰过氧化物酶等[5]。漆酶(Laccase,EC 1. 10. 3. 2) 是一类含铜的多酚氧化酶,其活性中心含有4个铜原子,底物在单核铜中心失去电子被氧化,氧分子在三核铜中心得到电子被还原成水。漆酶作用的底物特异性不强,能够催化多种酚类和非酚类化合物氧化;在介体存在的条件下,漆酶的作用底物范围更为广泛。宽泛的作用底物以及环境友好的催化特性,使漆酶在染料脱色、生物修复及生物漂白等领域显示出良好的应用潜力[6-7]。
真菌漆酶的纺织工业染料脱色已经得到较多研究,其中以白腐真菌 (White rot fungi) 来源的漆酶研究较多[8]。真菌漆酶在偏酸或中性条件下,具有较好的脱色效果,而在偏碱性、氯离子存在的条件下难以发挥作用[9-11]。细菌漆酶拥有不同于真菌漆酶的特性,如在偏碱性条件下催化活性高、卤族离子耐受性强等,在合成染料脱色中的应用潜力受到关注[12-18]。不断发掘新型细菌漆酶,并探讨其在偏碱性等条件下的染料脱色能力,对于扩大新型工业用酶的种类、推进漆酶的产业化应用进程具有重要意义。
我们前期通过元基因组文库技术从海洋微生物筛选获得了新型细菌漆酶 Lac15 (GenBank Accession No. ADM87301),其氨基酸序列与已报道的细菌漆酶的序列一致性低于40%。rLac15有优良的卤元素耐受性,耐受浓度Ki为1 mol/L,并显示了良好的常用纺织工业染料脱色潜能[13]。本文在前期工作的基础上,进一步优化了rLac15对部分蒽醌类和偶氮类人工合成纺织染料脱色条件,考察了介体、给酶量、反应pH、染料浓度以及温度对脱色效果的影响,为其工业化应用奠定基础。
1 材料与方法
1.1 材料
漆酶表达菌株E. coli BL21 (DE3)/pET22b-lac15为本实验室构建;丁香醛联氮 (Syringaldazine),ABTS (2,2'-azino-bis (3-ethylbenzothazoline-6-sulfonate)),HBT (1-hydroxybenzotriazole),丁香酸甲酯 (Methylsyringate),丁香醛 (Syringaldehyde)购自Sigma公司;染料由江苏省泰兴市锦鸡染料有限公司馈赠,或购自上海生工生物工程有限公司 (表1)。
1.2 方法
1.2.1 漆酶制备及纯化
E. coli BL21(DE3)/pET22b-lac15 接种于液体LB培养基,37 ℃培养至OD600达到0.6,加入终浓度为0.2 mmol/L IPTG,16 ℃诱导表达10 h。收集菌体,超声破碎,30 000×g 离心30 min,收集上清,利用Ni-NTA柱亲和纯化蛋白, 纯化过程参照Novagen使用说明书。SDS-PAGE电泳检测蛋白纯度,BCA法 (Bio-Rad) 测定蛋白浓度。
1.2.2 漆酶活力测定
以丁香醛联氮为底物考察漆酶活力,测定方法参照Fang等[13]。酶活力单位 (U) 定义为每分钟氧化1 μmol丁香醛联氮所需的酶量。
1.2.3 染料脱色率测定体系
采用1 mL反应体系,包括Na2HPO4-KH2PO4缓冲液 (50 mmo/L,pH 7.5)、不同终浓度的染料,rLac15以及介体。各脱色体系在45 ℃反应1 h,在各染料最大吸收波长处检测吸收值。
脱色率 (%) =[ (A0−At)/A0]×100对照组添加等量100 ℃失活的酶液,A0、At分别为对照组和实验组反应t小时后在最大吸收波长处的吸光值。

表1 染料类型和性质Table 1 Dye classification and maximum absorbance wavelengths
1.2.4 介体对染料脱色的影响
分别使用ABTS、丁香酸甲酯、丁香醛或HBT为介体,终浓度为100 μmo/L,以表1所列11种染料 (50 μmol/L) 为底物,测定脱色率以获得最优介体。
1.2.5 给酶量对染料脱色的影响
以 50 μmol/L M-2GE或 AR-6B为底物,100 μmo/L丁香酸甲酯作为介体,测定反应体系给酶量分别为10、20、40、80 U/L时脱色率的变化。
1.2.6 pH对染料脱色的影响
选取100 μmol/L M-2GE、K-7R、KE-R或AR-6B为底物,在不同pH (6.5~9.5) 条件下测定脱色率。缓冲体系分别为 50 mmo/L Na2HPO4-KH2PO4缓冲液 (pH 6.5~8.5),50 mmo/L Tris-HCl缓冲液 (pH 8.5~9.5) 和50 mmo/L Gly-NaOH缓冲液 (pH 8.5~9.5)。
1.2.7 染料浓度对染料脱色的影响
分别以 100~400 μmol/L M-2GE、K-7R、KE-R或AR-6B为底物,100 μmo/L丁香酸甲酯作为介体,给酶量为20 U/L,考察脱色率的变化以确定染料浓度对脱色的影响。
1.2.8 温度对染料脱色的影响
分别以200 μmol/L M-2GE、K-7R、KE-R或AR-6B为底物,在50 mmol/L Na2HPO4-NaH2PO4(pH 8.5) 缓冲体系中,25~55 ℃ (间隔10 ℃) 条件下,反应24 h,测定脱色率的变化以确定温度对脱色的影响。
2 结果与分析
2.1 rLac15的纯化及酶活测定
SDS-PAGE电泳检测纯化后的诱导产物,显示单一目标蛋白条带,说明 rLac15已纯化到SDS-PAGE电泳纯 (图未显示)。以丁香醛联氮为底物,rLac15比酶活为1.0 U/mg。
2.2 rLac15对染料的脱色性能比较
rLac15对不同结构的染料脱色效果有明显差异 (图1)。在无介体存在条件下,rLac15对部分偶氮类染料具有较好的脱色效果,M-2GE、KM-8B、KD-8B和K-7R脱色率在20%以上,其中M-2GE脱色率达到65%,对其他染料的脱色率均在4%以下。
小分子介体ABTS、HBT、丁香醛或丁香酸甲酯能够不同程度地影响 rLac15对染料的脱色效率。其中,丁香酸甲酯为最优催化介体。在丁香酸甲酯存在条件下,rLac15对M-2GE、AR-6B的脱色率分别达到92%和91%,对K-7R和KE-R的脱色率分别上升至73%和52%。
2.3 给酶量对染料脱色的影响
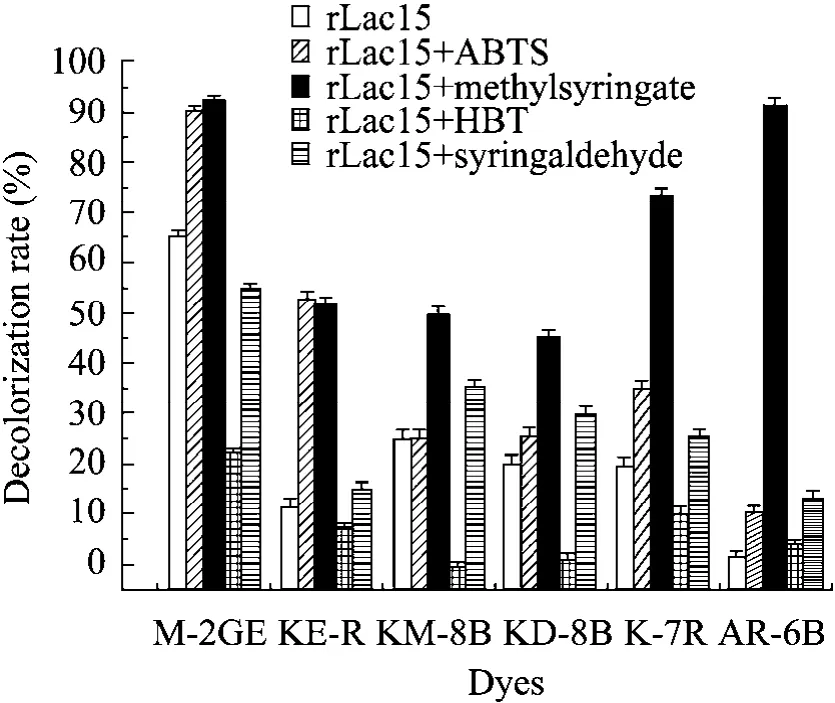
图1 重组细菌漆酶rLac15对不同染料的脱色效果Fig. 1 Decolorization of different dyes by rLac15. The assay was measured in Na2HPO4-KH2PO4 buffer (50 mmol/L, pH 7.5) at 45 °C for 1 h, in the presence of ABTS, HBT, methylsyringate, or syringaldehyde as mediators.
在给酶量为 10 U/L的条件下,rLac15对 M-2GE和AR-6B的脱色率分别达到90%和52%;20 U/L的脱色效果优于10 U/L,分别增至92%和 91%。继续增加给酶量,脱色率不再升高(图2)。
2.4 pH对染料脱色的影响
以4种脱色效率较好的偶氮类染料M-2GE、K-7R、KE-R或AR-6B为底物,考察pH对酶脱色效率的影响。pH 6.5~9.5范围内,rLac15能不同程度脱色100 μmol/L染料;其中,pH 8.5时脱色率最高,对于M-2GE和AR-6B的脱色率分别达到93%和95%;对K-7R和KE-R脱色率达到76%和61% (图3)。
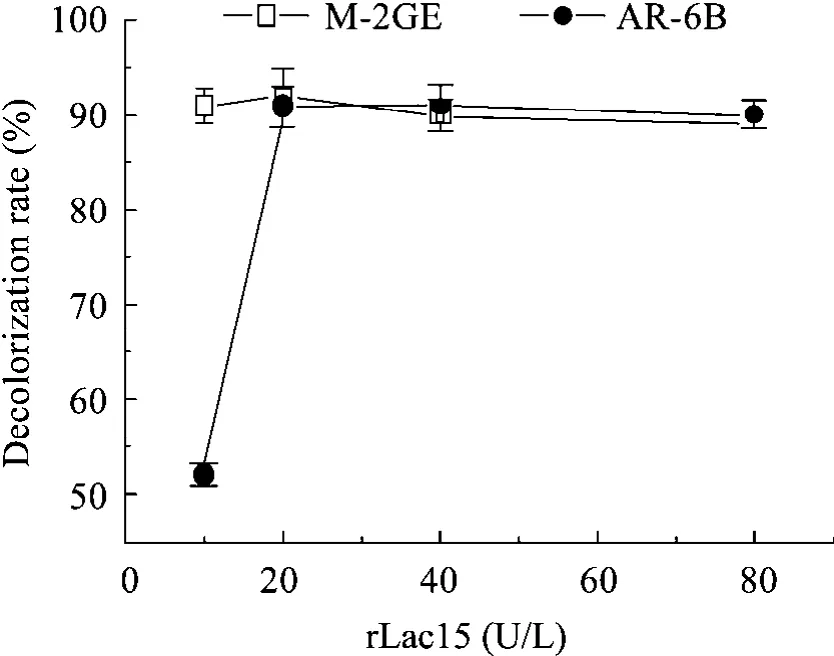
图2 给酶量对脱色率的影响Fig. 2 Effect of rLac15 activity on decolorization of dyes. The reaction system contained 50 μmol/L dyes, 100 μmol/L methylsyringate, Na2HPO4-KH2PO4 buffer (50 mmol/L, pH 7.5), and rLac15 from 10 U/L to 80 U/L.
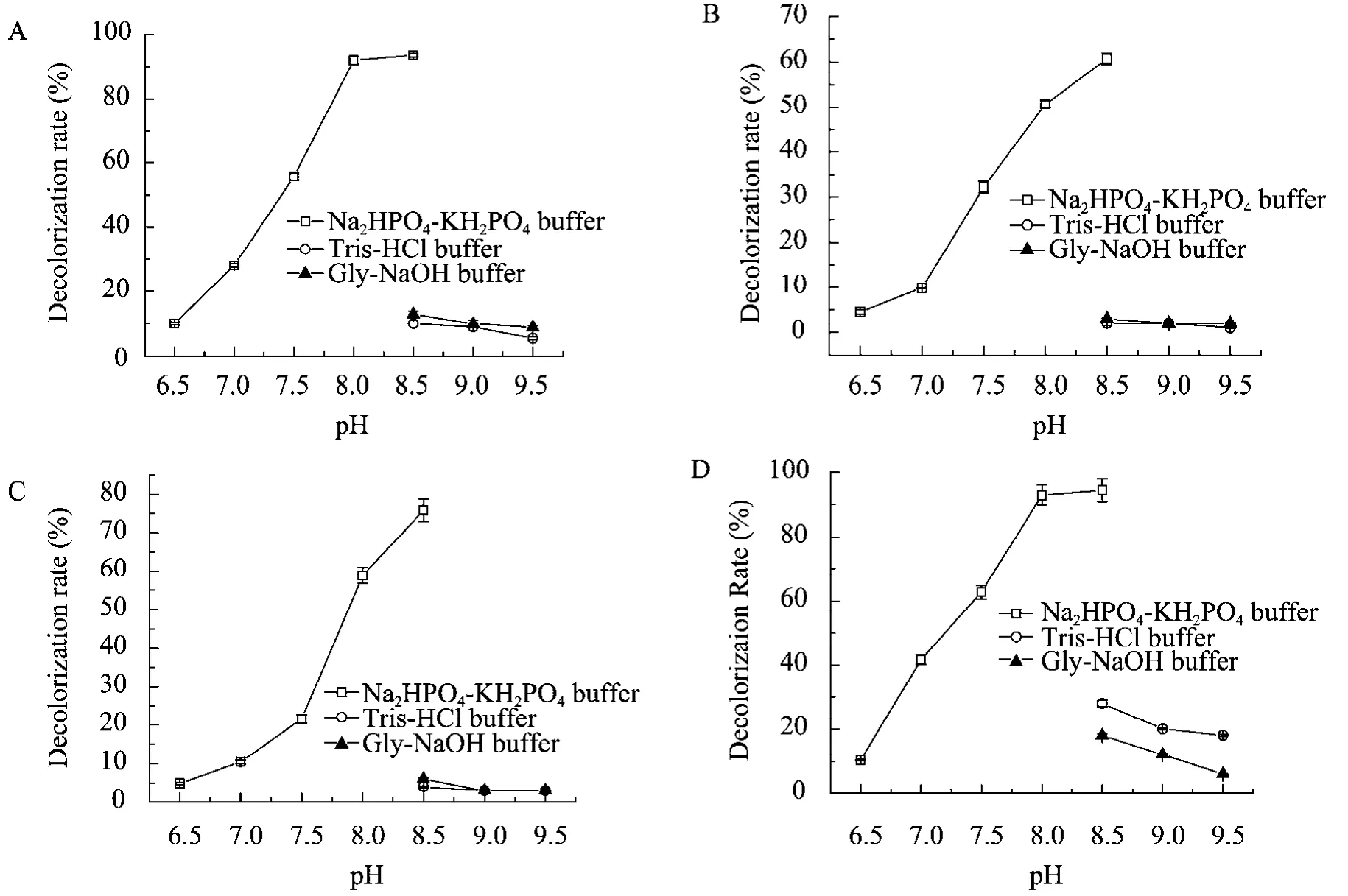
图3 pH对染料脱色的影响Fig. 3 Influence of pH on decolorization by rLac15. The assay was measured in 50 mmol/L Na2HPO4-KH2PO4, Tris-HCl or Gly-NaOH buffer under 45 ℃ for 1 h, with methylsyringate as mediator. (A) The assay was performed with M-2GE as substrate. (B) The assay was performed with KE-R as substrate. (C) The assay was performed with K-7R as substrate. (D) The assay was performed with AR-6B as substrate.
2.5 染料浓度对脱色效率的影响
在pH 8.5条件下,随着染料浓度的增加,脱色率呈现下降趋势 (图 4)。染料浓度低于100 μmol/L时,对M-2GE和AR-6B的脱色率均高于91%;浓度为200 μmol/L时,脱色率分别达到84%和82%;浓度达到400 μmol/L,仍可保持50%以上脱色率。K-7R和KE-R的浓度达到400 μmol/L时,脱色率为33%和1%。
2.6 温度对染料脱色的影响
在 25~45 ℃范围内反应 24 h,rLac15对200 μmol/L M-2GE和AR-6B的脱色率为80%以上。45 ℃反应30 min,两种染料的脱色率可以达到80%,并不随时间延长而提高;25 ℃反应24 h,脱色率可以分别达到86%和96%。在25 ℃条件下反应24 h,rLac15对K-7R和KE-R脱色率均达到66% (图5)。
3 讨论

图4 染料浓度对脱色的影响Fig. 4 Influence of concentrations of dyes on decolorization. The assay was performed with 200−400 μmol/L dyes as substrates under pH 8.5 and 45 ℃ for 1 h with methylsyringate as mediator.
真菌漆酶在中性偏酸的条件下,可以对人工合成染料进行有效的脱色[19-23]。来源于野生革耳Panus rudis的漆酶对于试验染料的脱色pH范围为3.5~4.5[19];在pH 5.0时,杂色云芝Trametes versicolor的漆酶对蒽醌类染料的脱色率达90%以上,而在pH 7.0时不足10%[20]。其他的一些研究也表明,真菌漆酶在中性偏碱的环境下难以有效发挥脱色作用。本研究中,rLac15在中性偏碱条件下,对4种偶氮染料有较好的脱色效果,在pH 8.5条件下,脱色效果最佳,显示出该细菌漆酶在中性偏碱环境下有优于真菌漆酶的脱色特性。
染料大分子的空间结构会阻碍其与酶分子活性中心的结合,随着染料浓度的增加,酶的脱色率会降低[24]。目前已报道细菌漆酶脱色研究所采用的底物浓度均低于 100 μmol/L[14-18],以Pseudomonas desmolyticum漆酶脱色的染料浓度最高,为 90 μmol/L[17]。本研究中,在高于100 μmol/L底物浓度条件下,rLac15对部分染料显示较高的脱色率;当染料浓度达到400 μmol/L,脱色率仍可维持在 50%以上,而达到以上脱色效果所需rLac15的酶量仅为20 U/L,性能优于番薯链霉菌Streptomyces ipomoea、枯草芽胞杆菌Bacillus subtilis以及 Pseudomonas desmolyticum等来源的细菌漆酶[15-17],因而rLac15具有使用较低酶量,脱色高浓度染料的特点。
低温脱色有利于降低工业应用能耗,已报道细菌漆酶脱色反应温度均在30 ℃~45 ℃[14-18]。rLac15在25 ℃条件下能对部分染料进行有效脱色,显示出其还具有低温脱色的优势,这可能与酶来源于海洋环境有关。以上表明,rLac15的染料脱色性能优良,且拥有卤族离子激活和耐受等特性,是具有潜在工业应用价值的新型细菌漆酶。
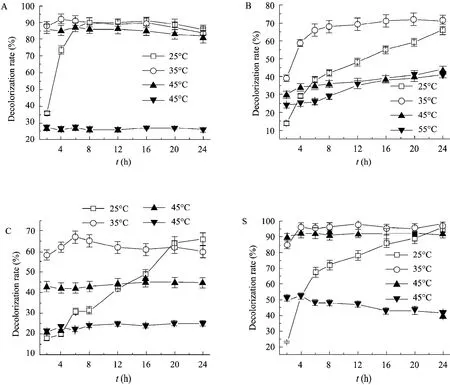
图5 温度对染料脱色的影响Fig. 5 Influence of temperature on decolorization of different dyes by rLac15. The assay was performed at 25 °C, 35 °C, 45 °C, or 55 °C for 24 h, with methylsyringate as mediator. (A) The assay was performed with M-2GE. (B) The assay was performed with KE-R. (C) The assay was performed with K-7R. (D) The assay was performed with AR-6B.
[1] Forgacs E, Cserháti T, Oros G. Removal of synthetic dyes from wastewaters: a review. Environ Int, 2004, 30(7): 953−971.
[2] Zhang FF, Yediler A, Liang XM, et al. Effects of dye additives on the ozonation process and oxidation by-products: a comparative study using hydrolyzed C.I. Reactive Red 120. Dyes Pigments, 2004, 60(1): 1−7.
[3] Rai HS, Bhattacharya MS, Singh J, et al. Removal of dyes from the effluent of textile and dyestuff manufacturing industry: a review of emerging techniques with reference to biological treatment. Crit Rev Environ Sci Technol, 2005, 35(3): 219−238.
[4] Verma P, Madamwar D. Decolourization of synthetic dyes by a newly isolated strain of Serratia marcescens. World J Microbiol Biotechnol, 2003, 19(6): 615−618.
[5] Saratale G, Kalme S, Bhosale S, et al. Biodegradation of kerosene by Aspergillus ochraceus NCIM-1146. J Basic Microbiol, 2007, 47(5): 400−405.
[6] Kaushik P, Malik A. Fungal dye decolourization: recent advances and future potential. Environ Int, 2009, 35(1):127−141.
[7] Robinson T, McMullan G, Marchant R, et al. Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative. Bioresour Technol, 2001, 77(3): 247−255.
[8] Rodríguez Couto S, Toca Herrera JL. Industrial and biotechnological applications of laccases: a review. Biotechnol Adv, 2006, 24(5), 500–513.
[9] Baldrian P. Fungal laccases-occurrence and properties. FEMS Microbiol Rev, 2006, 30(2), 215-242.
[10] Sharma P, Goel R, Capalash N. Bacterial laccases. World J Microbiol Biotechnol, 2007, 23(6): 823–832.
[11] Jimenez JN, Roman MR, Baeza A, et al. Alkali and halideresistant catalysis by the multipotent oxidase from Marinomonas mediterranea. J Biotechnol, 2005, 117(1): 73–82.
[12] Mao Y, Gang L, Wei QL, et al. Molecular cloning and characterization of a novel metagenomederived multicopper oxidase with alkaline laccase activity and highly soluble expression. Appl Microbiol Biotechnol, 2010, 87(3): 1023-1031.
[13] Fang ZM, Li TL, Wang Q, et al. A bacterial laccase from marine microbial metagenome exhibiting chloride tolerance and dye decolorization ability. Appl Microbiol Biotechnol, 2010, 89(4): 1103−1110.
[14] Lu L, Zhao M, Wang TN, et al. Characterization and dye decolorization ability of an alkaline resistant and organic solvents tolerant laccase from Bacillus licheniformis LS04. Bioresour Technol, 2012, 115: 35−40.
[15] Pereira, L, Coelho AV, Viegas CA, et al. Enzymatic biotransformation of the azo dye Sudan Orange G with bacterial CotA-laccase. J Biotechnol, 2009, 139(1): 68−77.
[16] Molina-Guijarro JM, Pérez J, Muñoz-Dorado J, et al. Detoxification of azo dyes by a novel pH-versatile, salt-resistant laccase from Streptomyces ipomoea. Int Microbial, 2009, 12(1): 13−21.
[17] Kalmea S, Jadhavb S, Jadhavb M, et al. Textile dye degrading laccase from Pseudomonas desmolyticum NCIM 2112. Enzyme Microb Technol, 2009, 44(2): 65−71.
[18] Liu YH, Ye M, Lu Y, et al. Improving the decolorization for textile dyes of a metagenomederived alkaline laccase by directed evolution. Appl Microbiol Biotechnol, 2011, 91(3): 667−675.
[19] Zhang M, Wu F, Wei ZY, et al. Characterization and decolorization ability of a laccase from Panus rudis. Enzyme Microb Tech, 2006, 39(1): 92−97. [20] Guo M, Lu FP, Liu MY, et al. Purification of recombinant laccase from Trametes versicolor in Pichia methanolica and its use for the decolorization of anthraquinone dye. Biotechnol Lett, 2008, 30(12): 2091−2096.
[21] Rodríguez Couto S, Sanromán M, Gübitz GM. Influence of redox mediators and metal ions on synthetic acid dye decolourization by crude laccase from Trametes hirsuta. Chemosphere, 2005, 58(4): 417–422.
[22] Nyanhongo GS, Gomes J, Gübitz GM, et al. Decolorization of textile dyes by laccases from a newly isolated strain of Trametes modesta. Water Res, 2002, 36(6): 1449−1456.
[23] Hong YZ, Zhou HM, Tu XM, et al. Cloning of a laccase gene from a novel Basidiomycete trametes sp. 420 and its heterologous expression in Pichia pastoris. Curr Microbiol, 2007, 54(4): 260−265.
[24] Saratale RG, Saratale GD, Chang JS, et al. Bacterial decolorization and degradation of azo dyes: a review. J Taiwan Inst Chem Eng, 2011, 42(1): 138−157.