基于AFLP标记的野生梅种质的鉴定
李庆卫,张启翔,陈俊愉
北京林业大学园林学院 国家花卉工程技术研究中心,北京 100083
梅 (Prunus mume Sieb. et Zucc.) 是我国原产的传统名花佳果[1]。野生梅是重要的种质资源,其分布广泛,生境多样,种群的分化变异情况、不同变种间的亲缘关系没有得到系统的研究。对其遗传多样性、亲缘关系和分类研究是梅育种和种质资源保护中的重要课题[2]。随着旅游业快速发展,野生梅种质资源的破坏日益严重,有效保护野生梅资源是迫不及待的问题。梅的传统分类主要是依据其形态特征进行分类,因易受环境影响,界定标准难以统一[3-4]。随着科学技术的发展,人们发现许多“种”只是“形态学种”,实际并不是全面的“生物学种”。划分物种的形态学依据是重要的,但不应该是唯一的[3]。对野梅的染色体也有人做过研究[5-7],植物染色体的研究与人类和哺乳动物染色体分带研究有较大差距。并且其技术本身仍缺乏相对的稳定性[8];张永春等[9]进行了部分野梅、果梅、花梅的同工酶分析,探讨了原始与进化品种在同工酶谱带上的差异。同工酶技术的多态性检出率较分子生物学手段低;在梅种质资源鉴别与分类方面应用分子标记技术,可以提供分子水平上的客观依据,并且比传统的方法更能反映其物种间的遗传多样性和亲缘关系。扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)分子标记技术兼有 RFLP (Restriction fragment length polymorphism) 标记技术的可靠性和PCR技术的高效性,还具有快速、灵敏、稳定、DNA用量少、多态性检出率高、重复性好的特点,所以AFLP可以用于遗传多样性研究、品种鉴定、基因定位及遗传图谱构建[10-18]。Vos等[15]认为Mse I可以高效酶切富含AT的真核生物重复序列区域,产生的片段大小适合于 PCR和变性胶的分离。而其他寡切点酶的酶切效果与 EcoRⅠ基本相差不大。MseⅠ-EcoRⅠ比PstⅠ-MseⅠ检测到的遗传多样性范围要宽一些。明军等[11]选用MseⅠ-EcoRⅠ内切酶,利用银染法AFLP技术建立了栽培梅花DNA指纹图谱,鉴定了167个梅花品种,探讨了梅与其部分近缘种间的亲缘关系[19-20]。
本实验采用荧光扩增片段长度多态性技术,建立了西藏 (30个)、云南 (15个)、四川 (14个)、贵州 (6个) 共计65个野梅AFLP-DNA指纹图谱,分析了其遗传多样性和亲缘关系,鉴别了野梅类型,进行了野梅分类,提出了有效进行野梅种质资源保护的建议。
1 材料与方法
1.1 材料
抽取西藏通麦、云南大理、四川、贵州等野梅半野梅群落为拟似群体,每个群体选取间隔不低于5倍株高的植株分别取样,样品包括西山野梅1 (原变种Prunus mume var. mume)、西山野梅2 (原种Prunus mume)、毛梅 (Prunus mume var. goethartiana Kochne)、厚叶梅 (Prunus mume var pallescens Franch.)、嵩明小梅 (Prunus mume var. microcarpa Makino T.)、曲梗常绿梅 (Prunus mume var. cenrnuus-sempervirens Chen et Li)、曲梗梅 (Prunus mume var. cernua Franch.)、蜡叶梅(Prunus mume var pallidus Bao et Chen)、南大坪桃梅等已记载的野梅类型,同时对采样点进行了GPS定位。实验材料为从云南洱源的南大坪、西山和宁蒗,四川冕宁、木里、盐源,西藏通麦,贵州荔波等地调查野梅时所采的野梅、半野生梅的叶片[21],新鲜样品采后迅速装入牛皮纸信封,室内阴干后放入−80 ℃冰箱,备用。65个野梅实验样品见表1。

表1 供试野梅样品Table1 The serial numbers of wild Mei

?
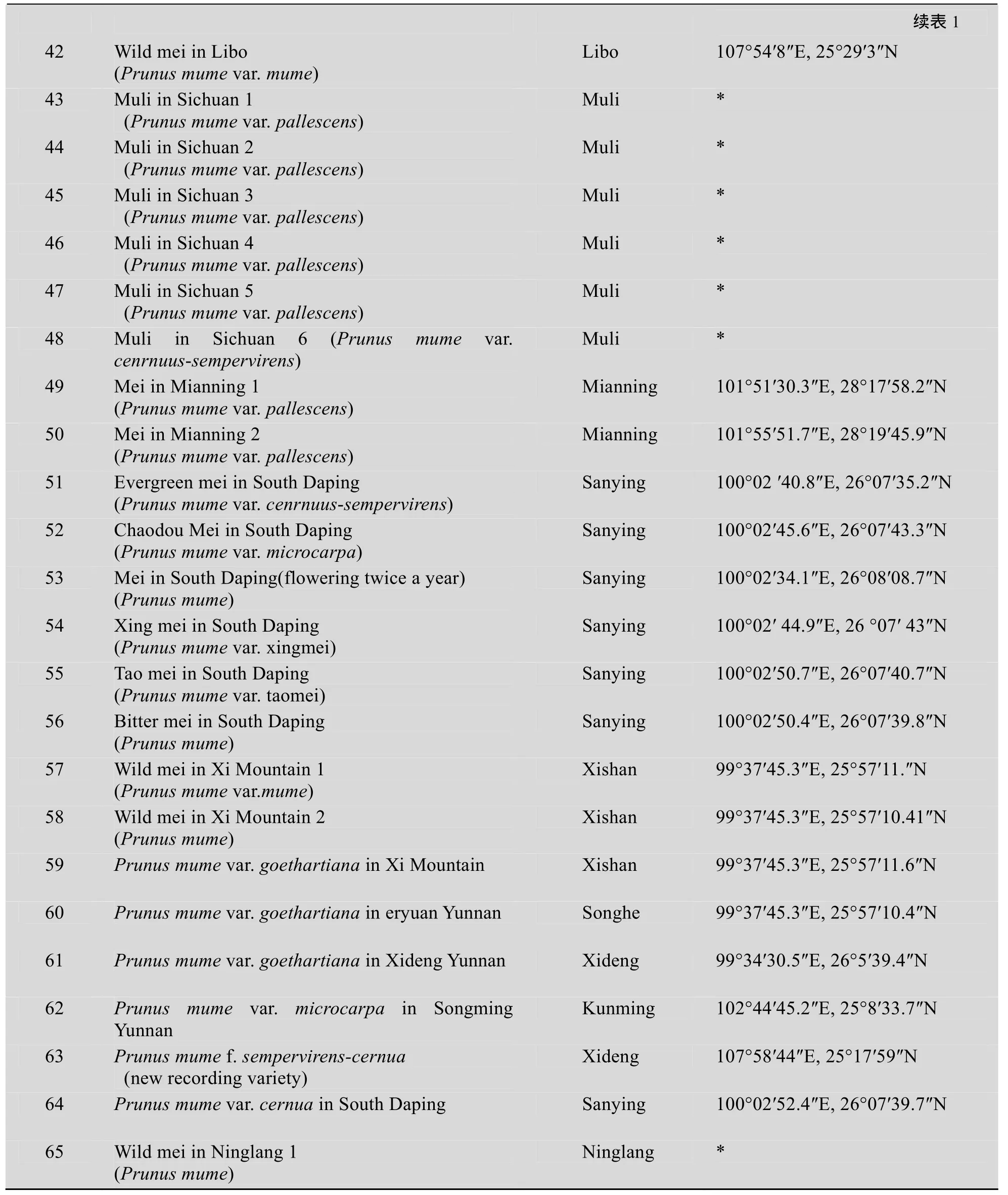
*: no GPS data.
1.2 实验主要仪器与试剂
台式离心机 DGL-16;DG-II暗箱式紫外透箱仪;DG-3D大型水平电泳槽;DG-III双稳数显电泳仪;Gene Amp PCR System 9600 (Perkin Elmer,USA);Sigma 3K18型低温冷冻离心机(Sigma,USA);测序仪ABI PRISM 377 sequence;AFLP试剂盒 (EcoRⅠ/MseⅠ型:北京鼎国生物技术公司生产并按说明书进行)。本实验所用的内切酶组合为:EcoRⅠ-MseⅠ,相应的接头、引物均采用Pieter Vos设计的相应的序列[15]。
1.3 基因组DNA提取、检测、限制性酶酶切及连接
采用CTAB法提取DNA[20],采用琼脂糖凝胶电泳检测DNA的质量。试验体系参照文献[15]和[19],建立荧光反应体系。本实验选用的内切酶组合为:EcoRⅠ-MseⅠ及其相关引物组合。限制性酶切及连接(20 μL反应体系):在0.5 mL离心管中加入表2中试剂,混匀,37 ℃保温5 h,8 ℃保温4 h,4 ℃过夜。
1.4 引物类型的选择
在AFLP标记引物中,3′端选择性核苷酸数目的多少决定了AFLP酶位点特异性顺序扩增产物的多少。EcoRⅠ引物和MseⅠ引物的组成见表3,选择性扩增用3+3引物组合 (表4)。
本实验采用 EcoRⅠ和 MseⅠ两种酶双酶切目的DNA,然后用T4 DNA连接酶,将EcoRⅠ和MseⅠ接头连接起来,构成预扩增模板DNA。
本实验引物筛选策略是:随机选取5个样品,共筛选引物组合64个,如表4所示,按照5个样品都扩增较好,且多态性条带在 10条以上的引物组合,进行扩大样品 (10个样品和30个样品) 扩增,再二次筛选。最后确定8个扩增较整齐、多态性高的引物组合,即表4中标记※的组合,作为指纹建立的引物组合。
1.5 预扩增反应与选择性扩增
在0.2 mL离心管中按表5建立预扩增反应体系:(共25 μL反应体系),混匀后离心5 s。预扩增反应条件:变性 94 ℃ 2 min ;94℃ 30 s,56℃30 s,72℃ 80 s,30个循环;72℃ 5 min。
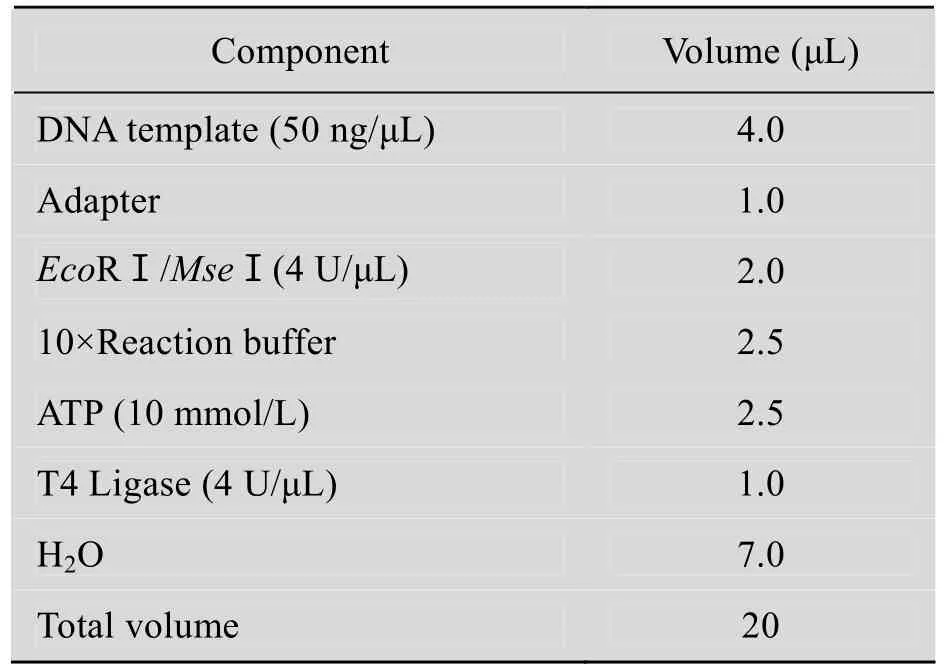
表2 AFLP限制性酶切及连接反应体系Table 2 AFLP restriction enzyme digestion and the linking reaction system
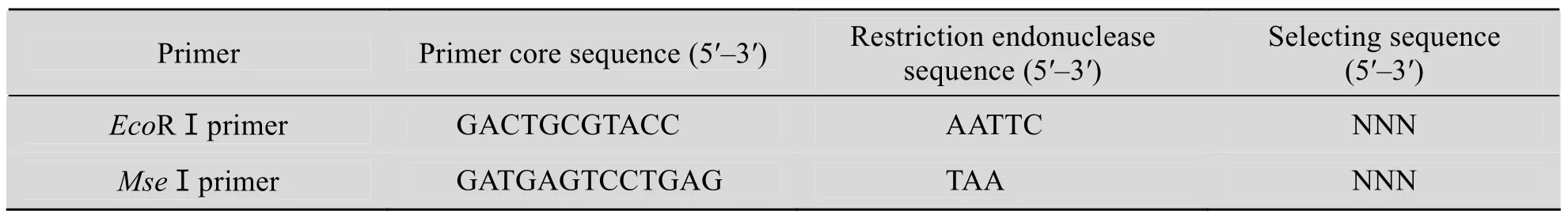
表3 EcoRⅠ引物和MseⅠ引物的组成Table 3 The component of primers EcoRⅠand MseⅠ

表4 EcoR I-Mse I及其相关引物组合Table 4 The primers combinations of EcoR I and Mse I
用TE缓冲液将预扩产物1∶20稀释,作为选扩模板。在0.2 mL离心管中,按表6建立选扩增反应体系,离心5 s,按下列参数进行PCR:94 ℃ 2 min ;第一个循环扩增参数:94℃ 30 s,65℃ 30 s,72℃ 80 s;以后每个循环退火温度递减0.7 ℃,扩增12个循环;接着按下列参数扩增23个循环:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s。
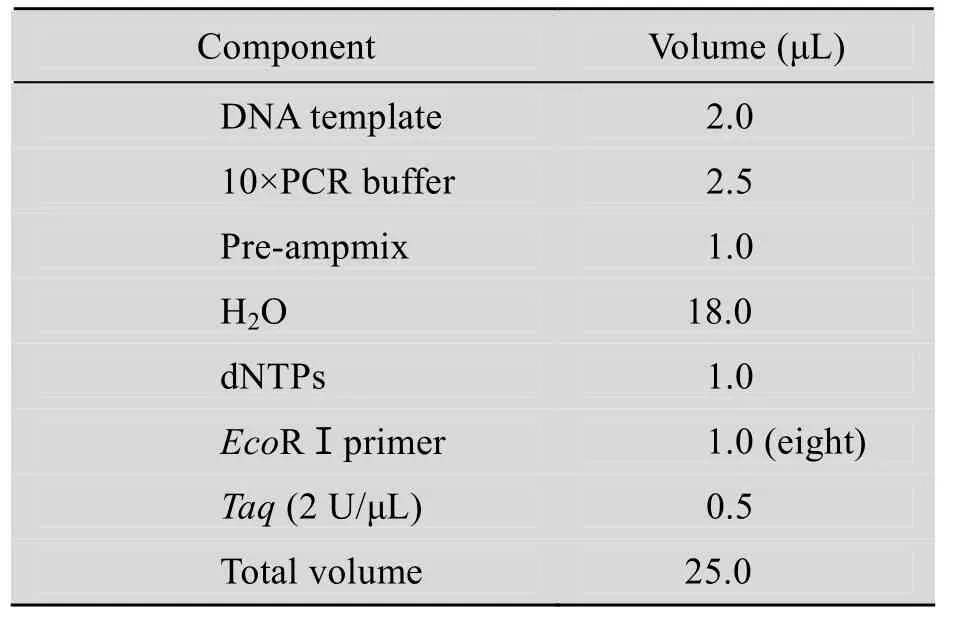
表5 AFLP预扩增PCR反应体系Table 5 PCR reaction system of AFLP pre-amplification
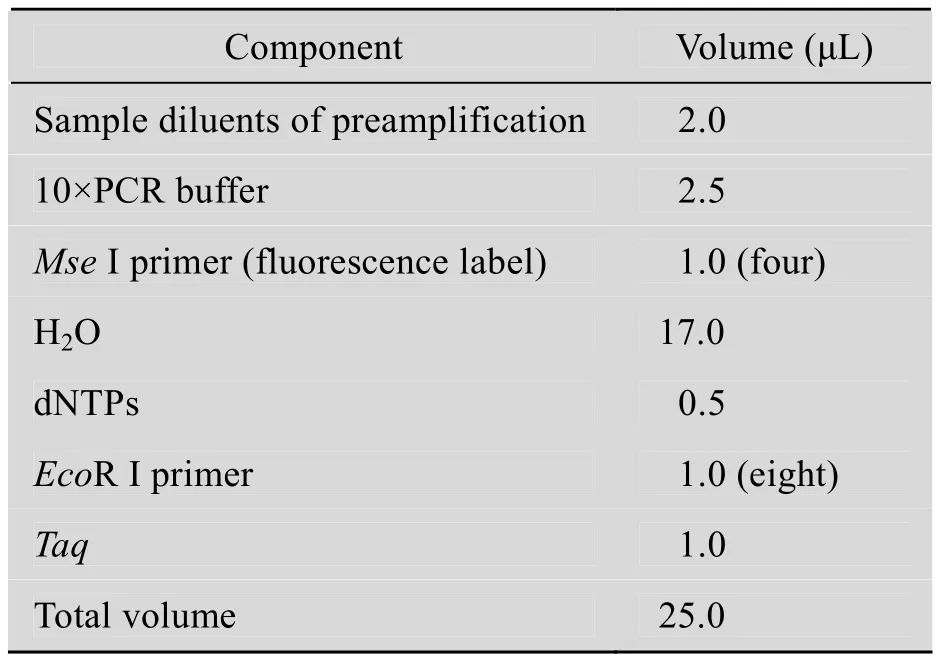
表6 AFLP选择性扩增PCR反应体系Table 6 PCR reaction system of AFLP selective amplification
1.6 电泳与数据处理
取1 μL PCR产物加入1 μL内标 (OX 500 Ladder (70~500 bp)),在荧光标记ABI 377测序仪上进行4%的变型聚丙烯酰胺凝胶电泳,利用GENESCAN3.1软件分析,通过Binthere软件提取样品的各片段大小的结果,用NTSYSpc-2.11F软件进行数据分析,计算 Nei’72距离系数,用SHAN程序中的 UPGMA方法进行聚类分析,并通过 Tree plot模块生成聚类图。
2 结果与分析
2.1 供试野梅AFLP条带多态性结果与分析
应用荧光AFLP分子标记技术,选用8对引物组合,建立了65个野梅样品的AFLP-DNA指纹图谱。以引物组合E-ACA+M-CAT为例,采用荧光AFLP技术,按照前述实验方法得到指纹图(图1)。8对引物组合共得到1 728条带,扩增出多态性条带 1 002条。平均多态性条带率为57.98%。从表7可以看出,应用AFLP技术标记野梅种质资源多态性是高效率的。
2.2 基于AFLP的野梅种质鉴别
引物组合E-ACA+M-CAT分析了65个野梅样品的DNA谱带,按照Nei’72距离系数聚类,结果见图2,西藏野梅30个样品,整体上聚类较好,其中 28个样品聚成一丛,它们的遗传距离在0.42以内,只有2个较分散,这个聚类结果反映了西藏野梅基本上是1个居群内发展的,亲缘关系最近,这个结论与西藏野梅生长在交通极不发达的环境中,和西藏种植业不发达,外来人为因素对梅种质的影响较小有关。四川、云南与贵州野梅的聚类结果不如西藏野梅集中,表明它们之间有种质的渗入,表明它们的亲缘关系较远。
图2中,四川省冕宁野梅1和冕宁野梅2是采自于冕宁县不同乡镇的厚叶梅,形态特征相同,亲缘关系较近,在0.24处聚在一起,是合理的。四川木里野梅共选6个样品,其中木里野梅1、木里野梅 3、木里野梅 4与四川冕宁野梅 1和冕宁野梅2属于厚叶梅的不同个体,亲缘关系近,主要形态特征是叶厚、枝刺多,它们在0.27以内聚在一起,这个聚类结果与形态学标记一致;木里野梅6 (叶常绿) 与云南常绿梅都具有叶常绿的特性,形态特征近似,二者在0.27处聚在一起,说明他们的亲缘关系较近;木里野梅5 (叶片小而厚、果实小) 在 0.25处与贵州野梅甲乙02 (原变种,叶小而枝短) 聚在一起,说明亲缘关系较近;木里野梅2树干匍匐状,与其他木里野梅的距离都较远,说明木里野梅遗传多样性突出。
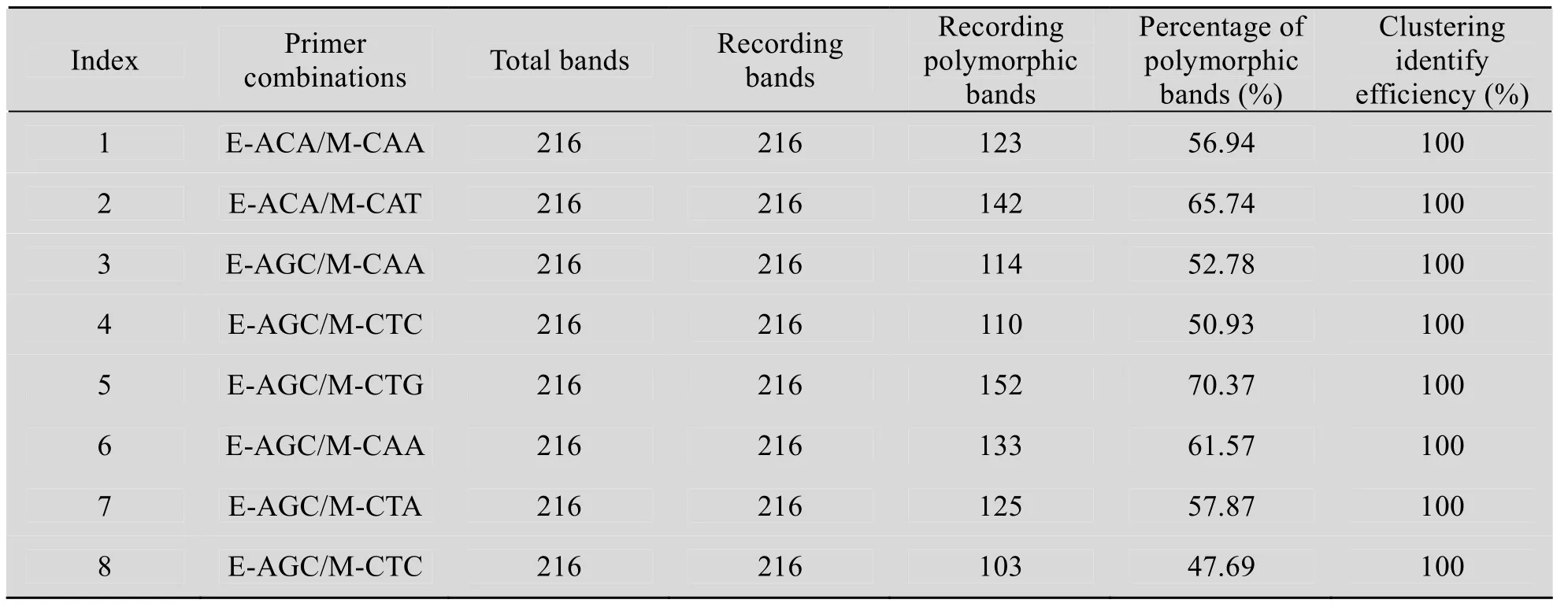
表7 不同引物组合在AFLP分析中的效果Table7 Effect of different primer combinations used in AFLP analysis

图1 引物组合E-ACA+M-CAT的AFLP指纹图式样Fig.1 AFLP fingerprint of primer combinations E-ACA/M-CAT. M: marker.
供试的贵州荔波野梅6个样品的形态特征差异较大,其中3个在0.31处聚在一起,具体是:贵州小苗样品系从贵州野生梅 (原种) 的实生苗取样的,亲缘关系较近,二者在0.24处聚在一起,然后与甲命05 (一年生枝细、叶倒卵形、花梗长) 在0.31处聚在一起;另外2个贵州野梅分别与木里野梅、泸沽湖野梅、南大坪野梅聚在一起,说明贵州荔波的遗传多样性突出,可能与其外来基因的渗入有关,调查发现贵州荔波确实有种梅的历史。
供试的云南洱源野梅样品主要采集了野梅的不同变种和变型,形态特征差异显著,其中嵩明小梅 (采自昆明,其枝条、叶、花、果均较小)与曲梗常绿梅 (为拟定新变种:花梗长、果实小、花复瓣、叶常绿)、南大坪长梗梅 (花梗长) 三种在0.39处聚在一起;洱源县西山毛梅 (叶片、果实多毛)、溪登毛梅 (叶片、果实多毛) 在0.3处聚在一起,然后与洱源县南大坪炒豆梅 (果实小)、二度梅 (叶片、果实多毛)、苦梅 (一年一次花,果实大) 在0.3处聚在一起,亲缘关系较近;南大坪杏梅与泸沽湖野梅5和泸沽湖野梅6在0.25处聚在一起,它们与宁蒗野梅在0.31处聚在一起,与南大坪的桃梅在0.39处聚在一起,聚类结果说明云南洱源野梅的多样性突出。这可能与云南洱源既是野梅分布中心,也是梅花和果梅的栽培中心有关,这里的交通相对于西藏和四川要便利很多,因此人们有意的引种和无意识的携带果品 (果核被投入野外而萌发成树) 都可能导致外来基因的渗入,使本地基因类型更丰富。它们之间的亲缘关系就可能较远。
2.3 主要野梅分类
为了使聚类结果更直观,将65个野梅样品中的冕宁厚叶梅1、冕宁厚叶梅2、西藏蜡叶梅、洱源南大坪常绿梅、洱源杏梅、洱源桃梅、西山毛梅、西山野梅、西山野梅原变种、嵩明小梅、曲梗常绿梅 (拟定的新变种)、西藏匍匐梅、木里2 (匍匐梅) 的AFLP 分子标记数据,按照Nei’72距离系数进行专门聚类,聚类结果如图3所示。
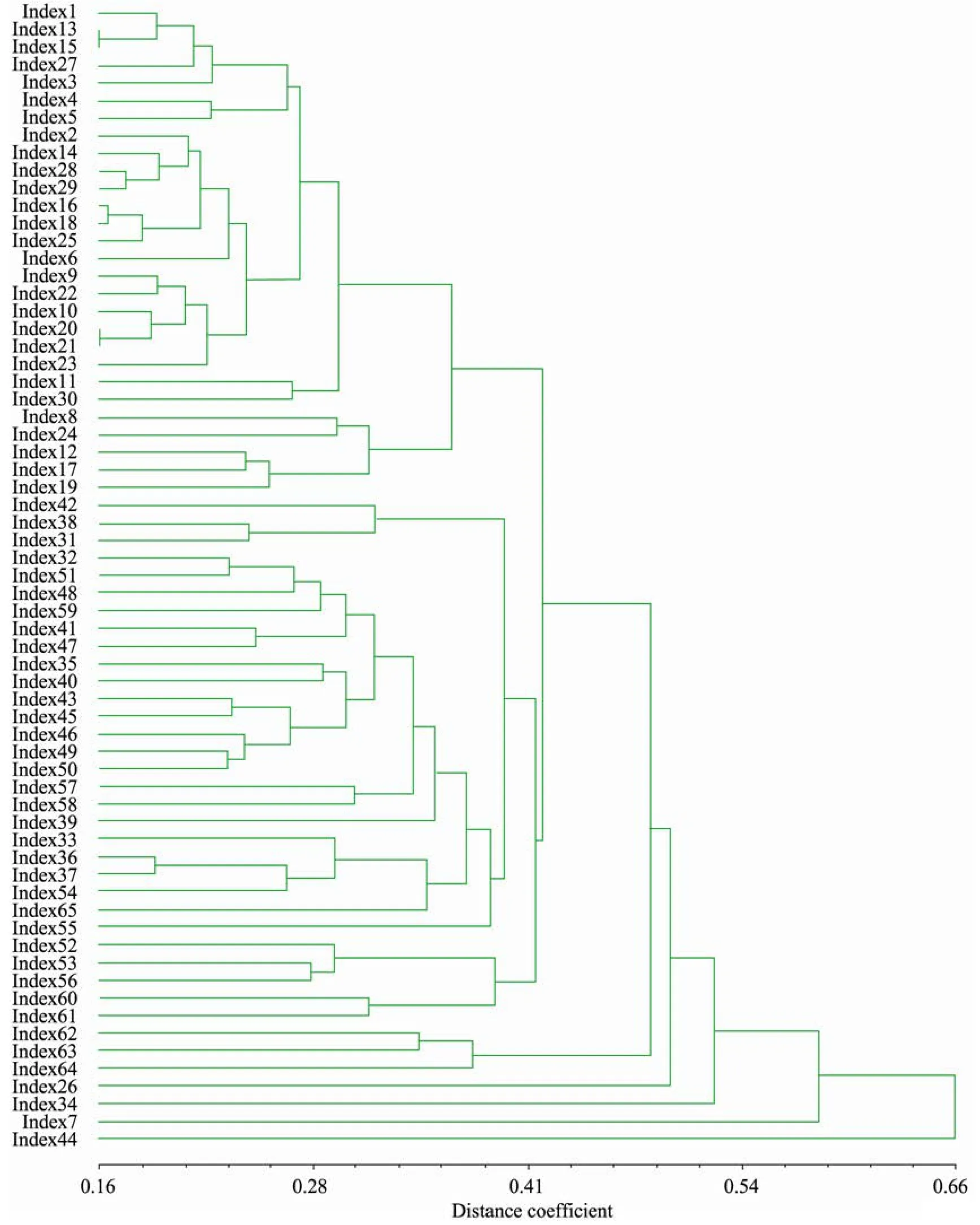
图2 Nei’72遗传距离系数对野梅种质资源多样性聚类图Fig.2 The dendrogram of wild mei of Nei’72 distance coefficient.
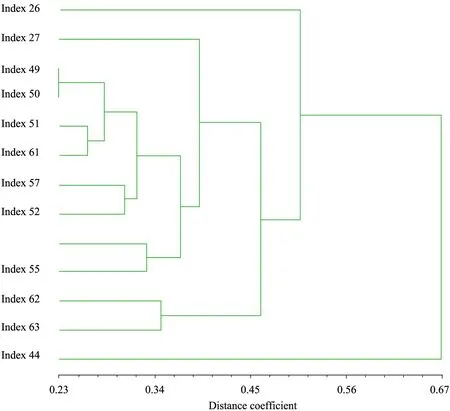
图3 主要野梅Nei’72距离系数聚类树Fig.3 Dendrogram of major wild mei based on methods of Nei’72 distance coefficient.
从图3可以看出,冕宁野梅1和冕宁野梅2两个样品为采于冕宁县两个不同村庄的厚叶梅个体,二者距离相差0.05,在0.23处聚在一起;常绿梅和西山毛梅是梅的不同变种,两者在0.27处聚在一起,因此,可以0.26作为一个阈值,距离大于0.26的定为变种或变型。新发现的拟定新变种——云南曲梗常绿梅与嵩明小梅 (已定变种) 二者在0.3476处聚在一起,大于0.26,结合形态特征看,该拟定新变种的主要形态特征是花梗长,花瓣8~14瓣,花开时叶片宿存,果实较小,与其他野梅变种差异显著,因此可以将曲梗常绿梅定为一个新变种。
西藏蜡叶梅的叶片两面均被白粉而呈现蜡白色,其距离系数为0.37,也大于0.26,可以定为一个变种,西藏匍匐梅之树干匍匐状,虽与西藏蜡叶梅两个样品的空间距离很近,但是遗传距离差异0.18,这种差异可能是由控制蜡叶性状的基因差异形成的。木里野梅2位于四川木里,其树干具有匍匐性,与西藏匍匐梅的空间距离很远,但是二者差异为0.16,可以认为是不同起源的匍匐梅,从AFLP标记的结果看,可以将匍匐梅作为一个变种。在Nei’72=0.26处,西山野梅原变种、西山野梅原种、西山毛梅、厚叶梅、南大坪桃梅、嵩明小梅、曲梗常绿梅、蜡叶梅、匍匐梅可区分出梅的变种或变型,并与形态分类一致。
3 讨论
AFLP标记方法已被证实是种质资源遗传多样性分析和鉴定的有效工具[11-20]。本研究用荧光AFLP技术建立了65个野梅样品的DNA指纹图谱,按照 Nei’72距离系数的聚类,结果表明,AFLP-DNA指纹图谱可以高效区分野梅种质,验证支持了形态学的鉴别结论。宋婉[23]用荧光法AFLP研究了 68个枣品种,田清震等[24]对大豆90个品种,明军[11]对 187个梅花样品进行的AFLP-DNA指纹分析,均全部鉴别了供试样品,但也都出现了样品间差异与形态特征分类不同的情况。所以要完全依据指纹鉴别野梅种质类型,就必须采用标准的野梅样品,并区分来源,分别采集样品,建立指纹图谱库,以进行比对鉴定。而确定野梅的标准模式类型必须依靠形态学方法鉴别。
本研究显示:西藏通麦野梅主要类型有西藏野梅 (原种)、原变种、匍匐梅和蜡叶梅4个类型,但它们的亲缘关系较近,为居群内变异;云南洱源、四川泸沽湖、以及贵州荔波等地既是野梅分布中心又是果梅的栽培中心,由于人工选择和外来基因渗入的影响导致聚类较分散,这就更说明了加强野梅种质资源保护的必要性和紧迫性。
虽然从AFLP分子标记结果看,可以将匍匐梅作为一个变种。但是由于干形、株型受多因素影响,而且其遗传性如何尚有待进一步研究,因此建议进一步进行繁殖栽培对比研究,暂不作新变种处理。
在Nei’72=0.26处,西山野梅1 (原变种)、西山野梅2 (原种)、毛梅、厚叶梅、嵩明小梅、曲梗常绿梅、曲梗梅、蜡叶梅、南大坪桃梅9个梅的变种或变型可区分出来,证明了AFLP可以用于野梅种质的鉴别。
变异类型主要在变种变型方面,群体内较小,所选择育种亲本和保护资源区分层次。因此,在保护、利用梅花资源时,需要优先筛选和保护变种、变型的遗传变异类型,其次,为其群体。建议对主要野梅变种采取就地和异地建立野梅基因库的方式加以保护。同时将西藏通麦野梅分布集区化为野生梅自然保护区,将荔波国家级自然保护区中自荔波县洞塘乡甲命村 (107°58′37″E, 25°17′59″N) 到甲乙村 (107°55′50″E, 25°48′3″N)所在区域划分为野梅保护核心区加以保护,由于洱源野梅已经处于半野生状态,受果梅栽培和人为活动影响很大,应对主要变种、变型采取单株重点保护。
[1] Chen JY. Pictorial Record of Chinese Mei Flower (Prunus mume) Cultivars. Beijing: China Forestry Press, 2010: 1−34.陈俊愉. 中国梅花品种图志. 北京: 中国林业出版社, 2010: 1−34.
[2] Bao MZ, Chen JY. Studies on the variation and distribution of Prunus mume Sieb. et Zucc. Acta Hortic Sin, 1994, 21(1): 81−86.包满珠, 陈俊愉. 中国梅的变异与分布研究. 园艺学报, 1994, 21(1): 81−86.
[3] Ma WL. Higher Plants and Diversity. Beijing: Higher Education Press, 1998: 4−6.马炜梁. 高等植物及其多样性. 北京: 高等教育出版社, 1998: 4−6.
[4] Lei XT, Wang JB, Xu XR, et al. Studies on genetic polymorphism of main mango cultivars via AFLP markers. Acta Hortic Sin, 2006, 33(4): 725–730.雷鑫涛, 王家保, 徐雪荣, 等. 杧果主要品种遗传多态性的 AFLP标记研究. 园艺学报, 2006, 33(4): 725−730.
[5] Bao MZ. Sysmetic study on wild mei germplasm resources in Sichuan, Yunnan and Tibet[D]. Beijing: Beijing Forestry University, 1991.包满珠. 我国川、滇、藏部分地区野梅种质资源及梅的系统学研究[D]. 北京: 北京林业大学, 1991.
[6] Huang YW, Bao MZ, Shen QY, et al. Studies on the number and morphology of chromosomes of wild mei and cultivated mei. J Beijing Forest Univ, 1995, 17(S1): 37−41.黄燕文, 包满珠, 沈清宇, 等. 野梅和栽培梅染色体数目及形态的研究. 北京林业大学学报, 1995, 17(S1): 37−41.
[7] Lin SH, Chu MY. Studies on chromosome of Prunus mume. J Beijing Forest Univ, 1999, 21(2): 91−93.林盛华, 褚孟嫄. 梅染色体研究. 北京林业大学学报, 1999, 21(2): 91−93.
[8] Li MX, Zhang XF. The Technology of Plant Chromosome Research. Harbin: Northeast Forestry University Press, 1991: 75−76.李懋学, 张敩方. 植物染色体研究技术. 哈尔滨:东北林业大学出版社, 1991: 75−76.
[9] Zhang YC, Bao MZ, Chen LQ, et al. Analysis of isozyme diversities in the cultivar resources of mei flower (Prunus mume). J Beijing Forest Univ, 1999, 21(2): 94−99.张永春, 包满珠, 陈龙清, 等. 梅花品种资源同工酶多态性分析. 北京林业大学学报, 1999, 21(2): 94−99.
[10] Zhao HB, Miao HB, Wu GS, et al. Intergeneric phylogenetic relationship of Dendranthema (DC.) Des Moul., ajania Poljakov and their allies based on amplified fragment length polymorphism. Sci Agric Sin, 2010, 43(6): 1302−1313.赵宏波, 缪恒彬, 吴国盛, 等. 基于 AFLP的菊属、亚菊属及其近缘属的属间关系. 中国农业科学, 2010, 43(6): 1302−1313.
[11] Ming J, Zhang QX, Yan XL, et al. AFLP-DNA fingerprint markers for cultivar identification of Prunus mume. J Beijing Forest Univ, 2003, 25(S2): 17−22.明军, 张启翔, 晏晓兰, 等. 应用 AFLP-DNA指纹技术鉴定梅花品种的研究. 北京林业大学学报, 2003, 25(S2): 17−22.
[12] Li T. The advancement of AFLP Technology. Chin J Biotech, 2006, 22(5): 861−865.李韬. AFLP标记技术的发展和完善. 生物工程学报, 2006, 22(5): 861−865.
[13] Yi GJ, Tan WP, Huo HQ, et al. Studies on the genetic diversity and relationship of longan cultivars by AFLP analysis. Acta Hortic Sin, 2003, 30(3): 272−276.易干军, 谭卫萍, 霍合强, 等. 龙眼品种(系)遗传多样性及亲缘关系的 AFLP分析. 园艺学报, 2003, 30(3): 272−276.
[14] Yang CD, Wang J, Zhang JW, et al. A preliminary analysis of genetic relationships for Prunus mume Sieb. et Zucc. by AFLP. Sci Agric Sin, 2005, 38(10): 2048−2089.杨朝东, 王健, 张俊卫, 等. 梅花不同样本间亲缘关系的AFLP初步分析. 中国农业科学, 2005, 38(10): 2048−2089.
[15] Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting. Nucl Acids Res, 1995, 23(21): 4407−4414.
[16] Chen QL, Li QG, Tian R, et al. AFLP technique and its application in the studies of horticultural plants’ genetics and breeding. J Jianghan Pet Inst: Soc Sci Ed, 2005, 2(2): 12−25.陈启亮, 李清国, 田瑞, 等. AFLP标记及其在园艺植物遗传育种中的应用. 长江大学学报: 自然科学版, 2005, 2(2): 12−25.
[17] Zhu S, Qu SP, Cui CS. Application of AFLP to the genetics and breeding of Chinese cabbage. China Cucurb Veget, 2007, (3): 24−26.朱珊, 屈淑萍, 崔崇士. AFLP标记在大白菜遗传育种中的应用. 中国瓜菜, 2007, (3): 24−26.
[18] Zhang YL. Classification and identification of new floweringquince germplasm using Morphological characters and AFLP markers. Jiangsu Agric Sci, 2010(4): 145−147.张亚利. 形态学性状及AFLP标记在木瓜海棠新种质鉴别和分类中的应用. 江苏农业科学, 2010(4): 145−147.
[19] Ming J, Zhang QX, Yan XL, et al. DNA template preparation and technology system building for AFLP analysis of Prunus mume. J Beijing Forest Univ, 2003, 25(3): 17−21.明军, 张启翔, 晏小兰, 等. 梅花基因组AFLP银染反应体系的建立和优化. 北京林业大学学报, 2003, 25(3): 17−21.
[20] Ming J, Zhang QX. Genetic relationships between Prunus mume Sieb. et Zucc. and related species using AFLP markers. J Beijing Forest Univ, 2012, 34(S1): 88−91.明军, 张启翔. 梅与其近缘种亲缘关系的 AFLP分析. 北京林业大学学报, 2012, 34(S1): 88−91.
[21] Li QW. Studies on investigation of wild Mei germplasm resources of Sichuan, Yunnan, Tibet and Guizhou province as well as regional tests of hardy Mei cultivars in North China[D]. Beijing: Beijing Forestry University, 2010.李庆卫. 川、滇、藏、黔野梅种质资源调查和梅花抗寒品种区域试验的研究[D]. 北京: 北京林业大学, 2010.
[22] Zhou YQ. DNA Molecular Markers Technology in Plants Research. Beijing: Chemical Industry Press, 2005.周延清. DNA分子标记技术在植物研究中的应用. 北京: 化工出版社, 2005.
[23] Song W. study on DNA fingerprint of improved cultivars of Zizyphus jujube [D]. Beijing: Beijing Forestry University, 1999.宋婉. 中国枣优良品种DNA指纹图谱的研究[D].北京: 北京林业大学, 1999.
[24] Tian QZ, Gai JY. Yu DY, et al. A study on amplified fragment length polymorphism (AFLP) in soybean. Soybean Sci, 2000, 19(3): 210−217.田清震, 盖钧镒, 喻德跃, 等. 大豆DNA扩增片段长度多态性(AFLP)研究. 大豆科学, 2000, 19(3): 210−217.