内切中性纤维素酶EGⅡ的发酵条件优化
郑海英,蔡少丽,黄平,杨威,黄杨,杨鹤,张爱平,刘小琳,黄建忠
(福建师范大学工业微生物教育部工程研究中心生命科学学院福建省现代发酵技术工程研究中心,福建福州350108)
纤维素酶是指能水解纤维素β-1,4葡萄糖苷键,使纤维素变成纤维二糖和葡萄糖的一组酶的总称,由内切β-葡聚糖苷酶、纤维二糖水解酶、β-葡萄糖苷酶3个主要成分组成的诱导型复合酶系[1-2]。按最适作用pH不同,可分为酸性纤维素酶(最适pH为4.8左右,由绿色木霉、里氏木霉、康氏木霉、黑曲霉、青霉等产生)、中性纤维素酶(最适pH为6~8,由长梗木霉、腐质霉、芽胞杆菌等产生)和碱性纤维素酶(最适pH为8~11,由嗜碱芽胞杆菌、腐质霉等产生)。中性纤维素酶在纺织、造纸、饲料、食品和制药等行业均具有广泛的应用前景[3],尤其是在牛仔布“洗旧”整理加工方面具有显著优势[4]。但中性纤维素酶用量大且生产成本高,在一定程度上限制了该酶的开发与应用。因此可以利用分子技术构建高产菌株,优化发酵工艺以提高中性纤维素酶的产量,从而降低成本。目前已有研究报道通过克隆其基因并试图构建重组高产菌株,但仍存在表达量不高等问题[5-6]。本研究拟通过对本课题组已构建好的产中性内切葡聚糖酶的毕赤酵母基因工程菌EIM-50-eg2的发酵条件进行优化,为该酶的生产应用提供基础参数。
1 材料与方法
1.1 材料
1.1.1 菌株毕赤酵母基因工程菌EIM-50-eg2,工业微生物教育部工程研究中心克隆表达内切中性纤维素酶的高产菌株。
1.1.2 主要试剂和溶液底物溶液、DNS溶液、醋酸-醋酸钠缓冲液、葡萄糖标准溶液。
1.1.3 培养基的制备和菌株培养方法①YPD液体培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,葡萄糖20 g/L,pH自然,115℃下高压灭菌20 min;②MGY液体培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,甘油10 mL/L,pH 6.0,121℃下高压灭菌20 min;③MMY液体培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,pH 7.0,121℃下高压灭菌20 min;④基础培养基:硫酸镁15 g/L,磷酸氢二铵20 g/L,磷酸氢二钾5 g/L,用氢氧化钾调pH至7.0,121℃下高压灭菌20 min;⑤微量元素PTM1配方:见Invitrogen公司提供的毕赤酵母操作手册。
1.2 方法
1.2.1 酶活测定方法内切中性纤维素酶EGⅡ的活力测定采用DNS法。在15 mL刻度试管中,加入1.8 mL 1.5%羧甲基纤维素钠溶液。将试管放入恒温水浴锅中在50℃水浴预热3 min。之后立即加入0.2 mL适当稀释的酶液,酶解30 min。然后加入3 mL的DNS试剂在沸水中显色反应10 min,迅速冷却至室温后加蒸馏水定容至15 mL,充分摇匀后于540 nm波长下测定其吸光值,根据葡萄糖标准曲线(葡萄糖的绝对量对吸光度数值作图),以每分钟水解羧甲基纤维素钠产生1 μg还原糖(以葡萄糖计)所需酶量定义为1个酶活力单位(U)。
1.2.2 产酶条件的研究将工程菌EIM-50-eg2接种于3 mL YPD培养基中,过夜培养。以1%接种于含30 mL MGY的250 mL三角瓶中,28℃培养至OD600=2~6。弃上清并将菌体细胞沉淀适量悬浮到MMY培养基中,控制其初始OD600=1。在此过程利用单因素试验方法优化发酵条件,如诱导时间、氮源、初始pH、发酵温度和甲醇诱导浓度等。接着采用L18(3)7正交表进一步优化培养基及培养条件,具体因素和水平安排见表1。分18个实验条件,每一个实验条件设置3个平行样,重复3次,共162组实验,酶活力取9组实验平均值。以酶活力高低为优化标准,得出1组最适的发酵条件。

表1 L18(3)7正交试验因素和水平取值表Table 1 Factors and levels of orthogonal experiment of enzyme production optimization
2 结果与分析
2.1 发酵时间对工程菌EIM-50-eg2产酶的影响
将工程菌EIM-50-eg2接种于发酵培养基中,3个平行,28℃,230 r/min振荡培养,每隔24 h取样测定酶活力,结果见图1。由图1可知,随着发酵时间的延长,第2天到第5天呈快速增长趋势,第5到第7天酶活力小幅度上升,第7天达到最高,以后逐渐下降。

图1 发酵时间对工程菌EIM-50-eg2产酶的影响Fig.1 Effect of culture time on yield of enzyme
2.2 氮源对工程菌EIM-50-eg2产酶的影响
改变基础培养基中氮源的种类,培养后测定酶活力,结果见图2。由图2可知,酵母粉和蛋白胨的混合物、磷酸氢二铵作为氮源的酶活明显高于其他原料发酵所产生的酶活。综合考虑成本和酶活因素,最后选用磷酸氢二铵作为工程菌的氮源。
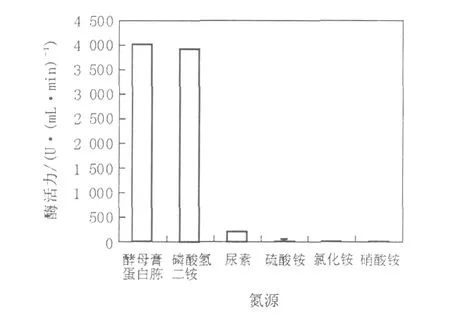
图2 不同氮源对工程菌EIM-50-eg2产酶的影响Fig.2 Effect of nitrogen source on yield of enzyme
2.3 磷酸氢二铵浓度对工程菌EIM-50-eg2产酶的影响
氮源浓度决定培养基的碳氮比,直接影响到工程菌EIM-50-eg2菌体的生长和产酶。氮源浓度对工程菌EIM-50-eg2产酶的影响结果见图3。由图3可知,在较低浓度的氮源里,酶活力随着氮源浓度的升高而增加,氮源浓度为4%时,酶活力达到最高,之后随浓度增加中性内切纤维素酶酶活迅速降低。

图3 不同磷酸氢二铵浓度对工程菌EIM-50-eg2产酶的影响Fig.3 Effect of(NH4)2HPO4concentration on yield of enzyme
2.4 培养基初始pH对工程菌EIM-50-eg2产酶的影响
实验分别考察了培养基初始pH 5.5、6.0、6.5、7.0、7.5、8.0对产酶的影响,结果见图4。由图4可知,初始pH为6.0时内切中性纤维素酶EGⅡ的活力最高。初始pH过低或过高,酶的活性均降低。这可能是因为过低的初始pH会影响细胞膜的通透性,影响细胞对营养物质的吸收和外源蛋白的分泌,并最终严重影响工程菌的表达[7]。过高的初始pH值则会影响发酵液中蛋白酶的活性而不利于某些蛋白的分泌[8-10]。

图4 初始pH值对工程菌EIM-50-eg2产酶的影响Fig.4 Effect of initial pH on yield of enzyme
2.5 诱导温度对工程菌EIM-50-eg2产酶的影响
选择酵母菌适宜生长的温度范围(24~30℃)对工程菌的产酶进行探讨。由图5可知最适的发酵温度为28℃。发酵温度对工程菌的生长和合成内切中性纤维素酶EGⅡ有至关重要的影响。温度过高会造成细胞内的活性物质发生变性,严重抑制微生物的代谢循环,温度过低则不利于菌体生长[11-12]。

图5 温度对工程菌EIM-50-eg2产酶的影响Fig.5 Effect of temperature on yield of enzyme
2.6 甲醇诱导浓度对工程菌EIM-50-eg2产酶的影响
不同浓度的甲醇诱导对工程菌产酶量的影响,结果见图6。甲醇诱导浓度为1.5%时,产酶量达到最高,接着逐渐下降。这可能是因为甲醇浓度太低导致碳源不足,所以产酶量低;过高的甲醇对细胞产生了毒害,抑制酶的产生[13]。

图6 不同浓度甲醇对工程菌EIM-50-eg2产酶的影响Fig.6 Effect of methanol concentration on yield of enzyme
2.7 PTM1对工程菌EIM-50-eg2产酶的影响
如图7所示,比较加PTM1与不加PTM1发酵液的酶活力,前者明显高于后者,这说明一定浓度的PTM1能够明显提高内切中性纤维素酶的表达量。由图7可知,0.02%的浓度最适于菌体产酶。可能是微量元素中含有Ca2+、Fe3+、Zn2+、Mg2+等金属离子,有助于提高细胞浓度、产率等。随着PTM1浓度增加,酶活力反而下降。可能是由于微量元素溶液中的金属离子如Ca2+、Fe3+等易与磷酸缓冲液中的作用产生沉淀,导致磷酸缓冲液中的和向电离产生和H+的方向进行,使得溶液中的H+浓度增加,导致pH值下降,最终抑制菌株生长和产酶。

图7 不同PTM1浓度对工程菌EIM-50-eg2产酶的影响Fig.7 Effect of PTM1concentration on yield of enzyme
2.8 正交试验结果及方差分析结果
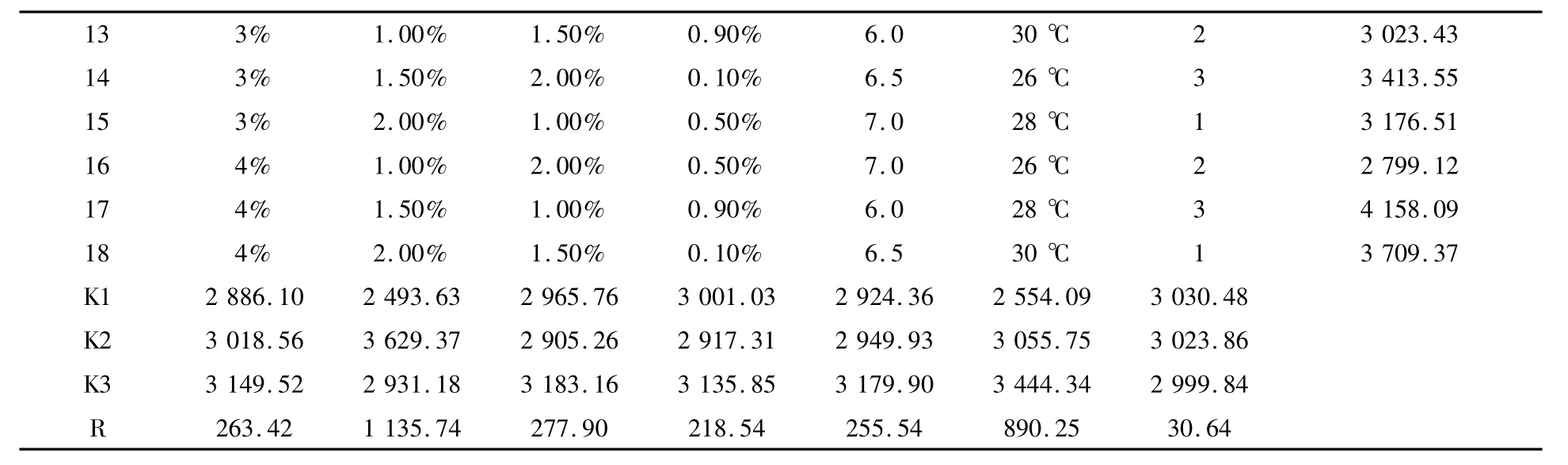
由表2可知,甲醇和温度的极差分居第1位和第2位,是影响酶活的关键性因子,磷酸氢二铵、硫酸镁、磷酸二氢钾、pH的极差都较小。比较正交表排列的18种培养基产酶活力大小,以17号培养基产酶活力最高,即该菌的产酶培养基的较优组合为磷酸氢二铵4%,甲醇1.5%,硫酸镁1%,磷酸二氢钾0.9%,pH 6.0,温度28℃。

表2 正交试验结果Table 2 Results of orthogonal test of enzyme production optimization
结果(表3)表明,试验的所有因子都是主要影响因素,其中甲醇诱导浓度和温度达到极显著水平(P<0.01),磷酸氢二铵、硫酸镁、磷酸二氢钾和pH达到了显著水平(P<0.05)。
续表2

表3 方差分析结果Table 3 Results of variance analysis
3 结论
本研究通过对工程菌EIM-50-eg2产内切中性纤维素酶发酵条件进行了研究,得到该工程菌最佳氮源是磷酸氢二铵,最适浓度4%,硫酸镁1%,磷酸二氢钾0.9%,最佳初始pH为6.0,最佳甲醇诱导浓度1.5%,最佳诱导产酶温度为28℃,最适微量元素PTM10.02%。在单因素实验的基础上采用正交实验优化发酵条件,工程菌EIM-50-eg2产内切中性纤维素酶EGⅡ酶活力从原来的1 449 U/(mL·min)提高到4 158 U/(mL·min),酶活力提高了约2.86倍。
[1] 顾方媛,陈朝银,石家骥,等.纤维素酶的研究进展与发展趋势[J].微生物学杂志,2008,28(1):83-86.
[2] 刘晓晶,李田,翟增强.纤维素酶的研究现状及应用前景[J].安徽农业科学,2011,39(4):1920-1924.
[3] Qin Y Q,Wei X M,Liu X M,et al.Purification and characterization of recombinant endoglucanase of Trichoderma reesei expressed in Saccharomyces cerevisiae with higher glycosylation and stability[J].Protein Express Purif,2008,58(1):162-167.
[4] 周文常.纤维素酶对亚麻织物的生物抛光整理[J].纺织科技进展,2008,(3):63-65.
[5] 谭慧芳,张国青,郑光宇,等.特异腐质霉中性内切葡聚糖酶Ⅱ基因的克隆及表达[J].微生物学通报,2006,33(6):68-73.
[6] 芦敬华,石家骥,葛克山,等.产中性纤维素酶特异腐质霉H31-3复合诱变研究[J].微生物学通报,2006,33(6):74-78.
[7] Bailey M J,Biely P,Poutanen K.Interlaboratory testing of methods for assay of xylanase activity[J].Journal of Biotechnology,1992,23(3):257-270.
[8] 黄文娟,刘睿,张达,等.重组毕赤酵母高密度发酵生产内切型纤维素酶的条件优化[J].生物加工过程,2010,8(4):51-60.
[9] Jahic M,Gustavsson M,Jansen A K,et al.Analysis and control of proteolysis of a fusion protein in Pichia pastoris fed-batch processes[J].Biotechnol,2003,102(1):45-53.
[10] He Xiuping,Liu Nan,Li Weiwei,et al.Inducible and constitutive expression of a novel thermostable alkaline β-mannanase from alkaliphilic Bacillus sp.N16-5 in Pichia pastoris and characterization of the recombinant enzyme[J].Enzyme and Microbial Technol,2008,43(1):13-18.
[11] 阎瑞香,吴仲,侯建华.重组巴斯德毕赤酵母发酵生产几丁质酶的条件优化研究[J].微生物学通报,2007,34(3):468-471.
[12] Haltrich D,Nidetzky B,Kulbe K D,et al.Production of fungal xylanases[J].Bioresource Technology,1996,58(2):137-161.
[13] Brierley R.A,Bussineau C,Kosson R,et al.Fermentation development of recombinant Pichia pastoris expressing the heterologous gene[J].Bovine Lysozyme,1990,(589):350-362.

