胸水中肺腺癌细胞与血清中PTN多效蛋白分子生物学的研究
李长思,李明珠,杨利霞,王秀茹,杜明伟,李建华*
(1.中国医科大学附属第一医院康复科,辽宁沈阳110001;2.中国医科大学基础医学院暨附属第一医院病理科,辽宁沈阳110001;3.中国医科大学基础医学院病理教研室,辽宁沈阳110001)
PTN(pleiotrophin)最早是1989年在华盛顿大学医学中心纯化的一种生长因子[1],当时认为该因子为17 ku的蛋白,与肝素具有高亲和性,并首次被命名为HBGF-8(heparin Binding growth factor-8)。1990年华盛顿大学医学中心的进一步研究[2]发现,该因子与当时已知的7个与肝素结合的生长因子不存在明显同源性,并因该蛋白具有多种生物学活性而改名为pleiotrophin(PTN),意为多效蛋白,从而更能准确地表达该因子的特性。PTN编码168个氨基酸,与MK存在50%的序列同源性,两者共同组成肝素结合超家族。PTN在多种肿瘤组织及血清中高表达[3-5],具有促进有丝分裂及血管新生的特性,影响肿瘤细胞的血供、生长及转移。研究表明,PTN蛋白在肺癌组织中含量丰富,早期即可在血浆中出现,并且与肿瘤的分期相关[6],2002年Jajer等用ELASA法检测肺癌患者血清中的PTN表达水平,发现PTN浓度比正常血清中的浓度显著增高,并且与临床病理分期成正相关,与化疗药物成负相关。本研究的目的是检测PTN在肺腺癌不同标本中的表达,并分析它们之间的关系,探讨PTN在肺腺癌EMT转化中的作用。
1 材料与方法
1.1 材料
1.1.1 临床资料收集2008年至2010年间肺腺癌患者的术前血清83例和相对应的肺腺癌所致的恶性胸水。另收取50例正常献血者血清、50例良性胸水增生细胞(炎症、结核、创伤所致)作为对照。所有标本均取自中国医科大学附属第一医院病理科。
1.1.2 试剂鼠抗人PTN(H-6)(sc-74443)单克隆抗体(浓缩性)购自美国Snata公司,辣根过氧化物酶标记的羊抗鼠二抗于4℃保存待用。兔抗人TTF1单克隆抗体(即用型)、鼠抗人CK19单克隆抗体(即用型)、鼠抗人E-ca单克隆抗体、兔抗人vimentin单克隆抗体(即用型)、S-P超敏免疫组化试剂盒和DAB酶底物显色试剂盒均购自北京中杉生物技术有限公司。
1.2 方法
1.2.1 免疫细胞化学技术胸水标本常规离心、沉淀包埋、切片、脱蜡、水化,按S-P法常规步骤进行,以PBS代替一抗作阴性对照。结果判定标准:每张切片在光镜下随机选取5个视野,每个视野计数100个瘤细胞。着色强度:无色为0分,浅黄色或黄色为1分,棕黄色为2分。阳性细胞数<10%为0分,10%~50%为1分,>50%为2分,2项得分相乘结果>2记为阳性(+),<2为阴性。
1.2.2 Western-blot技术总蛋白从血清和胸水细胞中提取,冰上超生处理,4℃静置,孵育50 min,4℃离心20 min(1 000 r/min),提取上清,用Brodford法测定蛋白浓度,以每孔80 μg蛋白加入10%SDS-PAGE凝胶电泳后,4℃,50 V条件下湿电转移仪将蛋白转入0.22 μm PVDF膜,5%脱脂奶粉封闭液封闭2 h,在分子量为18~25 ku附近剪开PVDF膜孵育一抗(PTN 1∶100稀释)4℃过夜,X底片曝光,显影,定影后拍照,以β-actin为内参,用凝胶成像及分析系统(BioImaging Systems,美国)分析蛋白各条带的灰度值,并取其与β-actin的比值为相对表达量分析PTN的表达情况,每组结果均为相同体条件重复3次。
1.2.3 统计学分析应用SPSS13.0统计软件进行数据处理,采用χ2检验(不满条件时用Fisher确切概率法)分析各组计数资料,P<0.05为差异有统计学意义。
2 结果与分析
2.1 血清中PTN蛋白Western-blot结果显示
如图1所示,在肺腺癌患者的血清中可见有特异性条带,其中Ⅳ期肺腺癌患者的血清PTN蛋白表达水平明显高于Ⅰ期肺腺癌患者的血清PTN蛋白表达水平。
2.2 PTN蛋白在胸水细胞中的免疫组化结果显示
在本研究中,首先做了免疫细胞化学CK19、TTF1染色,在所收集的189例恶性胸水细胞中两者均呈强阳性表达,由此推断所收集的恶性胸水细胞标本均为肺腺癌转移至胸水所致的恶性胸水细胞,如图2所示。PTN蛋白在恶性胸水腺癌细胞的阳性率为59%(49/83),在胸水良性增生细胞中的阳性率为0%(0/50),PTN蛋白在恶性胸水细胞中的阳性率高于胸水良性增生细胞中的阳性率(P<0.01)。

图1 血清中PTN蛋白Western-blot结果显示Fig.1 PTN protein Western-blot analysis showed in serum
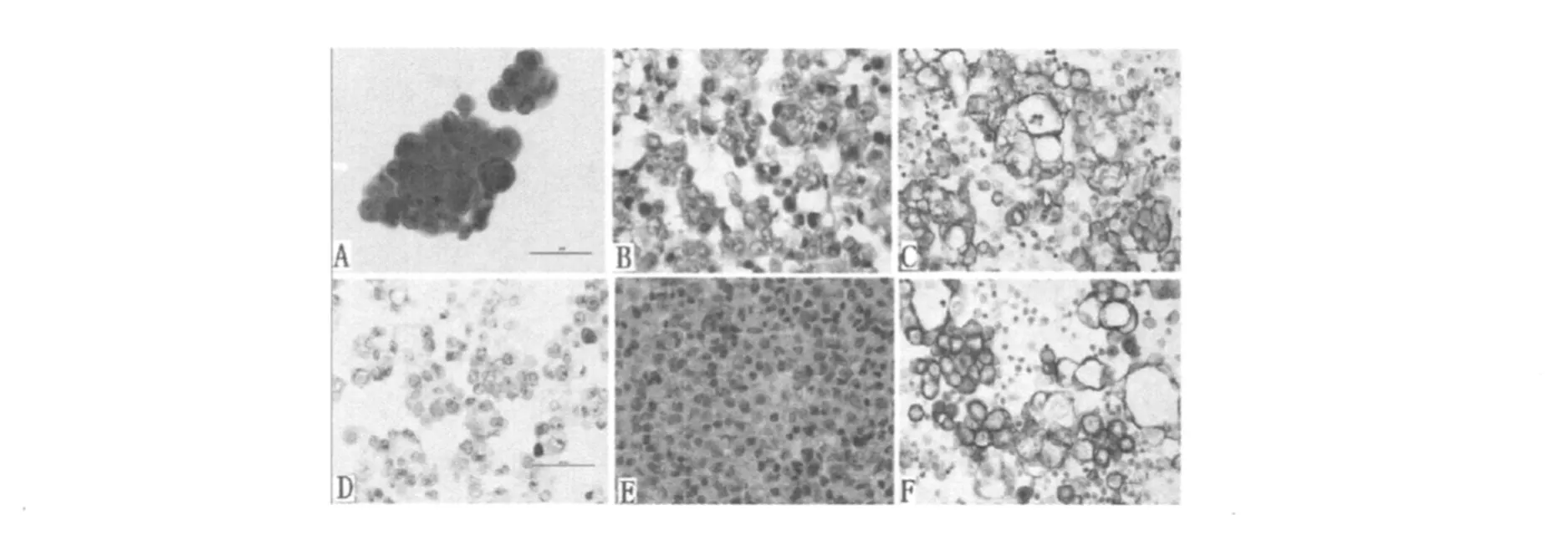
图2 PTN蛋白在胸水细胞中的免疫组化结果显示(400×)Fig.2 PTN protein in pleural effusion cells in immunohistochemical results show(400×)
2.3 PTN蛋白的表达和EMT之间的关系
PTN蛋白在肺腺癌患者的2种不同标本中阳性率的比较如表1所示,PTN蛋白在转移至胸水细胞中的阳性率59%(49/83)高于血清中的阳性率32.5%(27/83),差异具统计学意义(P<0.05),提示PTN的表达在肺腺癌的EMT转变中有非常重要的作用。83例肺腺癌转移至胸水细胞中的PTN和Vimentin表达之间的关系如表2所示,PTN和Vimentin成正相关,差异具统计学意义(P<0.01,r=0.728)。

表1 PTN蛋白在2种不同标本中阳性率的比较Table 1 The comparision of PTN protein positive rates in three difference specimens

表2 在恶性胸水腺癌细胞中PTN和Vimentin表达之间的关系Table 2 The relationship between PTN and Vimentin expressions in lung adenocarcinoma cells from pleural fluid
3 讨论
肺癌对人类健康的危害日益严重,由于难以早期发现和易于转移,导致肺癌死亡率增高,患者手术后5 a存活率降低。因此,近年来许多学者把研究的焦点聚集在肺癌的早期诊断和EMT(上皮间质化)上。
癌症的发生过程是一系列分子事件的作用引发的,包括基因突变(例如ras和p53基因突变)、生长因子和受体的过度表达、突变后的细胞能够恶性增长和易发生转移,并对药物产生抵抗,激活的PTN可能通过某种信号转导途径使肿瘤细胞更恶性增长,因为发现在多种肿瘤组织中,PTN是高表达的,如神经细胞瘤、神经胶质瘤、卵巢癌、前列腺癌、wilms瘤、绒癌和黑色素瘤等[7],在这些肿瘤组织中内源性的PTN基因持续活化,而在相应的正常组织中很难检测到PTN的表达。在神经母细胞瘤中PTN和它的受体RPTPβ/ζ都表达增加[8],并且它们的表达水平与该肿瘤恶性程度有关。PTN在某些肿瘤组织中,表现出细胞转化、抗凋亡、血管生成和纤溶等与肿瘤侵袭性生长有关的特性[9]。
1998年Souttou等[10]用ELISA方法检测消化道肿瘤患者血清中的PTN表达,发现肿瘤患者血清中的PTN表达水平显著高于正常对照,并与肿瘤的分期,肿瘤负荷相关。随后用免疫组织化学方法检测相应肿瘤患者组织中的PTN表达水平,结果发现,血清中PTN高表达的肿瘤患者,其组织中PTN亦高表达,并且术后患者血清中的PTN浓度较术前大大降低。2002年Jajer等[11]也用ELISA方法检测肺癌患者血清中的PTN表达水平,发现肺癌患者血清中的PTN表达水平明显高于对照组,并与肿瘤的分期成正相关,与化疗药的疗效成负相关,推测检测血清中的PTN表达水平可能成为早期诊断肺癌的一种有效方法。Jager等[12]在1997年应用RT-PCR检测了26株肺癌细胞系中的PTN mRNA表达,其中有12株小细胞肺癌(SCLC),14株非小细胞肺癌(NSCLC),结果显示9株SCLC和3株NSCLC有PTN mRNA的表达。
细胞发生上皮间质化(EMT)时,EMT表现为上皮细胞失去极性,与周围细胞和基质的接触减少,细胞黏附力下降,迁移和运动能力增加,同时细胞表型发生改变,而在肿瘤的侵袭和转移过程中细胞首先获得EMT的特性,以实现对周围组织的浸润和远处器官的转移,一旦这一过程完成,这些细胞就可能通过间质细胞上皮转型(mesenchyma-ep ithelial transition,MET)而重新获得增殖能力[13-14],Mitsiadis等[15]在1995年研究发现在胚胎发育(胚胎形成的9~14.5 d)和器官形成过程中,PTN在上皮间质化过程中发挥作用,如在神经系统、感觉器官、呼吸器官、消化器官、泌尿生殖器官以及骨骼和牙齿的发育过程中这2种蛋白都可以被检测出来。那么PTN在肿瘤EMT形成过程中是否也发挥重要的作用呢,2006年Perez-Pinera等[16]研究发现PTN可以破坏钙依赖的细胞与细胞之间的黏附从而引起EMT,但这是作者在体外PTN处理细胞获得的结论,然而在体内肺腺癌细胞中是否有PTN蛋白的存在,以及在肺腺癌EMT转变过程中其作用是什么。
本研究发现PTN在肺腺癌患者的2种不同标本中均高表达,同时直接比较早期肺腺癌(未发生转移的肺腺癌血清)和中晚期肺腺癌(发生转移的胸水)中PTN蛋白的表达,发现在中晚期肺腺癌中较早期肺腺癌中PTN蛋白的表达率高,说明PTN蛋白的表达在肺腺癌的侵袭转移过程中发挥了重要的作用。
以上研究表明PTN在肺腺癌中高表达,并且在其发生、发展和转移过程中也起重要的作用,尤其在肺腺癌的EMT转变中,其作用越来越受到人们的重视。未来的研究可以PTN作为药物靶点,或者对其信号通路进行干预,或者体外合成PTN抑制剂,达到下调PTN的作用[17],从而阻止EMT过程的发生。
[1] Milner PG,Li YS,Hoffman RM,et al.A novel 17 ku beparinbinding growth factor(HBGF-8)in bovine ulerus:purification and N-terminal amino acid sequence[J].Biochem Biophys Res Commun,1989,165(3):1096-1103.
[2] Li YS,Hoffman RM,Le Beau MM,et al.Characterization of the human pleiotrophin gene.Promoter region and chromosomal localization[J].J Biol Chem,1992,267(36):26011-26016.
[3] Liliental J,Moon SY,Lesche R,et al.Genetic deletion of the pten tumor suppressor gene promotes cell motility by activation of Rac1 and Cdc42 GTPases[J].Curr Biol,2000,10(7):401-404.
[4] Kilpelkinen I,Kaksonen M,Kinnunen T,et al.Heparin-binding growth-associated molecule contains two heparin-bindingβ-sheet domains that are homologous to the thrombospondin typeⅠrepeat[J].J Biol Chem,2000,275(18):13564-13570.
[5] Polykratis A,Delbe J,Courty J,et al.Identification of heparin affin regulatory peptide domains with potential role on angiogenesis[J].Int J Biochem Cell Biol,2004,36(10):1954-1966.
[6] 谢海燕,姜藻.多效蛋白在恶性胸腔积液中的诊断价值[J].中国现代医生,2009,6(47):29-31.
[7] Matsuura O,Kadomatsu K,Takei Y,et al.Midkine expression is associated with postnatal development of the lungs[J].Cell struct funct,2002,27(2):109-115.
[8] Polykratis A,Delbe J,Courty J,et al.Identification of heparin affin Regulatory peptide domains with potential role on angiogenesis[J].Int JBiochem Cell Biol,2004,36(10):1954-1966.
[9] Deuel TF,Zhang N,Yeh HJ,et al.Pleiotrophin:a cytokine with diverse functions and a novel signaling pathway[J].Arch Biochem Biophys,2002,397(2):162-171.
[10] Souttou B,Juhl H,Hackenbruck J,et al.Relationship between serum concentrations of the growthfactorpleiotrophin and pleiotrophin-positive Tumors[J].Natl cancer Inst,1998,90(19):1468-1473.
[11] Jajer,list,et al.Serum levels of the angiogenic factor pleiotrophin in relation todisease stage in lung cancer patients[J].Cancer Research UK,2002,86(6):858-863.
[12] Jager R,Noll K,Havemann K,et al.Differental expression and biologicalactivity of the heparin-binding growth-associated molecule(HB-GAM)in Lung cancer[J].Int Cancer,1997,73(4):537-543.
[13] 杨文君,陈丽荣.上皮间质转化在肿瘤侵袭转移中的作用[J].实用肿瘤杂志,2008,23(1):86-90.
[14] 徐江锋,罗庚求.上皮细胞间质转型与肿瘤转移[J].国际病理科学与临床杂志,2007,27(5):393-396.
[15] Mitsiadist TA,Salmivirtam M,Muramatsut T,et al.Expression of the heparin-binding cytokines,midkine(MK)and HBGAM(pleiotrophin)is associated with epithelial-mesenchymal interactions during fetal development and organogenesis[J].Development,1995,121(1):37-51.
[16] Perez-Pinera P,Alcantara S,Dimitrov T,et al.Pleiotrophin disrupts dependent-homophilic cell-cell adhesion and initiates an mesenchymal-transition[J].Proc Natl Acad Sci USA,2006,103:17795-17780.
[17] 张宏艳,李刚,宋三泰.pleiotrophin研究进展[J].国外医学遗传学分册,2005,2(28):65-68.

