阿托伐他汀对大鼠缺血心肌TRAIL表达及细胞凋亡的影响
王素云,王海芸,黄晓燕,王本极,陈必成,潘嘉林,杨德业
(1.温州医学院附属第一医院 心内科,温州医学院 心血管生物和基因研究所,浙江 温州 325000;2.温州市第三人民医院 药剂科,浙江 温州 325000;3.温州医学院附属第一医院 外科实验室,浙江 温州 325000)
急性心肌梗死(AMI)是心肌缺血性坏死,属冠心病的严重类型。过去认为坏死是心肌梗死的特征,近年来,越来越多的研究表明凋亡是梗死早期心肌死亡的主要方式[1]。心肌细胞凋亡已经被认为是心血管疾病发生发展的基本机制以及治疗心血管疾病的潜在靶点[2]。
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是肿瘤坏死因子超家族(TNFSF)成员[3]。有研究表明在冠心病患者的血清中TRAIL的表达下调[4],AMI患者循环中CD3+和CD14+细胞表面mTRAIL的表达增加[5]。另有研究表明,TRAIL有抗炎和抗动脉粥样硬化的活性[6-8]。这些均表明TRAIL可能是心血管疾病的一个重要的调节因子。
本研究通过观察阿托伐他汀干预缺血心肌TRAIL的表达及心肌细胞凋亡情况,探讨阿托伐他汀对心肌细胞凋亡的作用及可能机制。
1 材料和方法
1.1 材料 阿托伐他汀(辉瑞公司赠送),细胞凋亡原位检测试剂盒(In Situ Cell Death Detection Kit,POD)购自Roche公司,兔抗鼠Bcl-2及Bax多克隆抗体均购自北京中杉金桥,兔抗鼠TRAIL多克隆抗体购自abcam,SP检测试剂盒购自北京中杉金桥(pv-6001),HX-300动物人工呼吸机(成都泰盟科技有限公司)。
1.2 实验动物 健康雄性Sprague-Dawley大鼠,60只,体质量250~300 g,购自上海中科院实验动物中心[动物合格证号:SCXK(沪)2007-0005]。饲养于温州医学院实验动物中心普通级。
1.3 大鼠心肌梗死模型的复制 模型的复制参照文献[9]。10%的水合氯醛(350 mg/kg,腹腔注射)麻醉大鼠,以小动物呼吸机机械通气,频率为70次/min,呼吸比3:2,潮气量5~8 mL。于3或4肋间剪一2 cm横切口,钝性分离胸大肌和前锯肌,剪开肋间肌及胸膜暴露心脏,采用左前降支结扎的方法建立大鼠心肌梗死模型,以II导联心电图上见ST段明显抬高,同时梗死区心肌颜色变白,室壁运动明显减弱为手术成功的标志。
1.4 分组 术后24 h存活大鼠随机分为心梗组和阿托伐他汀组。阿托伐他汀组予以阿托伐他汀10 mg·kg-1·d-1溶于2 mL 0.9%氯化钠溶液中,灌胃给药治疗2周。假手术组开胸后只穿线不结扎。两组均予等量0.9%氯化钠溶液灌胃。
1.5 血脂水平测定 各组大鼠手术处理前在乙醚麻醉下眼眶采血约1 mL,采血前禁食12 h以上。给药2周后,禁食12 h以上,10%水合氯醛腹腔麻醉,开胸心脏采血约2 mL。所采血液静置30 min,3000 r/min离心20 min,分离血清,用全自动生化分析仪检测血清中总胆固醇(TC)、甘油三酯(TG)、高密度胆固醇(HDL-C)和低密度胆固醇(LDL-C)含量。
1.6 心肌组织病理学分析 各实验组心肌组织经甲醛固定,常规石蜡包埋,5μm 切片,常规HE染色后,光镜下观察。心梗面积=左室梗死区周径/[(左室心内膜周径+左室心外膜周径)/2] ×100%。
1.7 TUNEL分析 按常规病理组织学方法制备心肌石蜡标本。改良TUNEL方法[10]以Dnase I处理的组织作阳性对照,同时设立阴性对照。TUNEL阳性反应为核呈棕褐色或棕黄色颗粒,被判定为凋亡细胞。400倍显微镜下在非缺血区心肌随机取10个视野,计数凋亡细胞数和细胞总数。凋亡指数(%)=凋亡细胞数/细胞总数×100%。
1.8 Bcl-2、Bax、TRAIL的免疫组织化学检测 采用SP两步法: 滴加一抗Bcl-2 1:100,Bax 1:100,TRAIL 1:20 4 ℃过夜。以山羊抗兔二抗(北京中杉)孵育30 min。DAB显色。苏木素复染。以PBS代替一抗为阴性对照。结果评价:Bcl-2和Bax阳性细胞均为胞浆着色,呈棕黄色颗粒;TRAIL阳性细胞为胞浆和胞膜着色,呈浅黄、棕黄色。400倍显微镜下在非缺血区心肌选取5个不重叠的阳性视野,用Image J图像分析仪进行分析,测定细胞阳性染色的平均光密度(OD值)与阳性细胞百分比,计算蛋白阳性表达指数(PEI)。PEI=OD值×阳性细胞百分比×100。同时计算Bcl-2与Bax的比值。TRAIL用平均光密度表示其相对表达量。
3.2 利用CaCO3透明圈法可以筛选出产酸菌,然后再结合革兰氏染色以及代谢产物分析可以初步确定分离所得菌株为乳酸菌,但要确定其种属还要进行进一步的鉴定。
1.9 荧光实时定量RT-PCR 各组大鼠3只,心脏组织总RNA由TRIzol法提取。经紫外吸收测定和变性琼脂糖凝胶电泳鉴定RNA质量后,按RevertAidTM First Strand cDNA Synthe-sis Kit RT试剂盒说明书逆转录合成cDNA后,用TRAIL、Bax、Bcl-2实时定量RT-PCR引物(由上海英骏生物技术有限公司合成)进行荧光定量PCR检测,GAPDH作为内部参照。TRAIL引物序列为上游:5’-CCGATCCCATACTGCTG ATGA-3’,下游:5’-TTTGAGCTCGAACAGCCCC-3’;Bax上游:5’-AGCGGCTGCTTGTCTGGAT-3’,下游:5’- TG AGGACTCCAGCCACAAAGA-3’;Bcl-2上游:5’- TTCTCTC GTCGCTACCGTCG-3’,下游:5’- CCCTGAAGAGTTCCTCCA CCA-3’;GAPDH上游:5’-TCCTGCACCACCAACTGCTTAG-3’,下游:5’-AGTGGCAGTGATGGCATGGACT-3’。用ABI 7500 FAST型荧光定量PCR 仪检测,实验重复3次。通过比较ΔΔCt的方法进行TRAIL、Bax、Bcl-2表达的定量分析,相对表达量用2-ΔΔCt表示。Ct为每个反应管内的荧光信号到达设定的阈值时所经历的循环数,ΔCt为TRAIL、Bax、Bcl-2 Ct值与内参GAPDH Ct值之差,ΔΔCt为TRAIL、Bax、Bcl-2 ΔCt与假手术组ΔCt均值的差值。
1.10 统计学处理方法 应用SPSS 17.0统计软件,所有数据均采用±s描述,多组间比较应用单因素方差分析,两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 HE染色 光镜下观察,假手术组心肌纤维排列整齐,未见变性及坏死;模型组大鼠心肌纤维排列紊乱,心肌细胞溶解性坏死,间质增生,并有炎性细胞浸润(见图1)。除假手术组外,心肌梗死面积<30%的予以剔除,结果,假手术组大鼠6只,心梗组和阿托伐他汀组各8只被纳入统计。
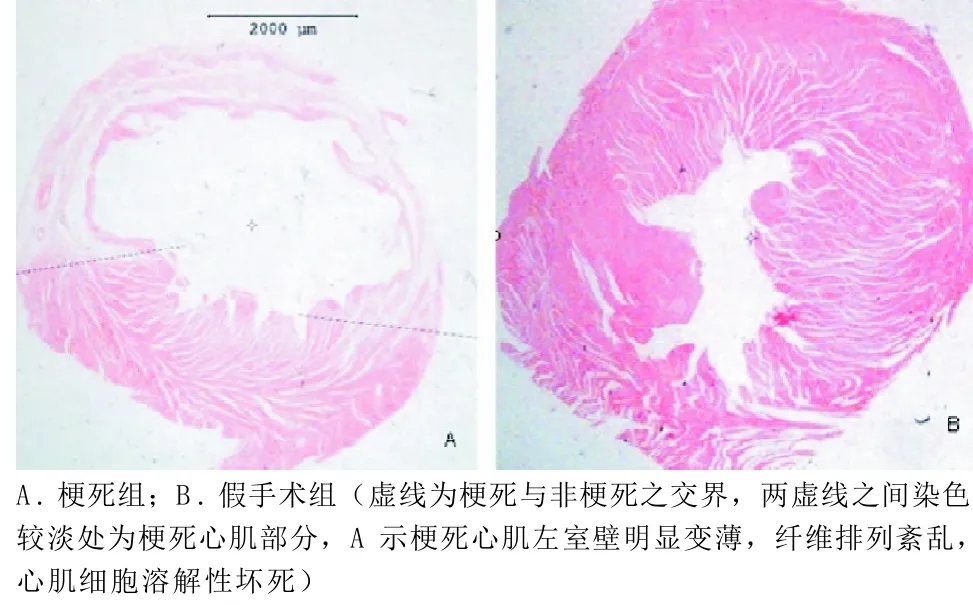
图1 大鼠心肌HE染色(×10)
2.2 各组大鼠TC、TG、HDL-C、LDL-C水平的变化各组大鼠治疗后与治疗前TC、TG、HDL-C、LDL-C水平相比,无明显变化(P>0.05),表明阿托伐他汀在心肌梗死中发挥的治疗作用与其降脂作用无明显关系(见表1)。
2.3 TUNEL法检测心肌细胞凋亡 假手术组中偶见凋亡心肌细胞,心梗组可见大量胞核呈深浅不一棕褐色的凋亡心肌细胞。心肌细胞凋亡指数,与假手术组相比,心梗组显著升高(P<0.01);与心梗组相比,阿托伐他汀组显著下降(P<0.01)。阿托伐他汀干预心肌缺血大鼠能明显减少其心肌细胞的凋亡(见表2、图2)。
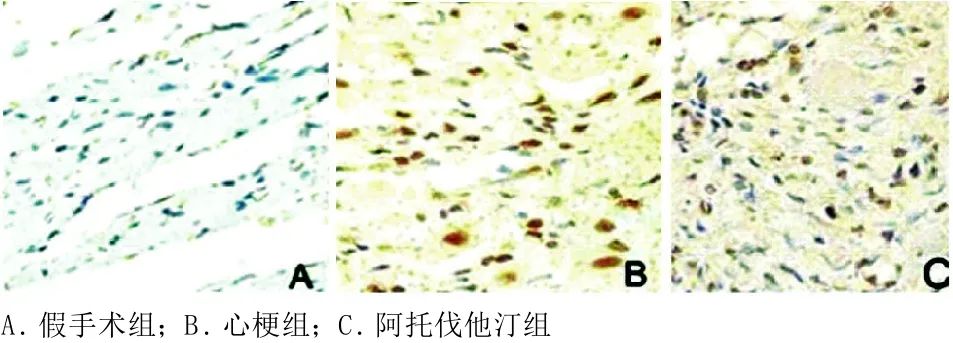
图2 TUNEL法检测各组大鼠心肌细胞凋亡(×400)
2.4 Bcl-2、Bax、TRAIL蛋白表达 Bcl-2各组之间的相对表达量,阿托伐他汀组>心梗组>假手术组。各组组间比较,与假手术组相比,心梗组明显升高(P<0.05),阿托伐他汀组显著升高(P<0.01),与心梗组比,阿托伐他汀组明显升高(P<0.05),表明阿托伐他汀干预心肌缺血大鼠能升高Bcl-2的表达(见表2)。
Bax在各组间均有表达,但差异无统计学意义,见表2。
与假手术组和心梗组相比,阿托伐他汀组Bcl-2与Bax的比值明显升高(P<0.05),而心梗组与假手术组相比差异无统计学意义(P>0.05),表明阿托伐他汀干预心肌缺血大鼠能升高Bcl-2与Bax的比值(见表2)。
与假手术组相比,心梗组TRAIL表达显著下降(P<0.01),阿托伐他汀组与心梗组相比表达显著升高(P<0.01),表明阿托伐他汀干预心肌缺血大鼠能上调TRAIL表达(见表2)。
2.5 定量RT-PCR结果 与假手术组相比,心梗组TRAIL mRNA表达显著下降(P<0.01),与心梗组相比,阿托伐他汀组TRAIL mRNA表达显著升高(P<0.01),表明阿托伐他汀干预心肌缺血大鼠能上调TRAIL mRNA表达。假手术组与心梗组Bcl-2 mRNA表达无明显差异,与心梗组比较,阿托伐他汀组Bcl-2 mRNA表达升高(P<0.05),表明阿托伐他汀干预心肌缺血大鼠能上调Bcl-2 mRNA表达。
与假手术组相比,心梗组及阿托伐他汀组Bax mRNA表达均升高,与心梗组比较,阿托伐他汀组下降(P<0.05),表明阿托伐他汀干预心肌缺血大鼠能下调Bax mRNA表达。与假手术组相比,心梗组Bcl-2/Bax显著下降(P<0.01),与心梗组比较,阿托伐他汀组Bcl-2/Bax升高(P<0.05),表明阿托伐他汀干预心肌缺血大鼠能上调Bcl-2/Bax的值(见表 3)。
3 讨论
阿托伐他汀属他汀类降脂药物,是一种3-羧-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl CoA,HMG-COA)抑制剂。他汀类药物能显著降低TC、TG的合成。最近研究发现他汀类药物能发挥独立于降脂外的效应。他汀类药物能恢复损伤的内皮细胞的功能,恢复血流[11-12]。在急性冠脉综合征患者中,他汀类药物具有稳定粥样斑块、抗炎及减少心肌梗死和中风概率的作用[13]。研究表明,他汀类药物在经皮冠脉介入术、冠脉搭桥术中起到保护心肌,减小心肌梗死面积的作用[14]。Tanaka等[15]观察到阿托伐他汀能阻断PKC抑制剂诱导培养的大鼠心肌细胞凋亡。Ogata等[16]比较氟伐他汀与普伐他汀对培养鼠心肌细胞增殖的影响,发现氟伐他汀呈时间及剂量依赖性诱导心肌细胞凋亡,普伐他汀则无此作用。本实验发现,10 mg·kg-1·d-1阿托伐他汀能显著减少心肌梗死边缘区的心肌细胞凋亡,其机制可能与上调Bcl-2,下调Bax及最终上调Bcl-2/Bax的比值有关。
表1 各组大鼠血脂水平比较(n=5,±s,mmol/L)
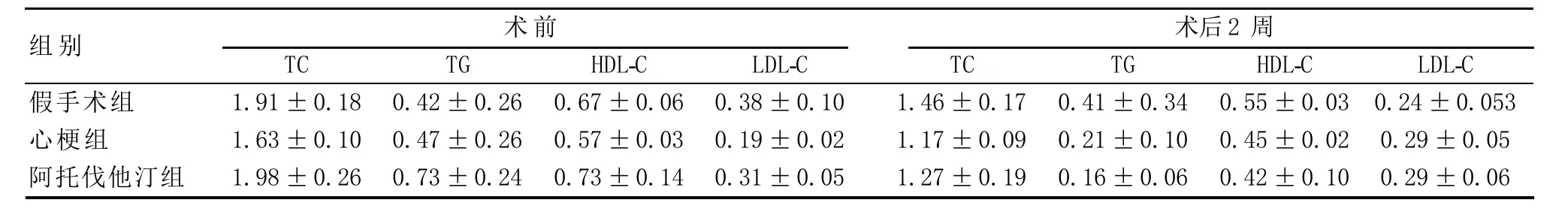
表1 各组大鼠血脂水平比较(n=5,±s,mmol/L)
组别假手术组心梗组阿托伐他汀组TC 1.91±0.18 1.63±0.10 1.98±0.26术前术后2周TG 0.42±0.26 0.47±0.26 0.73±0.24 HDL-C 0.67±0.06 0.57±0.03 0.73±0.14 LDL-C 0.38±0.10 0.19±0.02 0.31±0.05 TC 1.46±0.17 1.17±0.09 1.27±0.19 TG 0.41±0.34 0.21±0.10 0.16±0.06 HDL-C 0.55±0.03 0.45±0.02 0.42±0.10 LDL-C 0.24±0.053 0.29±0.05 0.29±0.06
表2 各组Bcl-2、Bax、TRAIL蛋白表达及凋亡指数比较(±s)
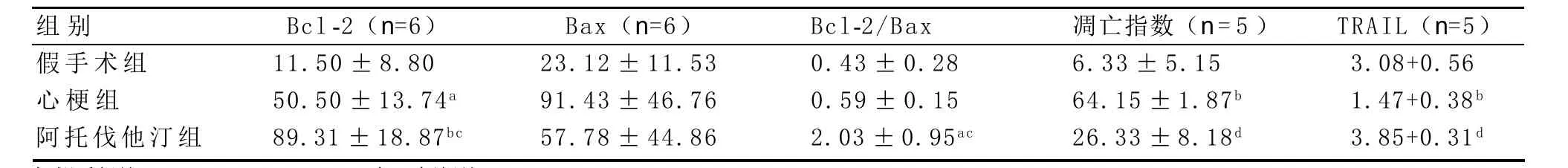
表2 各组Bcl-2、Bax、TRAIL蛋白表达及凋亡指数比较(±s)
与假手组比:aP<0.05,bP<0.01;与心梗组比:cP<0.05,dP<0.01
TRAIL(n=5)3.08+0.56 1.47+0.38b 3.85+0.31d组别假手术组心梗组阿托伐他汀组Bcl-2(n=6)11.50±8.80 50.50±13.74a 89.31±18.87bc Bax(n=6)23.12±11.53 91.43±46.76 57.78±44.86 Bcl-2/Bax 0.43±0.28 0.59±0.15 2.03±0.95ac凋亡指数(n=5)6.33±5.15 64.15±1.87b 26.33±8.18d
表3 TRAIL、Bcl-2、Bax基因定量RT-PCR结果(n=6±s)

表3 TRAIL、Bcl-2、Bax基因定量RT-PCR结果(n=6±s)
与假手术组比:aP<0.05,bP<0.01;与心梗组比:cP<0.05,dP<0.01
Bcl-2/Bax 0.63±0.37 0.16±0.06b 0.47±0.19c组别假手术组心梗组阿托伐他汀组TRAIL 1.03±0.28 0.36±0.23b 0.80±0.34d Bcl-2 0.23±0.12 0.15±0.03 0.33±0.11c Bax 0.38±0.05 1.01±0.45b 0.72±0.08ac
TRAIL属II型跨膜蛋白,目前已发现5种TRAIL受体,包括两种死亡受体DR4、DR5,两种诱骗受体DcR1、DcR2和一种可溶型受体OPG,均属TNFSF成员。TRAIL与受体DR4、DR5结合可以通过依赖线粒体和非依赖线粒体两条途径发挥促凋亡的作用,而与DcR1、DcR2结合可以保护细胞不发生凋亡。
文献报道,正常心脏组织中发现有TRAIL及其受体的表达,其中DR5的表达水平很高[17]。Nakajima等[18]用免疫组化法发现在AMI患者的病理组织中,变性的心肌细胞有DR4和DR5的表达,提示TRAIL及其受体可能参与某些病理状态下的细胞凋亡。但Secchiero等[19]认为,在心血管系统,TRAIL只在特定的情况下诱导血管内皮细胞的凋亡,比如抑制Akt通路。有研究发现,在冠心病患者的血清中TRAIL的表达下调[4];另有研究发现,AMI后早期血清TRAIL表达显著下降,随后逐渐升高,6~12个月恢复到接近健康水平,早期心肌梗死血清TRAIL的表达下降水平与心血管事件的发生密切相关,与负性预测指标如CK、CK-MB、BNP呈负相关,因此,循环中的TRAIL在冠心病患者中可能起到保护作用[17]。最近的研究也证实,TRAIL及其受体(DR4和DR5)能促进多种细胞包括淋巴细胞、内皮细胞、血管平滑肌细胞、成纤维细胞的存活和增殖[20-22]。现在被广泛接受的观点是,TRAIL与受体DR4、DR5的结合能激活转录因子NF-κB,继而激活抗凋亡基因包括CIAP1、CIAP2、XIAP、TRAF1、TRAF2、c-FLIP和Bcl-XL。TRAIL与DR4和DR5结合也可以激活参与细胞存活过程的ERK1/2、MAPK、JNK和Akt[23]。我们的研究发现,就蛋白质水平及基因水平,急性心肌梗死后心肌TRAIL表达较假手术组均明显下降,阿托伐他汀组缺血心肌TRAIL表达明显升高,由此,我们推测,阿托伐他汀干预缺血心肌TRAIL表达上调可能参与了心血管的保护作用,这种作用可能与TRAIL的抗凋亡作用有关,而这种抗凋亡作用一部分可能与Bcl-2的高表达、抑制线粒体凋亡通路有关。
TRAIL基因在肿瘤的研究中较多,而在心血管领域的研究有限,我们的发现,结合前人的研究发现,TRAIL除了促进凋亡的作用,同时也有抗凋亡的作用,如何平衡其在两者中的作用,以发挥对疾病的治疗作用,具有一定的研究价值。阿托伐他汀是治疗心肌缺血的常用药物,其除了降脂作用外,还有多种作用,我们发现其改变了心肌TRAIL因子的表达,从而通过某种机制参与了抗凋亡作用。
[1] 中华内科杂志编委会心血管病学编写组.我国心血管疾病十年回顾[J].中华内科杂志,1999,38(9):599-603.
[2] Yue TL,Ohlstein EH,Ruffolo RRJr.Apoptosis:a potential target for discovering novel therapies for cardiovascular disease[J].Curr Opin Chem Biol,1999,3(4):474-480.
[3] Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995,3(6):673-682.
[4] Schoppet M,Sattler AM,Schaefer JR,et al.Osteoprotegerin(OPG) and tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) levels in atherosclerosis[J]. Atherosclerosis,2006,184(2):446-447.
[5] Liao X,Wang X,Gu Y,et al.Involvement of death receptor signaling in mechanical stretch-induced cardiomyocyte apoptosis[J].Life Sci,2005,77(2):160-174.
[6] Zauli G,PandolfiA, Gonelli A, et al. Tumor necrosis factorrelated apoptosis inducing ligand (TRAIL) sequentially upregulates nitric oxide and prostanoid production in primary human endothelial cells[J].Circ Res,2003,92(7):732-740.
[7] Secchiero P,Corallini F,di Iasio MG,et al.TRAIL counteracts the proadhesive activity of inflammatory cytokines in endothelial cells by down-modulating CCL8 and CXCL10 chemokine expression and release[J].Blood,2005,105(9):3413-3419.
[8] Secchiero P,Candido R,Corallini F,et al.Systemic TRAIL delivery shows anti-atherosclerotic activity in apoE-null diabetic mice[J].Circulation,2006,114(14):1522-1530.
[9] 刘开宇,田海,孙露,等.标准化大鼠心肌梗死模型的制作[J].哈尔滨医科大学学报,2007,41(6):531-534.
[10] 朱汉华,李浪,汪熠,等.TUNEL检测心肌细胞凋亡的影响因素探讨[J].广西医科大学学报, 2009,26 (1):24-26.
[11]Chen L,Haught WH,Yang B,et al.Preservation of endogenous antioxidant activity and inhibition of lipid peroxidation as common mechanisms of antiatherosclerotic effects of vitamin E, lovastatin and amlodipine[J]. J Am Coll Cardiol,1997,30(2):569-575.
[12]Brandes RP,Behra A,Lebherz C,et al.Lovastatin maintains nitric oxide--but not EDHF-mediated endothelium-dependent relaxation in the hypercholesterolemic rabbit carotid artery[J]. Atherosclerosis,1999,142(1):97-104.
[13]Bates K,Ruggeroli CE,Goldman S,et al.Simvastatin restores endothelial NO-mediated vasorelaxation in large arteries after myocardial infarction[J].Am J Physiol Heart Circ Physiol,2002,283(2):H768-H775.
[14] Atar S,Ye Y,Lin Y,et al.Atorvastatin-induced cardioprotection is mediated by increasing inducible nitric oxide synthase and consequent S-nitrosylation of cyclooxygenase-2[J].Am J Physiol Heart Circ Physiol, 2006,290(5):H1960-H1968.
[15]Tanaka K,Honda M,Takabatake T. Anti-apoptotic effect of atorvastatin, a3-Hydroxyl-3-methylglutaryl coenzyme a reductase inhibitor, on cardiac myocytes through protein kinase C activation[J] .Clin Exp Pharmacol Physiol,2004,31(5-6):360-364.
[16] Ogata Y,Takahashi M,Takeuchi K,et al. Fluvastatin induces apoptosis in rat neonatal cardiac myocytes:a possible mechanism of statin attenuated cardiac hypertrophy[J].J Cardiovasc Pharmacol,2002,40(6):907-915.
[17] 宋朝君,刘雪松,陈立华,等.TRAIL及其受体在正常心脏组织的免疫组织化学定位[J].心脏杂志, 2003,15(6):490-492.
[18]Nakajima H,Yanase N,Oshima K,et al.Enhanced expression of the apoptosis inducing ligand TRAIL in mononuclear cells after myocardial infarction[J].Jpn Heart J,2003,44(6):833-844.
[19] Secchiero P,Corallini F,Ceconi C,et al. Potential prognostic significance of decreased serum levels of TRAIL after acute myocardial infarction[J].PLoS one, 2009,4(2):e4442.[20]Secchiero P, Gonelli A,Carnevale E,et al.TRAIL promotes the survival and proliferation of primary human vascular endothelial cells by activating the Akt and ERK pathways[J].Circulation,2003,107(17):2250-2256.
[21]Secchiero P,Zerbinati C,Rimondi E,et al. TRAIL promotes the survival, migration and proliferation of vascular smooth muscle cells[J].Cell Mol Life Sci, 2004,61(15):1965-1974.
[22]Morel J, Audo R, Hahne M, et al. Tumor necrosis factor related apoptosis-inducing ligand (TRAIL) induces rheumatoid arthritis synovial fibroblast proliferation through mitogen-activated protein kinases and phosphatidylinositol3-kinase/Akt[J].J Biol Chem,2005,280(16):15709-15718.
[23]Kavurma MM, Bennett MR. Expression, regulation and function of trail in atherosclerosis[J]. Biochem pharmacol,2008,75(7):1441-1450.

