卡托普利对糖尿病大鼠心肌细胞凋亡及相关蛋白表达的影响
蒋贤忠,赵竞,金可可,李剑敏,赵晨晨,曾玉萍,楼帅,邱晓晓
(温州医学院,浙江 温州 325035,1.第一临床医学院;2.病理生理学教研室)
糖尿病心肌病(diabetes cardiomyopathy, DC)是糖尿病(diabetes mellitus,DM)最常见的并发症之一,可发展为心力衰竭,是导致DM患者死亡的主要原因。研究表明,细胞凋亡参与了DC的发生、发展[1]。血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)能有效逆转DC心脏重构,具有明显的心肌保护作用[2],但其在DC细胞凋亡方面的研究报道较少。本实验以链脲佐菌素(streptozocin,STZ)建立DM大鼠模型,观察ACEI类药物卡托普利(captopril)对DM心肌细胞凋亡及凋亡相关蛋白Bcl-2、Bax、Caspase-3表达的影响,并探讨其机制。
1 材料和方法
1.1 实验动物 健康SPF级成年雄性SD大鼠30只,体质量180~220 g,由温州医学院实验动物中心提供,动物许可证号:SYXK(浙2010-0150)。
1.2 主要试剂 卡托普利(规格:25 mg/片)购自常州制药厂;STZ及枸橼酸钠分析纯购自美国Sigma公司;细胞凋亡检测试剂盒购自武汉博士德生物工程有限公司;兔抗鼠Bcl-2、Bax、Caspase-3多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗购自北京中杉生物技术有限公司;BCA蛋白定量试剂盒购自美国Pierce公司;PVDF膜购自美国Bio-Rad公司;BeyoECL Plus(免疫印迹化学发光试剂盒)购自碧云天生物技术有限公司。
1.3 动物分组及模型建立 健康SPF级成年雄性SD大鼠30只,随机分成正常对照组(NC组)10只和造模组20只。造模组大鼠禁食12 h后,STZ按65 mg/kg剂量腹腔注射,注射后72 h测血糖在13.8 mmol/L以上者为造模成功。NC组则给予等容积的0.9%氯化钠溶液腹腔注射。成功模型大鼠随机分为DM组、卡托普利组(Cap组)。Cap组按50 mg/(kg·d)剂量灌胃给予卡托普利,DM组和NC组则给予等容积的0.9%氯化钠溶液。所有动物自由进食、饮水,饲养,每2周测血葡萄糖一次。饲养12周后行股动脉放血处死大鼠。
1.4 大鼠生长过程相关指标的测定 大鼠精神状态、体质量监测。
1.5 大鼠血糖水平的测定 每隔2周行断尾采血法(采用Johnson稳步倍加血糖仪)测定大鼠血糖一次,动态监测大鼠血糖水平的变化。
1.6 原位缺口末端标记法(TUNEL法)检测心肌组织细胞凋亡 按试剂盒说明书操作。显微镜下细胞核中有棕黄色颗粒者为阳性细胞,即心肌组织凋亡细胞。随机计算5个高倍视野(×400)下的凋亡细胞数,凋亡指数(apoptotic index,AI)以凋亡细胞/100个细胞(%)表示。
1.7 Western blot法检测心脏组织Bcl-2、Bax、Caspase-3蛋白的表达 大鼠处死后立即取出心脏,冰浴上取左心室前壁组织,将所取组织于-70 ℃储存备用,每组各3只。全细胞裂解液提取心脏组织总蛋白,BCA法测定总蛋白浓度,SDS-PAGE电泳分离蛋白后转移到PVDF膜上,5%的脱脂奶粉封闭1 h,加入兔抗鼠Bcl-2、Bax、Caspase-3多克隆抗体,4℃孵育过夜,TBST洗膜后加HRP标记的二抗,室温孵育2 h后ECL发光,暗室中曝光、显影、定影。Quantity One凝胶软件分析系统分析蛋白条带的光密度值,以GADPH为内参照进行蛋白半定量。
1.8 心脏组织超微结构观察 取左心室前壁1 mm×1 mm×1 mm大小的组织2~3块,2.5%戊二醛前固定,1%锇酸后固定,乙醇丙酮系列梯度脱水后Epon812包埋,超薄切片,醋酸硝酸铅双重染色,透射电镜下观察。
1.9 统计学处理方法 采用SPSS 17.0统计软件分析。所有数据进行正态性检验,用±s表示。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(One-way ANOVA)。方差齐性者两两比较采用LSD法,方差不齐者进行Dunnet’s T3检验。
2 结果
2.1 一般情况 NC组大鼠精神活跃,动作自如,反应灵敏,毛发平伏有光泽,生长速度较快;DM组大鼠出现明显多饮、多食、多尿症状,精神萎靡,动作迟缓,反应迟钝,毛发无光泽,弓背蜷体,体质量较NC组明显减轻;Cap组较DM组多饮、多食、多尿症状减轻,精神较活跃,活动度较好,毛发较有光泽,体质量减轻情况改善。三组大鼠12周的体质量变化见图1。
2.2 血糖水平的变化 NC组大鼠血糖正常,很稳定;与NC组相比,DM组、Cap组大鼠血糖显著升高(均P<0.05);与DM组比较,Cap组大鼠血糖升高幅度降低,差异有统计学意义(P<0.05)。结果见图2。
2.3 心脏组织细胞凋亡检测 NC组少量细胞凋亡;DM组细胞凋亡较NC组明显增加(P<0.05);Cap组细胞凋亡较DM组明显减少,但仍高于NC组(P<0.05)。结果见表1、图3。
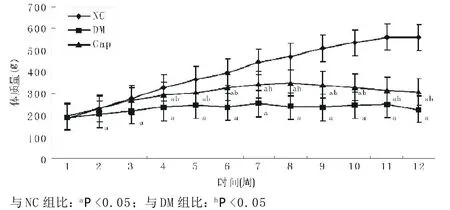
图1 各组大鼠体质量变化曲线

图2 三组大鼠血糖的变化曲线
表1 各组大鼠心脏组织细胞AI、Bcl-2、Bax、Caspase-3蛋白比较(n=10±s)

表1 各组大鼠心脏组织细胞AI、Bcl-2、Bax、Caspase-3蛋白比较(n=10±s)
与NC组比:aP<0.05;与DM组比:bP<0.05
Bcl-2 0.880±0.156 0.613±0.032a 0.900±0.046b组别NC DM Cap AI(%)1.93±0.60 30.62±2.05a 23.45±1.70ab Bax 0.683±0.038 1.177±0.112a 0.817±0.064b Caspase-3 0.297±0.085 0.930±0.168a 0.433±0.205b
2.4 Western blot法检测心脏组织Bcl-2、Bax、Caspase-3蛋白的表达 与NC组相比,DM组心脏组织Bcl-2蛋白表达明显减少,Bax、Caspase-3蛋白表达明显增加(均P<0.05);与DM组相比,Cap组心脏组织Bcl-2蛋白表达明显增加,Bax、Caspase-3蛋白表达明显减少(均P<0.05)。结果见表1、图4-6。
2.5 心脏组织超微结构改变 NC组心肌肌原纤维丰富,肌丝分布均匀;线粒体膜完整,嵴排列规则;微血管基底膜连续完整。DM组心肌细胞肿胀,肌原纤维灶性溶解,肌丝排列紊乱,部分断裂;线粒体肿胀,嵴排列紊乱甚至断裂,空泡形成;间质胶原增生,微血管基底膜增厚。Cap组心肌肌原纤维部分排列紊乱;线粒体肿胀减轻,少部分嵴断裂;微血管基底膜增厚减轻。结果见图7。

图4 Western blot法检测各组大鼠心脏组织Bcl-2蛋白的表达
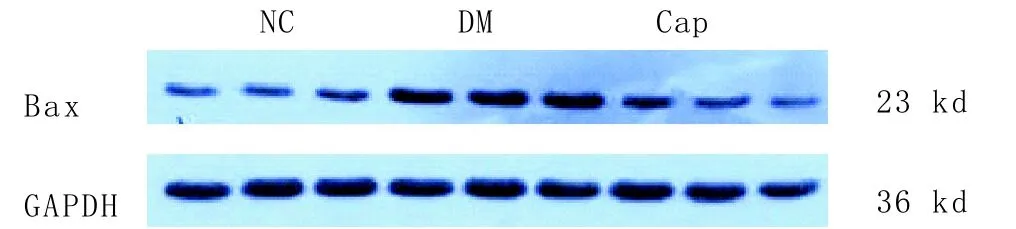
图5 Western blot法检测各组大鼠心脏组织Bax蛋白的表达

图6 Western blot法检测各组大鼠心脏组织Caspase-3蛋白的表达

图7 各组大鼠心肌细胞超微结构变化(电镜,×10000)
3 讨论
DC是指DM患者心肌原发性损伤引起广泛的结构异常,最终引起左心室肥厚,舒张期和(或)收缩期功能障碍的一种疾病状态,由Rubler于1972年最早提出。但迄今为止,其发生机制尚未完全阐明,可能机制包括心肌细胞代谢紊乱、氧化应激、细胞内钙超载、间质纤维化、心脏自主神经病变等[3]。研究发现,细胞凋亡参与DC的发生和发展,长期高血糖导致的心肌细胞凋亡是受基因调控及一系列蛋白酶形成的级联反应过程[1]。
Bcl-2基因家族是主要的凋亡调控蛋白,Bcl-2是首个被确认有抑制凋亡作用的基因,其抗凋亡的机制主要是:①直接抗氧化作用;②维持细胞钙稳态;③抑制Caspases的激活;④抑制线粒体释放促凋亡的蛋白质,如细胞色素C和凋亡诱导因子(AIF)的释放;⑤抑制促凋亡蛋白Bax、Bak的细胞毒作用。Bax亦为Bcl-2基因家族成员,含有与Bcl-2基因一致的BH1、BH2、BH3三个同源区域,但其作用与Bcl-2基因相反,属于促凋亡基因。Bcl-2高表达时,可形成Bcl-2/Bcl-2同源二聚体,也可形成Bcl-2/Bax异源二聚体,均抑制凋亡;Bax高表达时,则形成Bax/Bax同源二聚体,促进细胞凋亡[4]。Caspase家族是参与调节和执行凋亡最重要的蛋白酶之一,Caspase-3作为Caspase家族中最重要的成员,是凋亡发生的标志酶,是细胞凋亡蛋白酶级联反应的必经之路,控制着细胞凋亡的发生、发展。刘欣等[5]研究显示,DM时心肌细胞凋亡增加,Bcl-2蛋白表达减少,Bax蛋白表达增加。Cai等[6]研究发现,高血糖导致的细胞凋亡至少部分是通过Caspase-3依赖性的线粒体途径调控的。本实验发现,DM组大鼠心肌细胞AI明显增加,Bcl-2蛋白表达减少,Bax、Caspase-3蛋白表达增加,电镜示心肌超微结构呈明显损伤性变化,说明DC时细胞凋亡的发生与Bcl-2、Bax表达水平的异常改变及Caspase-3的激活有关,与文献报道结果一致。Bcl-2表达下调、Bax表达上调所致的Caspase-3依赖性的细胞凋亡可能是DC的发生机制之一。
近年来研究发现,心肌局部肾素-血管紧张素系统(renin angiotensin system,RAS)的过度激活,血管紧张素II(AngII)的异常作用也参与DC细胞凋亡的过程[7]。卡托普利是ACEI类药,可通过抑制全身或局部的RAS,减少AngII的生物合成而具有抑制细胞凋亡的作用[8]。本实验观察到Cap组心肌AI明显降低,Bcl-2蛋白表达增加,Bax、Caspase-3蛋白表达减少,超微结构损伤不同程度减轻,表明卡托普利可能通过上调Bcl-2表达,下调Bax表达,减少Caspase-3依赖性的心肌细胞凋亡,从而保护DM心肌结构。
综上所述,卡托普利可以改善DM大鼠高血糖、体质量减轻等症状及心肌结构,上调Bcl-2表达,下调Bax表达,减少Caspase-3依赖性的心肌细胞凋亡,为临床干预DC的发生、发展提供实验依据。
[1] Cai L, Kang YJ. Cell death and diabetic cardiomyopathy [J].Cardiovasc Toxicol,2003,3(3):219-228.
[2] 张晗,熊世熙,王海蓉,等. 卡托普利与贝那普利对糖尿病大鼠心肌的保护作用[J].心脏杂志,2009,21(6):795-797.
[3] Okoshi K, Guimaraes JF, Di Muzio BP, et al.Diabetic Cardiomyopathy[J].Arq Bras Endocrinol Metabol,2007,51(2):160-167.
[4] Walensky LD. Bcl-2 in the crosshairs:tipping the balance of life and death[J]. Cell Death Differ,2006,13(8):1339-1350.
[5] 刘欣,赵秀兰,康毅. 糖尿病大鼠心肌细胞凋亡及凋亡相关蛋白表达研究[J].中国心血管杂志,10(1):4-7.
[6] Cai L, Li W. Hyperglymia-induced apoptosis in mouse myocardium, mitochondrial cytochrome mediated caspase-3 activation pathway[J]. Diabetes,2002,51(6):1938-1948.
[7] Connelly KA, Boyle AJ,Kelly DJ. Angiotensin II and the cardiac complications of diabetes mellitus [J].Currpham Des,2007,13(26):2721-2729.
[8] Zagariya A, Bhat R, Navale S, et al. Inhibition of meconium-induced cytokine expression and cell apoptosis by pretreatment with captopril[J]. Pediatrics,2006,117(5):1722-1727.

