FOXP1和pVHL在肾透明细胞癌中的表达及意义
陈建欧,万丽,陈霖,黄卡特,吴秀玲
(1.温州市第八人民医院 病理科,浙江 温州 325000;2.温州医学院附属第一医院 病理科,浙江温州 325000)
肾细胞癌占成人肾脏恶性肿瘤的80%,居泌尿系统肿瘤第二位,每年全世界约9.5万人死于肾癌,约1/3肾癌患者初诊时已发生转移,其生物学行为极为多变,难以预测[1]。了解肾细胞癌的形成机制、提高预后评估水平对患者的治疗具有重要的意义。
基因变异在肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)的发生中发挥重要的作用,尤其是染色体3p位点缺失或突变,可见于96%的散发性CCRCC,其中VHL基因(3p25)变异是CCRCC的典型特征。VHL基因通过其蛋白产物pVHL降解低氧诱导因子(HIF)、调节血管内皮生长因子(VEGF)等发挥抑制肿瘤的作用[2]。pVHL是一种多功能蛋白,不仅能抑制VHL依赖性肾细胞癌的生长,而且在维持p53稳定性、细胞内环境调节中亦起关键作用[3]。FOXP1属于叉头转录因子家属,位于3p14.1,是新近发现的候选肿瘤抑制基因,在细胞转录、分化和增殖过程中起重要作用。FOXP1在正常组织中主要表达于细胞核,而在肿瘤细胞中则可出现异常表达,即胞浆、胞膜或胞核、胞浆同时表达,除B细胞恶性淋巴瘤外[4],FOXP1在其他各种肿瘤中的临床意义尚不清楚。据报道,CCRCC的FOXP1的表达率高达90%[5]。本研究旨在探讨FOXP1在CCRCC中的表达和定位情况,及其与临床病理参数和pVHL表达的相关性。
1 材料和方法
1.1 一般资料 收集2008年2月-2009年12月经病理确诊的CCRCC患者共48例,其中男38例,女10例,年龄32~68岁,平均52岁。临床表现为腰部不适、血尿21例,其余均为体检发现。肿块位于左肾31例,右肾17例,大小为3~8 cm。pT1期19例,pT2期15例,pT3/pT4期14例。病理分级:G1 10例,G2 25例,G3 13例。8例伴有淋巴结转移,10例伴出血和坏死。均行肾癌根治术。
1.2 检测方法 所有标本均经4%中性甲醛固定,常规石蜡包埋切片,HE染色,光镜观察。免疫组织化学染色采用Envision二步法。FOXP1特异性单克隆抗体(JC12抗体,由英国牛津大学Banham AH馈赠,工作浓度为1:80)及pVHL(北京中杉公司产品,工作浓度为1:50)两种免疫组化标记,操作均按说明书进行。以反应性增生的扁桃体作FOXP1阳性对照,以已知的肾透明细胞癌标本作pVHL阳性对照,用PBS代替一抗作阴性对照。FOXP1染色结果判定:肿瘤细胞无表达定义为阴性,胞浆、胞核、胞膜表达定义为阳性;每例均选择表达最强区域计算阳性细胞数,定义1%~10%阳性细胞数为0(阴性),11%~30%为 1(弱表达),31%~70%为2(中度表达),>70%为3(强表达)[6]。pVHL染色结果判定:胞浆或胞膜浅黄至棕黄色为阳性,不着色为阴性。
1.3 统计学处理方法 使用SPSS12.0软件,FOXP1和pVHL两者表达与临床病理参数用x2和Fisher检验,两者的相关性用Speaman等级相关分析。
2 结果
2.1 FOXP1在CCRCC中的表达 正常肾组织中,近曲小管FOXP1胞浆阳性,远曲小管和集合管胞核呈阳性表达,肾小球和细段呈阴性或弱表达(见图1)。48例CCRCC患者中FOXP1阴性者8例(占16.7%),弱表达者23例(占47.9%),中至强表达者17例(占35.4%),其中胞核、胞浆同时表达者9例,胞膜、胞浆同时表达者3例,余28例仅胞浆表达(见图2-3)。13例高级别CCRCC中有8例FOXP1阳性表达,而35例低级别CCRCC中有32例FOXP1阳性表达,高级别组明显低于低级别组,差异有统计学意义(P<0.05),FOXP1在各临床分期中表达无明显差异(P>0.05),在有淋巴结转移的CCRCC和无淋巴结转移的CCRCC病例中,FOXP1的表达无明显差异(P> 0.05)(见表1)。
2.2 pVHL在CCRCC中的表达 正常肾小管、肾小球pVHL呈弱表达。48例CCRCC患者中呈胞浆阳性者25例(占52.1%)(见图4)。pVHL表达与肿瘤分级、临床分期、淋巴结转移均无明显相关性(P>0.05),见表1。

图1 FOXP1在正常肾组织中的表达情况(×200)
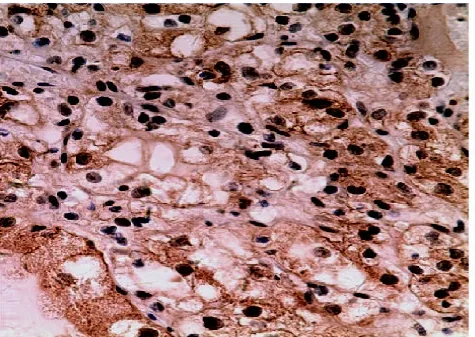
图2 CCRCC中FOXP1胞核与胞浆同时表达(×200)
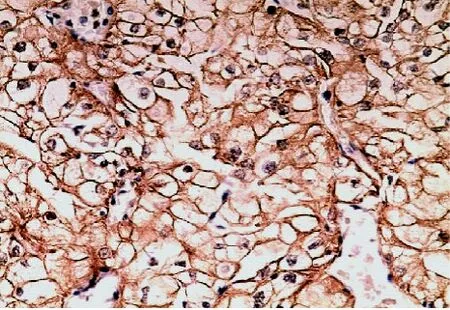
图3 CCRCC中FOXP1胞膜与胞浆同时表达(×100)

图4 CCRCC中pVHL胞浆表达(×200)
2.3 FOXP1与pVHL表达的相关性 48例CCRCC中9例胞核、胞浆同时表达,此9例CCRCC中8例pVHL阳性,其余31例FOXP1非胞核、胞浆同时表达的CCRCC中17例pVHL阳性,FOXP1胞核表达与pVHL表达具有正相关关系(r=0.594,P<0.05)。
3 讨论
FOXP1属于叉头/翼状转录因子FOX家族成员之一,其cDNA开放读码区包含677个氨基酸,由质粒pAB195cDNA序列的249~2279个核苷酸编码。据动物及体外实验等结果报道,FOXP1具有广泛的功能,从调节B细胞发育、单核细胞分化到促进心肌细胞和肺的发育[6-7]。FOXP1在不同器官中功能不同,FOXP1基因敲除会导致胚胎鼠死亡,而缺乏FOXP1表达的心肌增殖活性增加[7]。
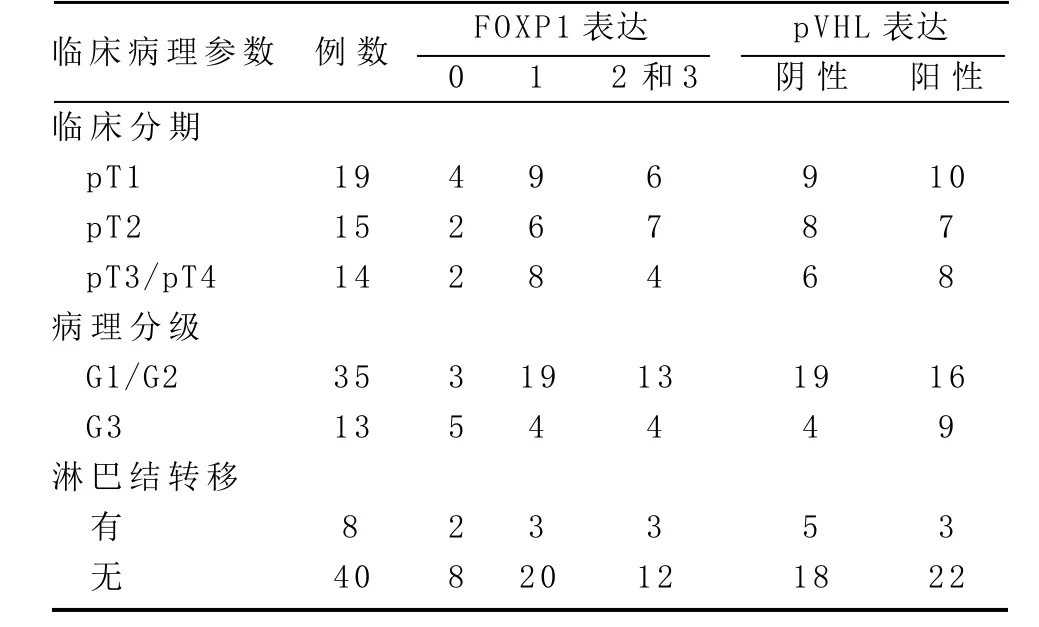
表1 FOXP1、pVHL表达与临床病理参数的关系
FOXP1在不同的组织中其蛋白表达的水平及定位也不同,如在次级淋巴滤泡中,大部分边缘区B细胞呈阳性表达,而生发中心B细胞中FOXP1蛋白的阳性表达率在10%~50%之间[7];正常肾组织近曲小管中FOXP1胞浆阳性表达,在远曲小管和集合管中胞核呈阳性表达,肾小球和细段中呈阴性或弱表达[6]。不仅如此,FOXP1在不同的肿瘤中其临床意义也不同,在弥漫大B细胞淋巴瘤中胞核过表达预示肿瘤预后较差;在MALT型淋巴瘤中胞核高表达预示肿瘤恶性转化[4];在乳腺癌中胞核表达与雌激素受体密切相关,且预示患者无瘤生存时间较长[8]。FOXP1蛋白在细胞中定位的区分化以及多种生物学功能意味着FOXP1转录因子在不同肿瘤中存在不同的调节机制。
本研究通过免疫组织化学方法检测FOXP1在48例CCRCC中的表达及定位,结果发现,其阳性表达率为83.3%,与Toma等[5]对22例CCRCC研究发现FOXP1蛋白表达率达90%的结果基本一致。FOXP1在肿瘤细胞中既有胞浆表达又有胞膜表达或胞核、胞浆同时表达,表明FOXP1参与CCRCC的发生,其蛋白定位的不同提示FOXP1在CCRCC中存在着多种发生机制。本研究还发现,FOXP1在低级别CCRCC中表达率明显高于高级别的CCRCC,表明FOXP1与CCRCC恶性程度有关。
3号染色体短臂(3p)的杂合性缺失是CCRCC常见的基因事件,研究已经发现此区存在多个肿瘤抑制基因,如VHL(3p25)、DUTTI/ROBO1(3p12-13)、FHIT(3p14.1)和FOXP1(3p14.1)等,其中VHL变异是CCRCC特征性的基因改变,多数基因的功能发挥有赖于此基因的失活[2,9],因此VHL基因被认为是“看家”基因。VHL mRNA编码的蛋白pVHL包含213个氨基酸残基,仍保留了肿瘤抑制功能。pVHL通过与elongins B、elongins C等结合形成VEC-E3泛素连接酶复合物,降解HIF-1途径抑制肿瘤生长,这一作用机制已被证实,并已应用于临床治疗。除此以外,pVHL还能促进肾细胞分化与生长,通过Mdm2途径修复DNA酶,而且在维护P53核因子的稳定,调节纤维连接蛋白基质信号,以及细胞内环境调节中起关键作用[2-3]。本实验结果显示,CCRCC中 pVHL阳性表达率为52.1%,呈胞浆和胞膜表达。而Magyarlaki等[10]报道CCRCC中pVHL阳性表达率为71.6%,多为胞膜表达,胞浆表达多见于高级别CCRCC,两者结果稍有差异。本研究发现pVHL与CCRCC的临床分期、病理分级、淋巴结转移均无关,提示pVHL异常仅在部分CCRCC形成中起关键作用。
本研究还发现9例FOXP1胞核、胞浆同时阳性的CCRCC中8例pVHL阳性。而Banham等[7]研究10例CCRCC、1例嫌色细胞癌及1例乳头状肾细胞癌,发现FOXP1阳性定位既可在胞核,也可在胞浆或两者均有,同时发现4例伴有VHL基因突变或VHL综合征的CCRCC中3例FOXP1呈胞核表达,与本研究结果类似,推测FOXP1可能单独或依赖于VHL基因的缺失或突变,调节促进CCRCC的发生发展。至于FOXP1是否如已经证实的P53肿瘤抑制蛋白的胞核运输一样[11],在pVHL调节下改变了转录方式,需做进一步探讨。
综上所述,FOXP1在CCRCC中存在高表达,可能参与肿瘤形成的早期阶段,其胞核表达与pVHL蛋白的相关性值得我们进一步探讨。
[1] Zhao H,Ljungberg B,Grankvist K,et al. Gene expression profiling predicts survival in conventional renal cell carcinoma[J].PLoS Med,2006,3(1):1549-1676 .
[2] Rathmell WK,Chen S. VHL inactivation in renal cell carcinoma: implications for diagnosis, prognosis and treatment[J]. Expert Rev Anticancer Ther,2008,8(1):63-73.
[3] Nyhan MJ, O’Sullivan GC, McKenna SL. Role of the VHL(von Hippel-Lindau) gene in renal cancer: a multifunctional tumour suppressor[J]. Biochem Soc Trans, 2008, 36(3):472-478.
[4] Banham AH, Connors JM, Brown PJ, et al. Expression of the FOXP1 transcription factor is strongly associated with inferior survival in patients with diffuse large B-cell lymphoma[J]. Clin Cancer Res,2005,11 (3):1065 -1072.
[5] Toma MI, Grosser M, Herr A, et al . Loss of heterozygosity and copy number abnormality in clear cell renal cell carcinoma discovered by high-density affymetrix 10K single nucleotide polymorphism mapping array[J]. Neoplasia, 2008,10(7):634-642.
[6] Toma MI, Weber T, Meinhardt M, et al. Expression of the Forkhead transcription factor FOXP1 is associated with tumor grade and Ki67 expression in clear cell renal cell carcinoma[J]. Cancer Invest,2011,29(2):123-129.
[7] Banham AH, Beasley N, Campo E, et al. The FOXP1 winged helix transcription factor is a novel candidate tumor suppressor gene on chromosome 3p[J].Cancer Res,2001,61 (24):8820-8829.
[8] Fox SB, Brown P, Han C, et al. Expression of the forkhead transcription factor FOXP1 is associated with estrogen receptor alpha and improved survival in primary human breast carcinomas[J]. Clin Cancer Res,2004,10(10):3521-3527.
[9] Velickovic M, Delahunt B, Storkel S, et al. VHL and FHIT locus loss of heterozygosity is common in all renal cancer morphotypes but differs in pattern and prognostic significance[J]. Cancer Res,2001,61(12):4815-4819.
[10] Magyarlaki T,Buzogany I, Nagy J, et al . Specific von Hippel-Lindau protein expression of clear cell renal cell carcinoma with “immunogenic” features[J]. Pathol Oncol Res, 2001,7(1):42-45.
[11] 许少峰,付丽. P53研究的新进展[J]. 中华病理学杂志,2004,33( 6):559-561.

