胃空肠Roux-en-Y旁路术对GK大鼠体重和血糖的影响
姜明哲,蔡景理,陈登刚,刘长宝,谢杰斌,李立军,张林君
(温州医学院附属第二医院,浙江 温州 325027,1.肛肠外科;2.普外科)
糖尿病是以糖代谢紊乱为基础的代谢性疾病,目前我国约有4000万糖尿病患者。胰岛素替代治疗疗效确切,但其需要终身治疗,往往不被大多数患者接受。20世纪80年代发现用于减重手术的胃旁路手术可以使伴2型糖尿病的肥胖患者在减重的同时糖尿病症状得到明显缓解[1-3]。如今美国已将2型糖尿病的外科治疗纳入糖尿病治疗指南,并有多篇回顾性或前瞻性研究显示,Roux-en-Y胃空肠旁路(Roux-en-Y gastric bypass,RYGB)术在确切减重的同时对2型糖尿病具有良好治疗效果[4],但该术式手术风险较高,胃空肠吻合口狭窄发生率5%~10%,吻合口溃疡发生率达1%,围手术期病死率为0.4%左右[5],并且术后可出现贫血、营养不良等远期并发症。为初步研究RYGB术对2型糖尿病的治疗效果及探讨该实验动物模型建立的可行性,我们通过GK大鼠建立RYGB实验动物模型。
1 材料和方法
1.1 动物及分组 选择体重、周龄等均无明显差异的30只SPF级雄性12周龄GK大鼠(购自上海史莱克实验动物中心),随机分为手术组(O组)10只、假手术饮食控制组(C组)10只和假手术空白对照组(B组)10只。实验大鼠进食高脂饲料及饮用高压灭菌水。
1.2 器材和试剂 无损伤止血钳(蚊式钳)、组织剪刀、线剪刀、显微外科持针器、6-0号棉线、4-0号棉线、无菌纱布若干、10%的水合氯醛、3%碘伏、5 mL和10 mL注射器、强生稳豪倍益血糖仪及血糖测试条等。
1.3 手术方法
1.3.1 O组:GK大鼠采用RYGB术。术前禁食24 h,电子秤称量体重,每只大鼠腹腔内注射浓度为10%的水合氯醛0.3 g/kg,沿上腹正中做长5 cm的纵向切口, 逐层剪开腹直肌和腹膜,充分暴露胃部。以胃小弯侧中下1/3和大弯侧上中1/3连线为界限离断,尽量清除远端及近端胃内残容物。远端胃断端连续内翻缝合,近端胃断端小弯侧连续内翻缝合。在距十二指肠悬韧带(treitz韧带)约10 cm 处切断空肠[5],远端空肠和胃大弯侧行胃空肠吻合,在距离胃空肠吻合口约10 cm 处行近端空肠和远端空肠端侧吻合。手术过程暴露肠管及胃部均用温0.9%氯化钠溶液纱布保护。均采用6-0号无创伤棉纶线连续缝合。术后用无损伤镊子尽量理顺并恢复肠管的正常解剖位置,并用庆大霉素(96万U)2 mL冲洗腹腔。麻醉苏醒后自由进水,48 h后正常进食固体饲料。整个手术过程约1.5 h。
1.3.2 假手术组:C组和B组均行空肠离断原位吻合术,术前准备、麻醉方式及手术时程均与O组相同。
1.4 观测指标及测量方法 观察O组GK大鼠的存活率,分析O组的死亡原因;观察并计算各组实验动物的每周进食量;每周应用血糖仪测量各组大鼠空腹血糖(FPG,mmol/L);实验周期内每日清晨8:00左右称量各组GK大鼠体重,观察各组实验动物的体重变化情况;各组GK大鼠分别于术前及术后第1、2个月行口服糖耐量试验(OGTT),采用50%葡萄糖溶液2 g/kg灌胃。
1.5 统计学处理方法 采用SPSS11.0软件进行分析,计量资料用±s表示。检验各组变量正态分布情况,术前各组大鼠观测指标比较应用方差分析(ANOVA),不同组别观测指标比较采用LSD-t检验;同一组别手术前后指标比较采用配对t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 存活率 O组大鼠死亡2只,存活率为80%,2只大鼠因为术后吻合口漏引起腹膜炎于术后第2~3天死亡。B组大鼠死亡1只,于术后10 d因粘连性肠梗阻死亡。C组大鼠均成活。
2.2 食物摄入量(g) 实验中C组大鼠的进食量控制和O组相同,故对B组和O组大鼠进食量进行统计学分析,两组GK大鼠术前每周进食量差异无统计学意义(P>0.05),术后O组和B组大鼠每周进食量差异均有统计学意义(P<0.05),如表1、图1。

图1 O组和B组GK大鼠进食量变化曲线图
表1 O组和B组大鼠手术后进食量比较(g,±s)

表1 O组和B组大鼠手术后进食量比较(g,±s)
与B组比:aP<0.05
组别 第1周 第2周 第3周 第4周 第5周 第6周 第7周 第8周O组 34.8±9.4a 70.4±6.8a 92.9±9.1a 111.9±9.5a 130.6±7.4a 146.5±6.5a 145.0±9.3a 143.9±8.3a B组 51.0±8.1 96.2±10.0 123.1±8.4 139.1±8.5 151.7±8.1 158.2±13.2 162.0.±9.5 162.6±11.6 n 8 9
2.3 体重(g) 3组GK大鼠术前体重差异无统计学意义(P=0.399),术后各组大鼠体重变化出现显著差异。O组大鼠于术后第1周开始体重下降,由术前体重(336.6±15.4)g下降至(288.5±18.2)g,差异有统计学意义(P=0.000),术后第6周体重(335.1±14.2)g大约升至术前水平,明显晚于其他两组。O组和C组除第1周以外,其他各时间点体重差异均有统计学意义。O组与B组各时间点体重差异均有统计学意义。见表2、图2。
表2 3组GK大鼠手术前后体重比较(g,±s)

表2 3组GK大鼠手术前后体重比较(g,±s)
与B组比:aP<0.05;与C组比:bP<0.05
组别 术前 第1周 第2周 第3周 第4周 第5周 第6周 第7周 第8周O组 336.6±15.4288.5±18.2a289.8±21.0ab 303.9±24.6ab 315.6±20.6ab 319.4±22.7ab 335.1±14.2ab 345.1±20.4ab 347.9±22.2ab C组 335.7±10.7301.9±17.5 307.7±18.5 321.8±15.3 336.4±13.3 347.5±12.3 356.4±11.2 362.2±12.4 365.8±16.6 B组 330.4±11.2317.7±13.8 318.2±11.7 349.3±11.9 358.1±14.6 364.6±17.4 372.4±17.7 375.9±14.7 379.7±13.6 n 8 1 0 9
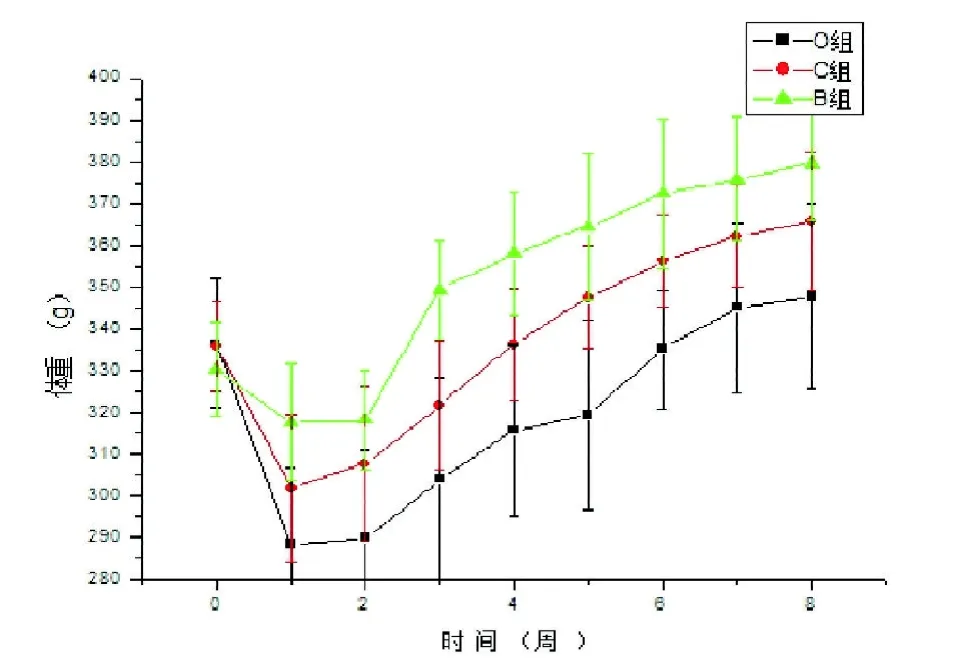
图2 3组GK大鼠手术前后体重变化曲线图
2.4 血糖(mmol/L) 3组GK大鼠术前FPG差异无统计学意义(P=0.839)。O组FPG由术前(17.6±2.1)mmol/L降至术后第1周的(7.5±0.9)mmol/L,差异有统计学意义(P<0.01)。术后1~8周,O组与B组差异均有统计学意义,O组与C组除第4周外,其他各时间点差异均有统计学意义。见图3。
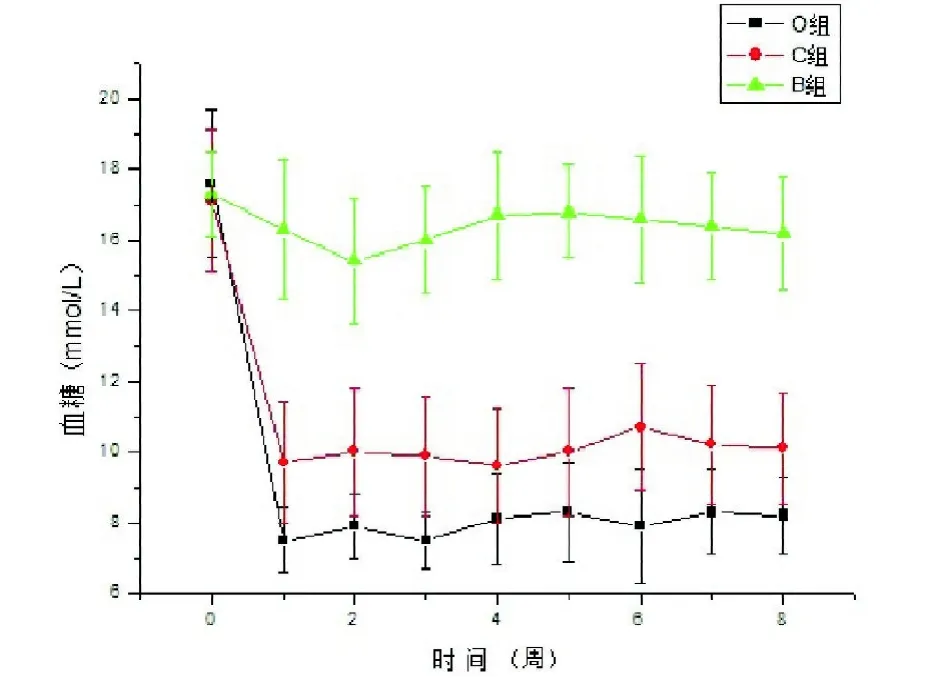
图3 3组GK大鼠手术前后FPG变化曲线图
2.5 OGTT 3组GK大鼠术前糖耐量曲线各时间点血糖值及曲线下面积(AUC)差异无统计学意义(P=0.317),O组术后1个月AUC由术前75.1±5.2下降至53.0±3.7,差异有统计学意义,与C组AUC(61.9±3.9)及B组AUC(71.9±2.9)相比较差异有统计学意义;术后2个月O组AUC与其他两组AUC差异具有统计学意义。各组大鼠术后糖耐量曲线,见图4-6。

图4 3组大鼠术前OGTT曲线

图5 3组大鼠术后1个月OGTT曲线
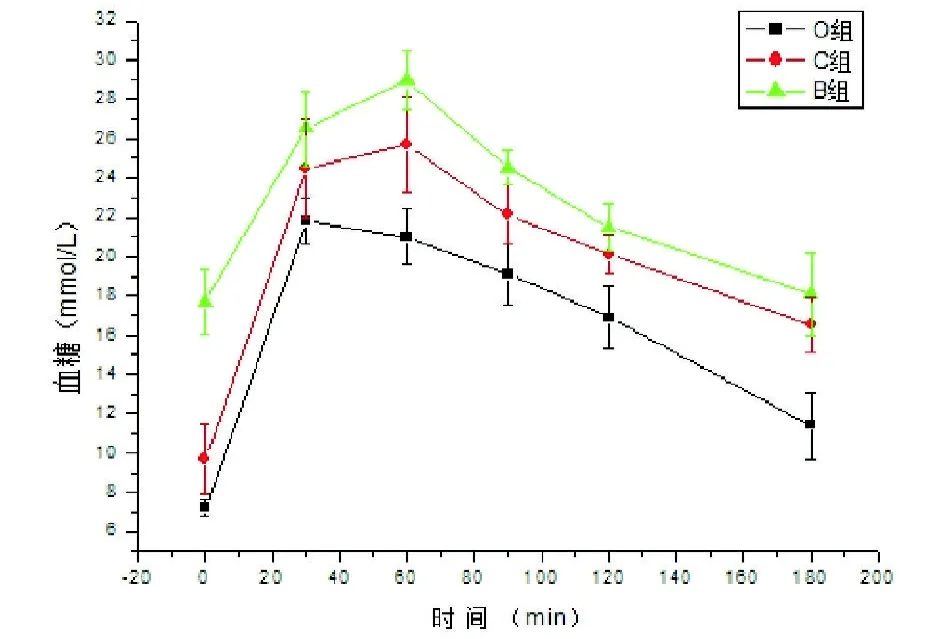
图6 3组大鼠术后2个月OGTT曲线
3 讨论
GK大鼠为自发的非肥胖2型糖尿病模型大鼠,其特征是葡萄糖刺激胰岛素分泌减少,B细胞数目减少,肝糖原生成增多等,被广泛应用于2型糖尿病的动物实验研究。本实验的目的是通过GK大鼠建立RYGB实验动物模型,并初步研究该术式对GK大鼠2型糖尿病的治疗效果。
我们在GK大鼠建立RYGB动物模型的过程中,充分地总结了SD大鼠建立RYGB动物模型的经验,取得了较高的成功率。建模过程中吻合技术是手术成功与否的关键,选用6-0丝线间断内翻吻合,针距控制在1 mm左右,可有效降低术后吻合口水肿、坏死的发生,并且吻合口漏发生的概率和连续内翻缝合无差别。另外,由于大鼠胃肠系统的解剖结构较人和其他大型实验动物更加精细,更易损伤,手术操作动作要轻柔,尽量避免肠壁及肠系膜的过度牵拉,吻合时寻找血供好的部位进行缝合。
GK大鼠经RYGB术后在给予充足饲料的基础上体重在术后2周内较其他各组下降幅度大,并在第6周后较为稳定地维持在一个水平,和术前体重相比较差异无统计学意义,O组与B组和C组相比,体重差异有统计学意义。我们的实验进一步验证了RYGB术在减重方面的疗效是肯定的。
在实验中,O组GK大鼠施行的术式为RYGB术,约保留了原有胃容积的三分之一,我们在实验过程中发现O组大鼠的进食量在术后3周左右恢复到术前水平,但FPG水平仍低于术前水平。Pacheco等[6]和Wang等[7]研究显示,RYGB术后血糖调节的改善与体重下降和进食量减少并无直接关系。近年来关于RYGB术后肠道激素分泌改变的研究显示,RYGB术后CCK、PYY(3-36)、OXM等胃肠道多肽类激素分泌的发生改变。Patriti等[8]提出RYGB术后消化道的正常解剖结构发生变化,未消化食物或消化的营养物质过早地刺激了小肠的L型细胞,从而导致GLP-1分泌增加(后肠学说);Brubcker等[9]提出GLP-1是一种肠促胰岛素,主要由末端回肠黏膜的L型细胞分泌的一种肽类激素,GLP-1的生物活性有延缓胃排空,增加胰岛素敏感性作用。RYGB术后大鼠体重明显低于B组和C组,除了和术后胃容积减少导致摄入量锐减的因素外,还与术后肠道激素分泌的改变有关,可能是GLP-1、CCK、PYY(3-36)、OXM等多肽类激素共同作用的结果。
RYGB术对GK大鼠血糖产生影响:O组大鼠在术后第1周至实验结束的第8周,空腹血糖一直维持在7~8 mmol/L左右,明显低于术前水平,与B组和C组相比差异也有统计学意义,我们考虑与RYGB术后GK大鼠胰腺beta细胞增生有关,Lin等[10]的研究也证实了此观点。3组大鼠术后1个月糖耐量曲线下面积结果为O 通过本次实验,我们认为RYGB术可以有效地减轻和控制GK大鼠体重,并可以降低血糖及改善血糖耐受。 [1] Fobi MA, Lee H, Holness R, et al. Gastric bypass operation for obesity[J]. World J Surg, 1998, 22(9):925-935. [2] PaPapielro K,Diaz E,Csendes A,et a1.Effects of gastric bypass on weight,blood glucose,serum lipid levels and artefial blood pressure in obese patients[J].Rev Med Chil,2005,133(5):511-516. [3] Torquati A,Lutfi R,Abumrad N,et a1.Is Roux-en-Y gastric bypass surgery the most effective treatment for type 2 diabetes mellitus in morbidly obese patients?[J ].J Gastrointest Surg,2005,9(8):1112-1116. [4] Ballantyne GH, Wasielewski A, Saunders JK.The Surgical treatment of type II diabetes mellitus:changes in HOMA Insulin resistance in the first year following laparoscopic Roux-en-Y gastric bypass(LRYGB)and laparoscopic adjustale gastric banding(LAGB)[J].Obes Surg , 2009,19(9):1297-1303. [5] Schauer PR, Ikramuddin S, Gourash W. Outcomes after laparoscopic Roux-en-Y gastric bypass for morbid obesity[J].Ann Surg, 2000, 232(4):515-519. [6] Pacheco D, de Luis DA, Romero A. The effects of duodenaljejunal exclusion on hormonal regulation of glucose metabolism in Goto-Kakizaki rats[J]. Am J Surg, 2007,194(2):221-224. [7] Wang Y, Zhang ZZ, Wang L,et al.Effect of diabetes control after small intestine exclusion surgery in Goto-Kakizaki rat with non-obese type 2 diabetes mellitus[J]. Zhonghua Wai Ke Za Zhi, 2009, 47(22):1736-1740. [8] Patriti A,Facchiano E,Sanna A,et a1.The enteroinsulfir axis and therecovery from type 2 diabetes after bariatric surgery[J].Obes Surg,2004,14(6):840- 848. [9] Brubaker PL.The glucagon like pept ides: pleiotropic regulators of nutrient homeost asis[J]. Ann N Y Acad Sci, 2006,1070:10-26. [10] Lin E, Liang Z, Frediani J.Improvement in β-cell function in patients with normal and hyperglycemia following Rouxen-Y gastric bypass surgery[J]. Am J Physiol Endocrinol Metab,2010,299(5):e706-e712. [11]Chambers AP, Jessen L, Ryan KK,et al.Weight-independent changes in blood glucose homeostasis after gastric bypass or vertical sleeve gastrectomy in rats[J]. Gastroenterology,2011,141(3):950-958. [12]Mingrone G, Castagneto-Gissey L.Mechanisms of early improvement/resolution of type 2 diabetes after bariatric surgery[J]. Diabetes Metab, 2009,35(6 Pt2):518-523. [13] Vilsboll T,Zdravkovic M,Le-Thi T,et al. Liraglutide, a longacting human glucagon -like peptide -1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type2 diabetes[J].Diabetes Care,2007,30(6):1608-1610.

