平阳霉素对人脐静脉内皮细胞株EA.hy926的作用及其机制
刘昭蓉,罗春芬,朱敏,於林军,范厉龙
(温州医学院附属台州医院,浙江 台州 317000,1.小儿外科;2.公共科研平台)
平阳霉素(Pingyangmycin,PYM)是一种国产抗肿瘤抗生素。自1991年郑勤田等[1]首先报道了PYM局部注射治疗各种类型的血管瘤210例有效率达100%后,国内相继有文献报道PYM用于血管瘤、淋巴管瘤及血管畸形患者的治疗,取得了较好的疗效[2-3]。PYM用于治疗血管瘤等疾病的作用机制研究不多,传统观点认为PYM进入人体后产生的氧自由基(OFR)通过干扰DNA复制这一细胞毒作用造成血管内皮细胞损伤,导致血管壁纤维增生、管壁增厚、血栓形成、管腔闭塞[4]。周卫兵等[5]通过细胞学研究发现PYM可通过促凋亡机制抑制血管内皮细胞增殖。笔者从细胞凋亡水平研究PYM对人脐静脉内皮细胞株EA.hy926的作用及其机制,以期为临床应用提供一定的理论依据。
1 材料和方法
1.1 实验材料 EA.hy926细胞株(购自美国ATCC公司);0.25%胰蛋白酶、M199细胞培养液、胎牛血清(美国Gibco BRL公司产品);MTS/PMS(北京Promega公司提供);天冬氨酸半胱氨酸蛋白酶(Caspase)-3、ActiveForm(美国BD Biosciences Pharmingen产品);人Annexin V-FITC/PI试剂盒(美国Qbiogene产品);BCA蛋白定量试剂(碧云天生物技术研究所提供);一抗Caspase-8、Caspase-9、GAPDH及二抗(美国Cell Signaling公司产品);DAB显色试剂(美国Sigma公司产品);注射用PYM粉剂(天津太和制药有限公司产品);Novel NIB-100倒置显微镜(宁波永新光学股份有限公司产品);RT6000酶标分析仪(美国Rayto公司产品);FACS Calibur流式细胞仪(美国Biosciences Cell Quest分析软件)。
1.2 实验方法
1.2.1 PYM溶液的配制:将无菌PYM粉剂预先用无菌0.9%的氯化钠溶液溶解,配制成浓缩原液(4 mg/mL)储存备用,实验前用10%血清M199培养液将原液稀释成实验所需浓度。
1.2.2 甲基三氯硅烷 (methyltrichlorosilane,MTS)比色实验:细胞经消化离心后,用培养液配制成5×104/mL浓度的EA.hy926细胞悬液,接种于2块96孔培养板中。PYM组每个浓度设4个复孔,并设对应的空白孔(不加EA.hy926细胞和PYM)和对照孔(不加PYM),每孔加入细胞悬液200μL,在倒置显微镜下观察到细胞生长至铺满孔底后,分别加入20μL不同浓度的PYM培养基溶液,使PYM终浓度为2.5、5、10、20、40、160和320μg/mL。2块板分别作用24和48 h后,每孔加入MTS 40μL,继续培养2~4 h。在酶标仪波长490 nm处测定吸光度(OD值),计算细胞生长抑制率(inhibit rate,IR)=[1-(实验组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)]×100%[6]。半数抑制浓度(IC50)采用Logit法计算,实验重复3次,求平均值。
1.2.3 细胞形态观察:每瓶接种2×105个/mL个EA.hy926细胞,培养24 h后,用 10、20、40、80、160μg/mL PYM分别处理24 h,设对照组(0μg/mL PYM),予瑞氏-吉姆萨染色,倒置显微镜下观察细胞形态并拍照。
1.2.4 流式细胞术检测:EA.hy926细胞以2×105个/mL接种6孔板,PYM分为10、20、40、80和160 μg/mL 5个浓度组,并设对照组(PYM 0μg/mL),每组设3个样本,作用24 h后,测定:①AnnexinV/FITC/PI:收集经PYM作用后的细胞,每样本取总数约为1×105的细胞,离心、洗涤后重悬于500μL PBS。取200μL细胞置于预先已加入200μL结合缓冲液的流式细胞仪专用管,加入5μL的AnnexinV/FITC避光孵育15 min,再加入5μL的碘化丙锭溶液(PI)双染色后,上机检测。②Caspase-3活性:收集各样本细胞1×105个,离心、洗涤后重悬于300 μL结合缓冲液,移入流式管,加入FITC-DEVD-FMK 1μL,37 ℃、5% CO2温箱孵育30 min~1 h,再次离心、洗涤后重悬于500μL结合缓冲液,上机检测。③罗丹明123染色测定线粒体膜电位:收集各样本细胞1×105个,离心、洗涤后0.5 mL PBS重悬,加罗丹明123 1.25μL,37 ℃水浴5 min,再次离心、洗涤后0.5 mL PBS重悬,移入流式管,上机检测。以上实验均重复4 次,求平均值。
1.2.5 免疫印迹(Western-blot)法检测:EA.hy926细胞以5×106个接种培养瓶,PYM分为20、40和80μg/mL 3个浓度组,并设对照组(0μg/mL),作用24 h之后,收集各组细胞,洗涤、离心后取沉淀,加入RIPA 100μL及PMSF 1μL混匀,冰上裂解2 h后4 ℃离心30 min,取上清,按照BCA法进行蛋白定量,参照说明书制备标准曲线,然后测定标本管吸光度值,在曲线中找出相应的浓度值,计算得出需要的上样量,使蛋白上样量一致。将40μg蛋白上样于SDS2-PAGE凝胶进行电泳,转移至PVDF膜,4 ℃下PVDF膜与一抗Caspase-8、Caspase-9(浓度均为1:500)及GAPDH(浓度为1:1000)孵育过夜,洗膜后与HRP连接的二抗(浓度均为1:3000)常温下孵育2 h,用DAB试剂按1:50配比后显色。
1.3 统计学处理方法 采用SPSS17.0统计学软件。计量资料以±s表示,采用方差分析,LSD行两两均数间的多重比较。
2 结果
2.1 PYM对EA.hy926细胞的增殖抑制作用 MTS比色检测结果显示:2.5~320μg/mL的PYM处理EA.hy926细胞24、48 h后可明显抑制细胞增殖,见表1。各浓度组间两两比较结果发现,在24 h,5μg/mL和10μg/mL、20μg/mL和40μg/mL、160μg/mL和320μg/mL组间差异无统计学意义(均P>0.05),其余各组间差异均有统计学意义(均P<0.05);在48 h,10μg/mL和20μg/mL、20μg/mL和40μg/mL、160μg/mL和320μg/mL组间差异无统计学意义(均P>0.05),其余各组间差异均有统计学意义(均P<0.05),提示PYM对EA.hy926细胞的生长抑制率与药物作用浓度有关,在低浓度即呈现明显的抑制作用,而达到160μg/mL后细胞生长大部分被抑制,抑制率进入平台期。PYM处理细胞24、48 h后,EA.hy926细胞的IC50分别为14.731μg/mL和6.894μg/mL,提示PYM抑制EA.hy926细胞生长具有浓度时间依赖性。在低浓度组(2.5μg/mL)随药物作用时间延长其抑制率明显下降(P<0.05),推测当PYM作用达到峰值后,未被抑制的细胞继续增殖,消耗了更多的PYM,使单位细胞数的作用药物减少,抑制作用随之减弱。

表1 各浓度PYM作用于EA.hy926细胞的生长抑制率(%)
2.2 PYM对EA.hy926细胞形态学的影响 采用瑞氏-吉姆萨染色,相差显微镜下观察PYM作用前、后EA.hy926细胞形态学变化,结果显示:在对照组,EA.hy926细胞呈多角形,核居中,绝大部分细胞贴壁生长呈典型的辅路石样(见图1)。在10、20μg/mL浓度下,PYM对EA.hy926细胞的作用主要表现为抑制,凋亡的形态学变化不明显;40、80μg/mL的PYM处理24 h后,EA.hy926细胞呈现典型的凋亡形态学特征,如贴壁生长的细胞数明显减少,细胞由多角形变为椭圆型或圆形、胞质空泡化、细胞核染色质浓聚、边缘化,形成环形核或新月形核、核碎裂、凋亡小体形成等(见图2-3)。当PYM浓度达160 μg/mL,则出现较多坏死细胞,细胞膜崩解,核碎裂,可见较多悬浮的细胞碎片。
2.3 PYM诱导EA.hy926细胞早期凋亡、Caspase-3活化、线粒体膜电位下降的作用 流式细胞仪检测结果显示,PYM作用EA.hy926细胞24 h的细胞早期凋亡率、活化Caspase-3表达率及线粒体膜电位下降率在各组间差异均有统计学意义(均P<0.01),随药物作用浓度增加而增高,见表2。

图1 对照组EA.hy926细胞形态(×200)

图2 40μg/mL PYM处理后EA.hy926细胞形态(×200)
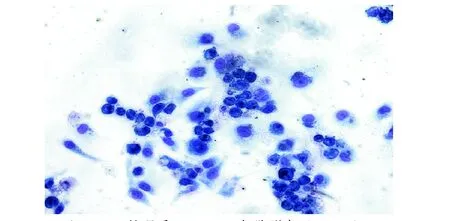
图3 80μg/mL PYM处理后EA.hy926细胞形态(×200)
表2 PYM对EA.hy926细胞早期凋亡率、活化Caspase-3表达率及线粒体膜电位下降率的影响(±s,%)

表2 PYM对EA.hy926细胞早期凋亡率、活化Caspase-3表达率及线粒体膜电位下降率的影响(±s,%)
组别 早期凋亡率 活化Caspase-3表达率 线粒体膜电位下降率对照组 4.50±0.36 0.39±0.03 7.56±0.49 10μg/mL 14.24±0.27 6.60±0.38 28.30±0.38 20μg/mL 20.83±0.60 11.58±0.54 29.72±0.34 40μg/mL 24.39±0.34 13.24±0.14 34.72±0.34 80μg/mL 27.15±0.28 18.95±0.28 37.21±0.32 160μg/mL28.48±0.47 20.89±0.26 54.24±1.31
2.4 PYM对EA.hy926细胞Caspase-8、Caspase-9蛋白表达的影响 不同浓度(0、20、40、80)μg/mL PYM作用EA.hy926细胞24 h后,Caspase-8、Caspase-9蛋白原始带随PYM浓度的增加明显下调,而激活带明显上升,对应的内参GAPDH则无明显变化,见图4。
3 讨论

图4 PYM对EA.hy926细胞的Caspase-8、Caspase-9表达的影响
多项研究已发现,PYM作为一种国产抗肿瘤抗生素,可诱导多种肿瘤细胞株发生凋亡[7-10],亦有文献报道了PYM可引起脾窦内皮细胞[11]、血管瘤内皮细胞[12]及脐静脉内皮细胞[4-5]凋亡,显示了其用于治疗血管瘤和血管畸形的独特优势。本研究以2.5~320μg/mL的PYM处理EA.hy926细胞,发现其能有效地抑制细胞增殖且呈浓度时间依赖性;形态学观察发现,PYM作用细胞后出现了典型的凋亡征象,如染色质浓聚、断裂、胞质空泡化、凋亡小体形成等。
目前认为在细胞凋亡早期,胞浆膜磷脂的不对称性丧失,使膜内侧磷脂酰丝氨酸(PS)暴露于外层,可被对PS特异的AnnexinV探针所标记。PS转位亦可发生于晚期凋亡细胞和坏死细胞,但早期凋亡细胞胞膜完整,而晚期凋亡和坏死细胞胞膜完整性被破坏,PI可对胞膜完整性被破坏的细胞染色而对胞膜完整细胞拒染,故AnnexinV结合PI行双染色时,正常活细胞不被染色,凋亡细胞可被AnnexinV标记。本研究通过AnnexinV/PI双染色法检测到PYM处理EA.hy926细胞后存在PS由细胞膜内向膜外的转位,提示,PYM对EA.hy926细胞的生长抑制作用可能是通过凋亡介导的,一定药物作用时间下的凋亡水平随药物浓度的增加而增高。
线粒体膜电位下降是细胞凋亡信号转导过程的早期事件,为凋亡的特征性改变。有研究[13]显示,线粒体膜电位的下降或消失反映了线粒体内膜的通透性增加,内膜通透性的增加使仅在线粒体内表达的细胞色素C蛋白释放到胞浆,继而发生核的凋亡改变。本实验通过罗丹明123染色检测到了PYM作用于EA.hy926细胞24 h线粒体膜电位在各浓度组呈现显著下降趋势,提示PYM可影响EA.hy926细胞的线粒体膜电位进而通过激活线粒体途径诱发细胞凋亡。
业已证实,Caspase家族引发的级联反应是细胞凋亡过程的中心环节。来自线粒体、细胞表面受体和内质网的凋亡诱导信号促发了Caspase级联反映,而这一级联信号通路被归结为线粒体途径(内源性途径)、死亡受体途径(外源性途径)和内质网途径。线粒体途径受细胞色素C的调节。Bcl-2家族蛋白等凋亡相关蛋白作用于线粒体,使细胞色素C从线粒体释放到胞浆,胞浆的细胞色素C在dATP存在的条件下结合凋亡激活因子1(Apaf-1)、procaspase-9,形成凋亡小体,并促使procaspase-9发生自我催化,被激活的Caspase-9从复合体上释放出来作为始动子去激活下游的Caspase-3,从而诱导细胞凋亡[14-15]。死亡受体途径始于Fas等细胞表面受体,Fas和配体Fasl结合后,吸引胞浆中死亡信号转录中的一个连接蛋白FADD,该蛋白又通过与procaspase-8的结合,共同形成死亡诱导信号复合物(DISC),DISC的行成可诱导procaspase-8自身激活,活化的Caspase-8则进一步激活下游的Caspase-3诱导凋亡[16]。本研究通过流式细胞术及Western-blot法检测,结果显示PYM作用于EA.hy926细胞后可引起Caspase-3、Caspase-8、Caspase-9的活化蛋白水平明显增加。周卫兵等[5]研究发现,不同浓度PYM作用脐静脉内皮细胞系24 h后,可上调 Fas蛋白表达,同时下调Bcl-2蛋白表达。因此认为,PYM作用于EA.hy926细胞可能通过线粒体途径和死亡受体途径这两条凋亡通路诱导细胞发生凋亡。该研究为目前临床上PYM用于血管瘤的治疗及促进其进一步的推广提供了一定的实验依据,对于我们开发PYM新的剂型,使其治疗血管瘤更加微创、更具有靶向性具有重要意义。
[1] 郑勤田,伍连康,容文星,等.平阳霉素局部注射治疗小儿血管瘤:附210例临床分析[J].中华外科杂志,1991,29(5):290-291.
[2] 郑家伟,陈传俊,张志愿. 平阳霉素瘤内注射治疗口腔颌面部血管瘤、血管畸形的系统评价[J].中国口腔颌面外科杂志,2003,1(2):102-105.
[3] 李杰荣,刘国度,唐华,等.B超引导下注射平阳霉素治疗婴幼儿囊性淋巴管瘤22例[J].临床小儿外科杂志,2007,6(4):37-38.
[4] 高庆红,王昌美,温玉明,等.平阳霉素局部注射对周围血管作用的实验研究[J].华西口腔医学杂志,2001,19(3):184-l87.
[5] 周卫兵,范红渠,郝鲁峰,等.平阳霉素对人脐静脉内皮细胞系ECV304的抑制作用及其机制的实验研究[J].口腔医学研究杂志,2007,23(1): 42-46.
[6] 段红钰,陈石海,刘 柳,等.内皮抑素和平阳霉素对血管内皮细胞的作用[J].中国美容医学,2010,19(12):1815-1819.
[7] 彭心昭,沈忠英,黎妙娟,等.平阳霉素诱导人类食管癌细胞EC8712凋亡的研究[J].癌症,1999,l8(6):657-660.
[8] 周芸,王津津,陈靖,等.新型平阳霉素杀伤喉癌细胞系Hep-2细胞的体外实验研究[J].耳鼻咽喉-头颈外科,2000,7(4):226-228.
[9] Tai KW, Chou MY, Hu CC,et a1.Induction of apoptosis in KB cells by Pingyangmycin[J].Oral Oncol,2000,36(2):242-247.
[10]江荣彬,梁淑贤,张丽仙,等.平阳霉素对人舌癌Tca8113 细胞凋亡和端粒酶活性的影响[J].重庆医学,2003,32(8):1040-1041.
[11] 李平,周水淼,李兆基,等.平阳霉素对大鼠脾脏组织的作用及其机制[J].第二军医大学学报,2006,27(2):178-181.
[12] 徐伟立,牛爱国,李索林,等.平阳霉素乳剂对增生期毛细血管瘤细胞凋亡的诱导[J].中华整形外科杂志,2006,22(5):362-364.
[13]Denecker G, Dooms H, Van Loo G, et al. Phosphatidyl serine exposure during apoptosis precedes release of cytochrome c and decrease in mitochondrial transmembranc potential[J].FEBS Lett,2000,465(1):47-52.
[14]Mary AB, Hu Y, Naohiro I,et a1.Expression and functional analysis of Apaf-1 isoforms[J].J Biol Chem,2000,275(12):8461-8468.
[15] 付木锋,樊廷俊.Bcl-2家族蛋白与细胞凋亡[J].生物化学与生物物理学报,2002,34(4):389-394.
[16]Micheau O, Thome M,Schneider P.et a1.The long frorn of FLIP is an activator of caspase-8 at the Fas death inducing signaling complex[J].J Biol Chem,2002,277(47):45162-45171.

