高糖环境对HBZY-1大鼠肾小球系膜细胞IL-18、TGF-β1表达的影响
潘晓燕,龚小花,杨丽娟,沈飞霞
(温州医学院附属第一医院 内分泌科,浙江 温州 325000)
近年来,2型糖尿病的发病率明显增加,其危害性主要表现在慢性并发症导致的高致死率、高致残率[1]。糖尿病肾病(diabetic nephropathy,DN)是其典型的微血管并发症之一。研究表明,由DN造成的肾功能衰竭比非糖尿病患者高17倍,是糖尿病患者主要死亡原因之一,因此DN的防治工作关系重大。
近年有研究证实炎症递质在DN病理发展中扮演着重要角色。白细胞介素18(IL-18)是IL-1细胞因子家族的成员,主要由活化的单核巨噬细胞产生,其他组织细胞也广泛表达,在免疫调节以及多种免疫相关性疾病的发生、发展、转归中都起着重要作用[2]。最近研究发现,早期DN患者血浆IL-18显著升高,且高水平IL-18能加重DN动物模型肾功能的衰竭,这提示IL-18很可能是启动DN患者肾功能走向衰竭的早期关键环节之一[3-6]。DN肾组织中转化生长因子β1(TGF-β1)高表达是DN肾功能恶化的经典途径之一。然而,DN肾组织中TGF-β1升高的原因仍不完全清楚。研究表明IL-18能通过与IL-18受体的结合激活NF-κB信号转导途径诱导TH1细胞产生IFN-γ、IL-2等细胞因子。在此基础上,本研究以IL-18作为DN抗感染治疗的靶点,选择肾小球系膜细胞(mesangial cells,MCs)作为研究的靶细胞进行研究,观察高糖环境下IL-18和TGF-β1的表达及两者的相互关系,并阻断IL-18观察TGF-β1的表达变化。
1 材料和方法
1.1 材料 大鼠肾小球系膜细胞系(HBZY-1,中国典型培养物保藏中心),葡萄糖(Sigma),IL-18抗体(Santa cruz),TGF-β1抗体(Abcam),二抗(CST),倒置显微镜(Leica),荧光定量PCR仪(Roche 480)。
1.2 方法 肾小球系膜细胞加入ATCC完全生长培养液(含3×105U/L青霉素、100 mg/L链霉素及10%灭活小牛血清),置于37 ℃、5% CO2浓度、体积分数为0.05的饱和湿度培养箱中,每日换液1次,3~4 d传代1次。
1.2.1 实验分组:取对数生长期的系膜细胞进行分组实验:①正常糖组(NG组): ATCC培养液中加入葡萄糖(终浓度5.5 mmol/L);②高糖组(HG组):在培养液中加入葡萄糖(终浓度25 mmol/L);③IL-18正常糖组(IL-18/NG组):在培养液中分别加入四个不同浓度IL-18[1 ng/dL(IL-18/NG-1组)、10 ng/dL(IL-18/NG-2组)、50 ng/dL(IL-18/NG-3组)、100 ng/dL(IL-18/NG-4组)]+葡萄糖浓度5.5 mmol/L;Con/NG-O组培养液中未加入IL-18,作为对照组。④IL-18高糖组(IL-18/HG组):在培养液中分别加入四个不同浓度IL-18[1 ng/dL(IL-18/HG-1组)、10 ng/dL(IL-18/HG-2组)、50 ng/dL(IL-18/HG-3组)、100 ng/dL(IL-18/HG-4组)]+高糖(25 mmol/L);Con/HG-O组培养液中未加入IL-18,作为对照组。⑤IL-18抗体-正常糖组(IL-18Ab/NG组):在培养液中加入IL-18 Ab 100 g/dL+葡萄糖浓度5.5 mmol/L;⑥IL-18抗体-高糖组(IL-18Ab/HG组):在培养液中加入IL-18 Ab 100 g/dL+葡萄糖浓度25 mmol/L。通过IL-18抗体拮抗IL-18来阻断TGF-β1的表达。系膜细胞以每孔2×105个细胞数接种到6孔培养板,每组设3个复孔(n=3)。
1.2.2 荧光定量PCR检测IL-18和TGF-β1 mRNA的表达:每孔弃培养液,按说明书Trizol法提取细胞总RNA,用Oligo(dT)18进行逆转录制备cDNA。按照说明书使用胶回收法纯化DNA片段作为标准品。用SYBR Green I荧光嵌合法在Rea1-time的PCR仪上进行荧光定量PCR检测。选取β-actin为内参照。引物序列如下β-actin:上游5’-GTAAAGACCTCTATGC CAACA-3’,下游5’-GGACTCATCGTACTCCTGCT-3’;IL-18:上游5’-CAACCGCAGTAATACGGAGCAT-3’,下游5’-TCTGGGATTCGTTGGCTGTT-3’;TGF-β1:上游5’-ACCTTGG TAACCGGCTGC-3’,下游5’- TCCTTGGTTCAGCCACTGC-3’。反应条件如下:94 ℃预变性2 min;然后进行94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸90 s,共35个循环;最后72 ℃延长7 min,2次,在延伸的过程中收集荧光信号,扩增结束后收集溶解曲线。采用标准曲线法计算mRNA的相对表达量。IL-18 mRNA相对表达量/β-actin mRNA相对表达量和TGF-β1 mRNA相对表达量/β-actinm RNA相对表达量分别为为IL-18和TGF-β1的mRNA表达量校正值。每个样本均设3个复孔。
1.3 统计学处理方法 采用SPSS16.0统计软件进行分析。各组数据均以±s表示。多组间差异比较采用单因素方差分析,组内两两比较方差齐者采用SNK法,方差不齐者采用Games-Howell法。P<0.05为差异有统计学意义。
2 结果
2.1 高糖对IL-18、TGF-β1水平的影响 IL-18 mRNA表达量NG组为1.06±0.47,HG组为8.75±0.34;TGF-β1 mRNA表达量NG组为1.03±0.31,HG组为7.23±1.18,与NG组比较,HG组IL-18、TGF-β1 mRNA表达均增强,差异有统计学意义(P<0.01)。
表1 TGF-β1 mRNA在不同浓度IL-18条件下的表达(±s)
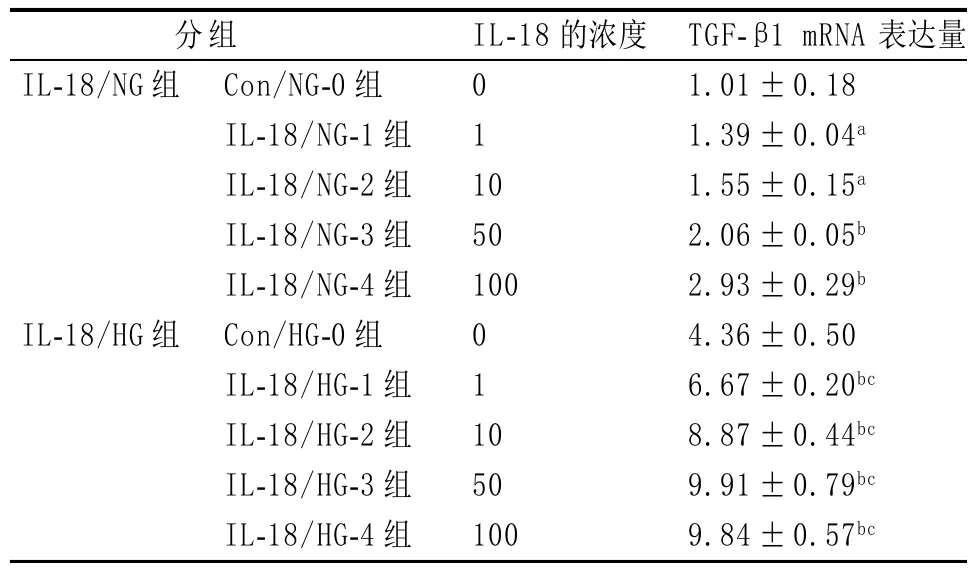
表1 TGF-β1 mRNA在不同浓度IL-18条件下的表达(±s)
与Con/NG-O组、Con/HG-O组比:aP<0.05;bP<0.01;HG同浓度各组与NG各组比:cP<0.01
分组IL-18的浓度IL-18/NG组0 1 1 0 50 100 IL-18/HG组Con/NG-0组IL-18/NG-1组IL-18/NG-2组IL-18/NG-3组IL-18/NG-4组Con/HG-0组IL-18/HG-1组IL-18/HG-2组IL-18/HG-3组IL-18/HG-4组0 1 1 0 50 100 TGF-β1 mRNA 表达量1.01±0.18 1.39±0.04a 1.55±0.15a 2.06±0.05b 2.93±0.29b 4.36±0.50 6.67±0.20bc 8.87±0.44bc 9.91±0.79bc 9.84±0.57bc
2.2 IL-18对TGF-β1水平的影响 相同浓度IL-18条件下,IL-18/HG组TGF-β1 mRNA的表达水平均高于IL-18/NG组;TGF-β1 mRNA表达随IL-18浓度增高而增加。TGF-β1表达升高依赖于IL-18,且有剂量依赖性。具体见表1。
2.3 IL-18对TGF-β1水平的影响 在NG组和HG组,分别加入100μg/dL的IL-18 Ab,结果表明在髙糖情况下通过IL-18抗体拮抗IL-18可抑制TGF-β1的表达(P<0.01)。具体见表2。
表2 TGF-β1 mRNA在阻断IL-18后的表达(±s)

表2 TGF-β1 mRNA在阻断IL-18后的表达(±s)
与NG组比:aP<0.01;与HG组比:bP<0.01
分组 药物和浓度TGF-β1 mRNA的表达量
3 讨论
DN的发病机制目前仍不十分清楚,除传统的代谢和血流动力学因素对肾脏的损伤外,目前认为免疫和炎症递质在DN病理发展中扮演着重要角色[2]。最近研究发现,早期DN患者血浆IL-18显著升高,且高水平IL-18能加重DN动物模型肾功能的衰竭,这提示IL-18很可能是启动DN肾功能走向衰竭的早期关键环节之一。本研究以大鼠肾小球系膜细胞为对象,研究高糖环境下IL-18与TGF-β1表达及其相互关系,探讨IL-18在DN肾功能衰竭疾病机制中的作用及意义。
IL-18是IL-1细胞因子家族的成员,它的结构与IL-1β相似,但它在炎症和免疫调节过程中具有不同于IL-1β的特性[7]。最近研究发现,DN患者血和尿IL-18水平升高,且高水平IL-18与低肾脏功能显著相关;此外,糖尿病患者即使在正常尿蛋白期,其IL-18浓度较对照组亦明显升高,且高水平IL-18与肾小球滤过率下降显著相关[3-6];动物实验发现,每日注射IL-18,使非糖尿病动物体内IL-18升高,其尿蛋白排泄率显著升高,而预先注射IL-18保护性抗体,IL-18升高尿蛋白排泄率的作用消失[8]。由此可见,IL-18在早期DN患者体内显著升高,且IL-18很可能是启动DN肾功能走向衰竭的早期关键靶点。本研究发现高糖可以导致IL-18和炎症因子TGF-β1表达升高,证实了IL-18与高糖导致的肾小球系膜细胞炎症及损伤有关,但是IL-18是作为调节因子还是效应因子发挥作用,目前仍不清楚,探讨其具体的作用机制有助于进一步了解DN炎症持续的免疫学机制,为寻找新的治疗策略带来新的思路。
DN的病理改变是肾小球细胞外基质进行性积聚,基底膜增厚,滤过面积减少,肾小球进行性纤维化,最终可导致终末期肾病。DN肾组织中TGF-β1高表达是DN肾功能恶化的经典途径之一。TGF-β1刺激细胞外基质的合成,诱使MCs的硬化,加速血浆蛋白从肾小球基底膜漏出到包氏囊,诱导下游肾小管区域促炎和促纤维化的损伤,从而介导肾小管的纤维化和萎缩[9]。然而,DN肾组织中TGF-β1升高的原因仍不完全清楚。既往研究表明,血流动力学因素、高糖环境、糖基化终末产物、糖基化终末产物受体上调是DN肾组织TGF-β1表达增加的重要原因,但是,纠正DN患者血液循环及降低血糖并不能有效降低DN肾组织TGF-β1表达,亦不能阻止DN的进一步恶化。因此高糖并不是导致TGF-β1表达增高的直接原因。本研究建立在大鼠系膜细胞体外培养的基础上,观察高糖对系膜细胞的IL-18和TGF-β1 mRNA表达的影响。结果显示,高糖条件下不仅IL-18、TGF-β1表达均升高,并且TGF-β1表达升高依赖于IL-18的升高,两者存在剂量依赖性;通过IL-18 Ab阻断IL-18发现可以抑制TGF-β1的表达。由此我们推测在HBZY-1中,IL-18可以发挥调节因子作用,是TGF-β1的上游调控因子,对上调TGF-β1的表达有重要作用。因此通过IL-18抗体拮抗IL-18来阻断TGF-β1的表达,可以防止或减少DN炎症启动,进而有助于阻止DN的发生,是防治DN的有意义的新靶点。目前已有研究表明IL-18能通过与IL-18受体的结合激活核因子κB(nuclear factor-κB,NF-κB)信号转导途径诱导TH1细胞产生IFN-γ、IL-2等细胞因子;基于此研究结果,本课题组将继续对IL-18与TGF-β1的信号通路及胞内途径及其蛋白表达作进一步深入研究。
综上所述,本研究显示高糖可以导致IL-18表达升高,IL-18可以诱导肾小球系膜细胞TGF-β1高表达,启动DN肾脏炎症。该结果进一步阐明了DN炎症启动及进展的免疫学机制,为IL-18抗体治疗DN提供理论依据,为DN防治策略提供新的思路。
[1] Wilson JD, Foster DW, Kronenberg HM,et al. Williams textbook of endocrinology[M].北京:科学出版社,2001:973-1059.
[2] 任莉莉,李富荣. IL-18在免疫相关性疾病发病机制中的意义[J]. 广东医学, 2004,15(1):99-101.
[3] 吴朝明,王靓,潘优津,等.血清白介素-18与2型糖尿病肾病的相关性研究[J].浙江医学,2009,31(9):1202-1204.
[4] Araki S, Haneda M, Koya D, et al. Predictive impact of elevated serum levels of IL-18 for early renal dysfunction in type 2 diabetes:an observational follow-up study[J].Diabetologia,2007,50(4):867-873.
[5] Nakamura A, Shikata K, Hiramatsu M,et al.Serum interleukin-18 levels are associated with nephropathy and atherosclerosis Japanese patients with type 2 diabetes[J].Diabetes Care,2005,28(12):2890-2895.
[6] Miyauchi K,Takiyama Y,Honjyo J. Upregulated IL-18 expression in type 2 diabetic subjects with nephropathy[J].Diabetes ReS Clin Pract,2009,83(2):190-199.
[7] Navarro-Gonzalez JF, Mora-Fernandez C.The role of inflammatory cytokines in diabetic nephropathy[J]. J Am Soc Nephrol,2008,19(3):433-442.
[8] Dinarello CA.Interleukin-18 and the pathogenesis of inflammatory diseases[J].Semin Nephrol, 2007, 27(1):98-114.
[9] Brosius FC 3rd. New insights into the mechanisms of fibrosis and sclerosis in diabetic nephropathy[J]. Rev End ocr Metab Disord,2008,9(4):245-254.

