大鼠出生后早期心肌细胞有丝分裂指数检测及细胞周期进程相关基因的表达
旷文安,黄伟聪,王珏,杨凯,郑哲,孙成超
(1.温州医学院附属第一医院 心胸外科,浙江 温州 325000;2.北京阜外心血管病医院 卫生部再生医学重点实验室,北京 100037)
最新的实验研究表明,哺乳动物心脏在出生后早期存在心肌细胞的分裂增殖[1],而对于成熟的心肌细胞,在特定的条件下仍然可以被诱导重新进入细胞周期,并以增生性生长为主的方式改善心脏功能[2]。心肌细胞的增殖依赖于心肌细胞的有丝分裂,Ccnd1、Ccna2、Ccnb1、Cdc2、CDk2、Cdk4、Cdkn1a和Cdkn1b等细胞周期进程相关基因的表达与心肌细胞的有丝分裂密切相关[3-4]。组蛋白H3的磷酸化贯穿于有丝分裂分裂期(M期)的各个时相[5],是目前标记细胞有丝分裂的最佳指标之一,且广泛用于心肌细胞的增殖研究中[1,6]。本实验应用RT-PCR的方法定量检测细胞周期相关基因在大鼠出生后早期不同时间点的表达情况,并以磷酸化组蛋白3(H3p)和肌钙蛋白T(cTnt)双重免疫荧光染色各时间点的心室肌组织,检测其有丝分裂指数,在细胞和组织水平共同研究大鼠出生后早期心肌细胞的增殖情况。
1 材料和方法
1.1 实验动物 出生后第1、4、7、10、14天的SD大鼠由温州医学院实验动物中心提供,研究经温州医学院实验动物伦理委员会批准。
1.2 主要试剂 DMEM培养基、PBS、青链双抗、胰蛋白酶(北京四环生物有限公司),胎牛血清FBS(美国Gibco公司),H3p小鼠IgG单克隆抗体(美国millipore公司),cTnt抗体(英国Abcam公司),DAPI染色剂(北京中杉金桥生物技术有限公司),逆转录试剂盒PromegaA3500(美国Promega公司),引物设计与合成(北京六合通生物技术公司):Gapdh(F:5’-GGCACAGTCAAGGCTGAGAATG-3’,R:5’-ATGGTGG TGAAGACGCCAGTA-3’);Ccnd1(F:5’-TACCGCACAACGCA CTTTC-3’,R:5’-AAGGGCTTCAATCTGTTCCTG-3’);Ccna2(F:5’-GCCATCGCTTATTGCTGGAG-3’,R:5’-CTTTGAGGTAGGTCTGGTGAAGGTC-3’);Ccnb1(F:5’-GGTGGAACTGGATGAGCCTGA-3’,R:5’-TGTTTCCATTGGGC TTGGAGA-3’);Cdk1(F:5’-TCCCTGCAGGACTACAAGAA CAC-3’,R:5’-GATTCGTTTGGCTGGATCATAGAC-3’);Cdk2(F:5’-CCTGCACCAGGACC TCAAGAA-3’,R:5’-CGGTGAGAATGGCAGAATGCTA-3’);Cdk4(F:5’-TAAAGGGCCACCTCCGCAGC-3’,R:5’-AAAGGCAGCCCCTCT CCTCACT-3’);Cdkn1a(F:5’-CACGGCTCAGTGGACCAG AA-3’,R:5’-ACTGGAGCTGCCTGAGGTAGGA-3’);Cdkn1b(F:5’-CGAATGCTGGCACTGTGGA-3’,R:5’-CATTCAAT GGAGTCAGCGATATGTA-3’)。
1.3 主要仪器设备 细胞培养超净台GB-II(北京长城空气净化设备公司),CO2恒温细胞培养箱(美国Thermo公司),realtime-PCR仪7300(美国AB公司),荧光显微镜及图像采集系统(日本Olympus公司)。
1.4 实验方法
1.4.1 原代心肌细胞分离与纯化:无菌条件下开胸取出生后第1、4、7、10、14天的大鼠心脏,PBS冲洗残留血渍,剪碎心室肌组织,约1 mm3,然后用事先配好的消化液(trypsin 0.080%,Nacl 0.801%,Kcl 0.030%,NaHCO30.035%,Glucose·H2O 0.099%,pH 7.4)消化约12~16次(37 ℃,8 min/次)。将消化的细胞悬液离心后,加入含10% FBS的DMEM培养基在37 ℃,5% CO2培养箱中培养70 min后,收集细胞悬液再次离心后,加入含10% FBS和1% Brdu的DMEM培养基在37 ℃,5% CO2培养箱中培养16 h,离心收集心肌细胞并加入Trizol试剂,-80 ℃保存。
1.4.2 心肌细胞RNA提取及qRT-PCR定量检测:收集大鼠的原代心肌细胞,Trizol法提取总RNA,Sbyegreen法逆转录cDNA后在realtime-PCR仪7300上行定量PCR,以GAPDH为内参,利用2-ΔΔCt方法计算不同时间点心肌细胞Ccnd1、Cdk1和Cdkn1a等基因的mRNA表达水平。
1.4.3 心室肌组织免疫荧光双重染色:开胸取出生后第1、4、7、10、14天的大鼠心脏,PBS冲洗残留血渍,10%的中性甲醛液固定,制备石蜡切片,脱蜡脱水后,孵育H3p抗体(1:100)、cTnt抗体(1:1000)及二抗显色,DAPI显示细胞核。
1.4.4 荧光显微镜观察并拍照:应用Olympus BX61正置荧光显微镜,在400倍视野分别观察激发波长480 nm下H3P的表达,紫外光区DAPI的细胞核染色,以及在激发波长560 nm处观察cTnt的表达,通过分析软件拍照,并将三者图像通过3D叠加以确定三者共表达的细胞。每个时间点8张切片,每张切片随机拍下10个视野。
1.4.5 细胞计数:ImageJ软件计数每个400倍视野中H3P-cTnt-DAPI共表达细胞数与总心肌细胞数,二者的比值,即为心肌细胞的有丝分裂指数(mitotic index,MI)。
2 结果
2.1 大鼠出生后早期不同时间点的心肌细胞有丝分裂指数 通过对大鼠生后第1、4、7、10、14天心室肌组织H3P(绿色)-cTnt(红色)-DAPI(蓝色)的多重免疫荧光染色(见图1),我们可以清晰分辨出心肌细胞的有丝分裂相。数据统计显示(见图2):出生后第1、4、7、10天大鼠心室肌组织MI分别为1.884%±0.118%、2.744%±0.183%、1.025%±0.053%和0.086%±0.012%。出生后第4天时心肌细胞有丝分裂指数出现峰值,约为第1天时的1.5倍(P<0.05),第10天时,有丝分裂指数急剧下降,仅为第4天时的0.03倍(P<0.05),出生后第14天的大鼠心脏却未发现有丝分裂的心肌细胞。

图1 大鼠出生后不同时间点心肌组织的双重免疫荧光染色(×400)
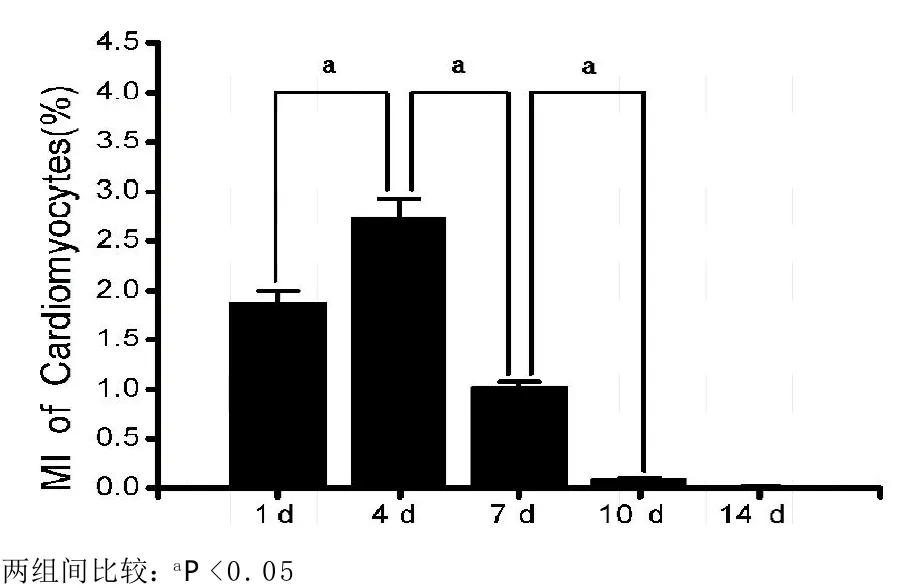
图2 大鼠出生后第1、4、7、10、14天时心肌细胞有丝分裂指数
2.2 大鼠出生后不同时间点的心肌细胞周期相关基因的mRNA表达水平 qRT-PCR法检测出生后第1、4、7、10、14天SD大鼠心肌细胞中细胞周期进程相关基因的mRNA表达水平,数据显示:出生后第4天心肌细胞Ccnd1、Ccna2、Ccnb1、Cdk1、CDk2和Cdk4出现表达高峰,然而在出生后第10天的心肌细胞中表达急剧下降,出生后第14天表达水平更低,而Cdkn1a、Cdkn1b的表达水平随着大鼠日龄的增加呈递增趋势(见图3)。
3 讨论
心肌细胞的分裂增殖源于有丝分裂的完成,H3p是目前研究心肌细胞有丝分裂增殖的最佳标志之一。通过对心肌细胞有丝分裂指数的检测,我们发现大鼠出生后第4天时,细胞有丝分裂指数到达峰值,之后第10天时则急剧下降,直至第14天时检测不到。综上结果,我们认为出生后第4天和第10天是大鼠心肌细胞增殖的拐点。Soonpaa等[7]研究认为小鼠出生后4~6 d心肌细胞DNA的合成高峰与心肌细胞的双核化一致,并推测此时只有心肌细胞核分裂而没有胞质分裂。但最近Porrello等[1]研究却发现小鼠在出生后7 d心肌细胞仍具有完成胞质分裂的增殖能力。这种差异的存在可能源于各自研究手段和研究水平的不同,同时提示我们:出生后第4天有丝分裂指数峰值的出现与大部分心肌细胞的双核化和多核化有关,但也不能排除有小部分完成了之后的胞质分裂,真正实现了心肌细胞的分裂增殖。出生后第10天大鼠心室肌细胞有丝分裂趋于停滞,第14天检测不到,说明出生第10天后,大鼠心肌细胞逐渐丧失了分裂增殖能力。
心肌细胞的有丝分裂过程可分为G0、G1、S、G2和M期。G0/G1和G2/M是有丝分裂能否顺利进行的两个重要检查点。有实验[8-10]证明Ccnd1、Ccna2、Ccnb1基因产物CyclinD1、CyclinA2、CyclinB1和Cdk1、Cdk2、Cdk4等是细胞有丝分裂G0/G1、G2/M检查点时相转换最为重要的促进因子,而Cdkn1a、Cdkn1b基因产物p21、p27则是该时相转换的重要阻滞因子[4]。

图3 大鼠出生后第1、4、7、10、14天时心肌细胞周期相关基因的mRNA表达水平
Cyclind1/Cdk4复合物通过磷酸化Rb蛋白,解除其对E2F的结合抑制,活化的E2F可激活下游与S期相关的DNA聚合酶II、胸苷激酶的表达[8]。CyclinA2/Cdk2可促进复制前复合物的形成,启动DNA的合成,是S期进行的关键。CyclinB1/Cdk1活性的逐渐增强被证实是协调有丝分裂进程的关键[10]。实验发现上述Cyclins/Cdks的mRNA表达水平呈现先上升后下降趋势(见图3),出生后第4天的大鼠心肌细胞Ccnd1、Ccna2、Ccnb1、Cdk1、Cdk2和Cdk4出现表达高峰,在出生后第10天表达迅速下降,第14天表达更低,这种表达趋势的变化与心肌细胞有丝分裂指数变化趋势基本一致。Li等[11]认为出生后第4天时细胞周期进程相关基因出现表达高峰与心肌细胞的多核化及肥大性生长有关。Tamamori等[12]研究认为Ccnd1及Cdk4的高水平表达与心肌细胞的增生性生长有关,而我们的实验也显示在大鼠出生后第4~7天的心肌细胞中Ccnd1及Cdk4的表达水平都比较高。
心肌细胞分裂增殖能力的丧失与Cdkn1a、Cdkn1b的表达升高相关[9]。Stefano等[13]发现敲除Cdkn1a、Cdkn1b基因可促进胞浆分裂的完成,实现心肌细胞的分裂增殖。Poolman等[4]认为Cdkn1a、Cdkn1b基因的表达是心肌细胞退去细胞周期,维持G0/G1和G2/M阻滞的关键所在。我们的实验发现,Cdkn1a、Cdkn1b的mRNA表达水平随大鼠日龄的增加呈现上升趋势,且在第14天时,表达尤为明显。Cdkn1a、Cdkn1b表达水平的升高增强了对Cyclin/CDKs活性的抑制,从而导致心肌细胞退出细胞周期,阻碍心肌细胞增殖,这与Stefano[13]和Poolman等[4]的研究结果相吻合。
心肌细胞的增殖是个多基因、多水平、极其复杂的调控过程,细胞周期的退出和增殖能力的丧失必然伴随着相关基因和蛋白表达的上调或下降。通过各种手段检测并筛选这一过程中的决定性指标将有助于阐明心肌细胞退出细胞周期的调控机制,从而找到促进心肌细胞增殖的靶点,是我们今后研究的方向。
[1] Porrello ER, Mahmoud AI, Simpson E,et al. Transient regenerative potential of the neonatal mouse heart[J].Science,2011,331(6020):1078-1080.
[2] Bersell K, Arab S, Haring B, et al. Neuregulin1/ErbB4 signaling induces cardiomyocyte proliferation and repair of heart injury[J].Cell,2009,138(2):257-270.
[3] Kang MJ, Kim JS, Chae SW,et al. Cyclins and cyclin dependent kinases during cardiac development[J]. Mol Cells, 1997,7(3):360-366.
[4] Poolman RA, Gilchrist R, Brooks G. Cell cycle profiles and expressions of p21CIP1 AND P27KIP1 during myocyte development[J].Int J Cardiol,1998,67(2):133-142.
[5] Hans F,Dimitrov S. Histone H3 phosphorylation and cell division[J].Oncogene, 2001, 20(24):3021-3027.
[6] Jopling C, Sleep E, Raya M,et al. Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation[J]. Nature,2010,464(7288):606-609.
[7] Soonpaa MH, Kim KK, Pajak L,et al. Cardiomyocyte DNA synthesis and binucleation during murine development[J].Am J Physiol,1996,271(5 Pt 2):H2183-2189.
[8] Weinberg RA.The retinoblastoma protein and cell cycle control[J].Cell.1995,81(3):323-330.
[9] Ahuja P, Sdek P, MacLellan WR. Cardiac myocyte cell cycle control in development, disease, and regeneration[J]. Physiol Rev,2007,87(2):521-544.
[10]Lindqvist A, van Zon W, Karlsson Rosenthal C,et al. Cyclin B1-Cdk1 activation continues after centrosome separation to control mitotic progression[J]. PLoS Biol,2007,5(5):e123.
[11]Li F, Wang X, Capasso JM, et al. Rapid transition of cardiac myocytes from hyperplasia to hypertrophy during postnatal development[J].J Mol Cell Cardiol,1996,28(8):1737-1746.
[12]Tamamori-Adachi M, Ito H, Nobori K, et al. Expression of cyclin D1 and CDK4 causes hypertrophic growth of cardiomyocytes in culture: a possible implication for cardiac hypertrophy[J]. Biochem Biophys Res Commun,2002,296(2):274-280.
[13]Di Stefano V, Giacca M, Capogrossi MC,et al. Knockdown of cyclin-dependent kinase inhibitors induces cardiomyocyte re-entry in the cell cycle[J]. J Biol Chem,2011,286(10):8644-8654.

