大鼠肺成纤维细胞的体外培养及急性炎症模型的建立
朱天琦,郑声星
(1.温州医学院附属第一医院 麻醉科,浙江 温州 325000;2.温州医学院附属第二医院 麻醉科,浙江 温州 325027)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是临床常见危重病,其病死率极高,大约在40%~70%,由内毒素血症引起的ARDS极为常见。成纤维细胞作为间质的主要成分,其对炎症的成功消退过程起到了重要的作用。而在体外培养成纤维细胞并建立其急性炎症模型是研究成纤维细胞在ARDS过程中促炎症消退作用的重要方法之一。本研究用不同剂量的脂多糖(lipopolysaccharide,LPS)刺激体外培养的肺成纤维细胞(lung fiibroblasts,LF),并在不同时间点通过细胞毒性检测来评价内毒素性细胞的损伤程度,旨在建立合理的体外细胞ARDS模型。
1 材料和方法
1.1 动物 SPF级健康Sprague Dawley(SD)雄性大鼠60只,体质量120~150 g,平均(132±10)g由同济医学院实验动物中心提供(医动字第19-025号)。
1.2 主要试剂 内毒素(LPS,E.coil serotype 055:B5),细胞增殖/毒性检测试剂(MTT)为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,购自美国sigma公司。用超纯水溶解的H-DMEM的培养基(Gibco公司),消化液:0.25%胰蛋白酶(Sigma公司)。抗波形蛋白(vimentin)单克隆抗体和CD31单克隆抗体,均购自abcam公司。
1.3 LF的分离、培养 参照Tamm等[1]的组织贴壁方法并进行改良,大鼠称重,腹腔注射2%戊巴比妥钠80 mg/kg麻醉,仰卧位固定。沿腹中线剪开皮肤、皮下组织,暴露腹腔,切断腹主动脉放血,剪掉横膈膜,暴露胸腔,截取胸骨,小心折断肋骨,摘除胸腺,最大限度地暴露心脏及大血管,从右心室插入套管至肺动脉,用D-Hanks液灌洗至肺明显发白,完整地取出心肺气管,除去心脏和大气道,置于放有预冷的D-Hanks(青霉素100 IU/mL、链霉素100 IU/mL)的无菌培养皿中,反复用预冷的D-Hanks液冲洗,用小剪刀将肺组织剪碎(<1 mm3) ,移至10 mL离心管中, 静置5 min后,吸去D-Hanks液后加入0.25%胰蛋白酶(37 ℃预温)5 mL,用吸管反复吹打1.5 min,加入含15%新生牛血清(NBS)的H-DMEM培养液终止消化,用吸管吹打均匀,1000 r/min离心5 min,弃上清,再加入少量15% NBS HDMEM悬浮组织块,加入培养液以不飘起组织块为宜。每只大鼠肺可接种一个25 mL的培养瓶。37 ℃、5%CO2培养箱培养,24 h补加培养液后继续培养,72 h换液。4 d细胞接近融合时,弃去培养液,D-Hanks液轻洗3次,加入0.25%胰酶消化1 min,用含15%NBS的H-DMEM培养液终止消化, 吸管轻轻吹打细胞,收集细胞悬液, 1000 r/min离心2 min,弃上清,用15% NBS的H-DMEM培养液,按1:2接种传代,40 min后换培养液(差速贴壁法)。LF细胞采用HE染色。
1.4 免疫荧光鉴定 将传代的LF消化制成单个细胞悬液,计数细胞,调整细胞密度为1×104/mL,接种于6孔板内(孔内有预先置有多聚赖氨酸涂布的盖玻片),37 ℃、5% CO2培养箱常规培养。当细胞铺满盖玻片时,取出盖玻片,4%多聚甲醛固定30 min,PBS洗3次,含0.2% Triton的PBS洗两次,再PBS洗两次,5% BSA封闭40 min(室温),保持湿度,抗孵育过夜(4 ℃)。次日用PBS洗3次,每次5 min,加二抗(避光)室温孵育1 h,PBS洗7次,每次5 min,Hoechest复染核12 min,PBS洗1次,检测 LF vimentin和CD31的表达。
1.5 MTT 将分离纯化的LF用含15% NBS的培养液配成单个细胞悬液,接种入6孔板,2 mL/孔,37 ℃、5% CO2培养箱培养,待细胞80%~90%呈融合状态时,换无血清培养基培养24 h后重悬,调整浓度为1×106个/mL,加入96孔板,100μL/孔,5复孔,同时设空白对照孔(不加细胞),加入不同浓度LPS作为刺激物,建立体外炎症模型,同时以PBS作为阴性对照。药物干预时间分别设为3、6和9 h,至规定时间后加入MTT,每孔加MTT溶液(5 mg/mL用PBS配制,pH=7.4)20μL。继续于37 ℃、5% CO2培养箱培养孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加150μL DMSO,震荡10 min,使结晶物充分融解。放入酶标仪检测,测定波长490 nm各孔的OD值,记录结果,以时间为横坐标,OD值为纵坐标绘制细胞生长曲线。
1.6 统计学处理方法 用SPSS16.0统计软件进行分析处理。所有数据以±s表示,多组样本均数比较进行方差齐性检验,组间比较采用单因数方差分析。方差齐性者两两比较采用LSD法,方差不齐者进行Dunnet’s T3检验。
2 结果
2.1 LF的分离纯化和扩增 24 h后显微镜下可见长梭型细胞从组织块中爬出, 72 h后细胞生长迅速,4 d接近融合。在原代培养过程中,LF还混有少量的圆形II型肺泡上皮(alveolar typeII,ATII)(见图1),因为传代后差异贴壁,利用成纤维细胞贴壁的时间早于ATII细胞,从而去除ATII细胞。LF呈星状或梭形,核椭圆形,核仁明显,细胞伸出多个突起,并连接成网状。传代后的LF几乎长满整个培养瓶,偶见其他非纤维细胞(见图2),细胞增殖能力强,3 d接近融合,连续传4~5代以后,细胞增殖能力方逐渐下降。
2.2 免疫荧光 肺成纤维细胞vimentin阳性,CD31阴性(见图3)。
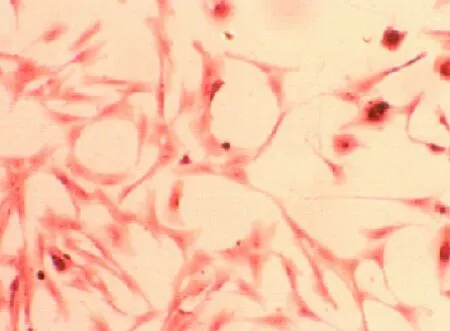
图1 原代细胞(HE,×200)

图2 传代第三代细胞(HE,×200)
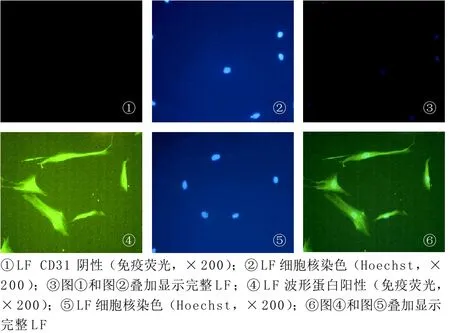
图3 LF vimentin 阳性,CD31阴性
2.3 MTT检测结果 在LPS的刺激下,大鼠肺成纤维细胞出现了增殖反应,0.1μg/mL组、1μg/mL组、10μg/mL组与对照组相比,均出现了增殖反应(P<0.05)。其中刺激浓度为1μg/mL时,与其他3组相比,细胞增殖反应最大(P<0.05),且在各个浓度的不同刺激时间里,6 h时,细胞增殖反应较大(P<0.05),具体见表1。因此可以确定LPS刺激致ARDS模型的最适刺激浓度为1μg/mL,最佳刺激时间为6 h。
表1 各组不同时间段OD值比较(±s)
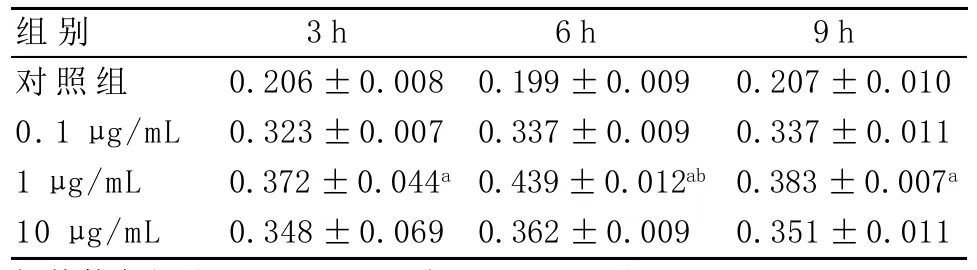
表1 各组不同时间段OD值比较(±s)
与其他各组比:aP<0.05;与3h、9h比:bP<0.05
3h 0.206±0.008 0.323±0.007 0.372±0.044a 0.348±0.069组别对照组0.1μg/mL 1μg/mL 10μg/mL 6h 0.199±0.009 0.337±0.009 0.439±0.012ab 0.362±0.009 9h 0.207±0.010 0.337±0.011 0.383±0.007a 0.351±0.011
3 讨论
成纤维细胞是人体数量最多的一种间质细胞[2],主要功能包括细胞外基质的合成与重造、调节上皮细胞的分化、调节炎症过程以及参与组织损伤的修复[3]。通过调控成纤维细胞可以调控炎症的发生及消退过程。
本试验参照Tamm等[1]的组织贴壁方法分离肺成纤维细胞,并进行改良。在分离细胞的过程中发现,分离前使用肝素和经肺动脉、经气道的充分灌洗非常重要。充分灌洗能冲走心脏和大血管里的大部分血细胞和肺泡内绝大多数的巨噬细胞,这样可以增加成纤维细胞的纯度。而本实验采用胰酶稍微消化后的组织混合悬液进行贴壁培养的方法,与单纯组织培养法[4]相比,单纯组织贴壁法缺点为组织存活率低,而且成纤维细胞爬出慢,至少要两周左右才能有成纤维细胞爬出。同时与差速离心和贴壁法[5]相比,差速离心和贴壁法缺点为酶消化法步骤多,过程复杂,极易污染,成功率很低,而且多次离心也会使细胞损伤和丢失。另外本实验基本上2代的成纤维细胞纯度可达95%~99%。差异贴壁利用成纤维细胞贴壁的时间早于ATII细胞,从而去除ATII细胞。本方法操作简单, 大大缩短了时间, 全程大约为1 h,减少了污染机会,保证了细胞活力(与组织块培养法[4]、差速离心和贴壁法[5]相比)。 本实验还观察到培养瓶中组织块分布的均匀度及培养基的量对于成纤维细胞的生长有很大影响,组织块必须分布均匀而且培养基的量一定要避免组织块飘起为准。
炎症是机体抵抗病原入侵、修复组织细胞损伤的重要防御机制之一。传统观念认为急性炎症效应细胞主要有白细胞及巨噬细胞等,目前越来越多证据表明成纤维细胞也可以作为急性炎症效应细胞[6]。但至今国内外鲜有理想的在体外培养的LF上建立急性炎症模型。在70%的临床ARDS病人中,40%与感染及脓毒血症有关,而细菌内毒素作为自然的致病原是引起ARDS的重要因素[7]。本实验选择LPS建立急性炎症模型较为合理。
MTT可用于简便而较准确的细胞增殖分析,MTT比色法,是一种检测细胞存活和生长的方法,用酶联免疫检测仪在490 nm波长处测定其光吸收值,可间接反映活细胞数量。因此可利用这一特性直接进行细胞增殖分析。本试验是在分离纯化得到的成纤维细胞上直接用LPS干预,并利用MTT来检测细胞增殖高峰所需的LPS的浓度及达到增殖高峰的时间,结果显示在体外培养的成纤维细胞上用1μg/mL的LPS干预6 h能够达到增殖的最高峰。本实验采用原代成纤维细胞建立模型较能表现成纤维细胞病理生理特性,但缺点是LPS直接干预下原代成纤维细胞与在体LPS干预下LF还是有一定区别,因为其不能显现出成纤维细胞与肺巨噬细胞等的相互作用过程。我们下一步的研究为避免这样缺点,将采用LPS刺激大鼠,建立大鼠急性肺损伤,并应用免疫磁珠方法急性分离LF,建立急性炎症LF模型。
[1] Tamm M, Roth M, Malouf M, et al. Primary fibroblast cell cultures from Transbronchial biopsies of lung transplant recipients[J]. Transplantation,2001,71(2):337-339.
[2] Klapholz-Brown Z, Walmsley GG, Nusse YM,et al. Transcriptional program induced by Wnt protein in human fibroblasts suggests mechanisms for cell cooperativity in defining tissue microenvironments[J]. PLoS One,2007,2(9):e945.
[3] Kalluri R, Zeisberg M. Fibroblasts in cancer[J]. Nat Rev Cancer,2006,6(5):392-401.
[4] Mio T, Nagai S, Kitaki M, et al. Proliferative characteristics of fibroblast lines derived from open lung biopsy specimens of patients with IPF(UIP). Chest,1992,102(3):832-837
[5] 祝华平, 常立文, 李文斌, 等. 胎鼠肺细胞的分离纯化及原代培养[J]. 华中科技大学学报:医学版,2003,32(6):597-600.
[6] Vancheri C, Sortino MA, Tomaselli V, et al. Different expression of TNF-alpha receptors and prostaglandin E(2)Production in normal and fibrotic lung fibroblasts: potential implications for the evolution of the inflammatory process[J]. Am J Respir Cell Mol Biol,2000,22(5):628-634.
[7] Udobi KF, Childs E, Touijer K. Acute respiratory distress syndrome[J]. Am Fam Physician,2003,67(2):315-322.

