银杏内酯B对ApoE基因敲除小鼠动脉粥样硬化的影响
刘熹昀,赵革新,鲍 利,陈北冬,吴 伟,齐若梅
动脉粥样硬化是心脑血管疾病致死的主要病理改变,涉及血管内皮细胞、平滑肌细胞,炎症细胞以及血小板。近年研究显示[1-3]血小板不仅参与动脉粥样硬化晚期的血栓形成,在动脉粥样硬化早期阶段通过释放炎症介质促进动脉粥样硬化的炎症反应。银杏内酯B(ginkgolide B,GB)是中药银杏叶提取物,早期研究显示GB能够特异性拮抗血小板活化因子(platelet activating factor,PAF)受体,从而抑制血小板聚集、释放等功能[4]。本研究观察了GB是否能够减少血小板炎症介质释放,从而抑制ApoE-/-小鼠动脉粥样硬化进展,以及 GB对ApoE-/-小鼠血浆 RANTES(regulated on activation,normal T-cell expressed and secreted)的影响。
1 材料与方法
1.1 材料 银杏内酯B购自江苏大观园商贸公司,纯度为95%(批号:BAT2007115)。高脂饲料购自北京科澳协力有限公司,含脂肪15%,胆固醇1.25%。RANTES ELISA检测试剂盒购自美国R&D公司。HE染色液购自北京试剂合力生物科技公司。油红O和OCT购自Sigma公司。Mac-3抗体购自Santa Cruz公司。
1.2 实验动物 24只8周龄♂ ApoE-/-小鼠和12只C57BL/6J小鼠购自北京大学实验动物中心[合格证号:SCXK(京)2006-0008]。ApoE-/-小鼠分为两组,模型组和GB药物组,每组12只,均给予高脂饮食,GB组每日灌胃给药0.6 mg,模型组以等体积的PBS的每日灌胃。C57BL/6J小鼠为正常组,以普通饮食喂养。喂养8周后处死,处死前禁食12 h,不禁水。
1.3 小鼠主动脉弓及胸主动脉油红O染色 实验小鼠被处死后从左心室缓慢灌流PBS,然后分离主动脉弓和胸主动脉,纵向剖开管腔后进行油红O染色。
1.4 小鼠主动脉弓及胸主动脉扫描电镜观察 实验小鼠被处死后从左心室缓慢灌流PBS,再用戊二醛体内固定,分离出主动脉弓及胸主动脉,纵向切开后体外固定、脱水、干燥。使用FEG场发射环境扫描电镜(型号为FEI QUANTA 200)下观察血管内成像。
1.5 血管HE染色及巨噬细胞免疫组化染色 实验小鼠处死后从左心室灌流PBS,分离主动脉头臂干部分,用4%多聚甲醛固定,石蜡包埋切片。用HE染色观察动脉斑块,用抗巨噬细胞抗体Mac3免疫组化染色观察巨噬细胞浸润。
1.6 血浆RANTES测定 用戊巴比妥麻醉小鼠,眼眶后取血,体积分数为3.8%枸橼酸钠抗凝,1 000 r·min-1离心 20 min,取上清后再次 10 000 r·min-1离心10 min,以完全去除血细胞。使用 R&D公司ELISA试剂盒进行RANTES测定,测定方法按照试剂盒说明进行。
2 结果
2.1 扫描电镜 电镜观察 C57BL/6J小鼠主动脉内壁表面光滑,内皮细胞排列规则,纵嵴方向整齐。模型组ApoE-/-小鼠血管内可见硕大斑块及坏死组织,斑块周围内膜病变明显,内皮细胞肿胀,细胞膜破损等改变;GB处理的ApoE-/-小鼠血管内斑块较小,斑块周边主动脉内膜病变较轻(Fig 1)。

Fig 1 Effect of GB on the atherosclerosis in C57BL/6J and ApoE -/- mice showed by scanning electron microscopic imagesA:Aorta of C57BL/6J mice with normal diet;B:Aorta of ApoE-/- mice with high-fat diet;C:Aorta of ApoE-/- mice with highfat diet and GB.
2.2 主动脉HE染色 主动脉头臂干部位是最容易发生动脉粥样硬化的部位。正常组C57BL/6J小鼠的主动脉腔内未见粥样斑块;模型组ApoE-/-小鼠主动脉头臂干部位形成较大的粥样斑块,面积约占管腔面积3/5,GB组ApoE-/-小鼠头臂动脉管腔斑块面积明显减小(Fig 2)。
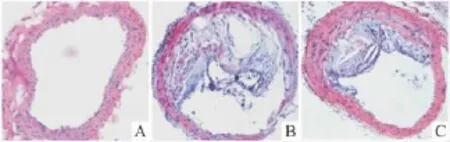
Fig 2 HE staining(hematoxylin-eosin)of atherosclerotic plaque in C57BL/6J and ApoE -/- mice.Note see Fig 1
Tab 1 Plasma level of RANTES by ELISA( ± s,n=12)

Tab 1 Plasma level of RANTES by ELISA( ± s,n=12)
**P<0.01 vs normal group;△△P<0.01 vs model group
Group RANTES/ng·L -1 Normal(C57BL/6J)123.81 ±12.74 Model(ApoE-/-)359.16 ±12.79**GB(ApoE -/-)193.32 ±51.45**△△
2.3 油红O染色 油红O能特异地结合脂质形成肉眼可见的红色。各组主动脉头臂干部位的油红O染色结果显示,C57BL/6J小鼠管腔内仅在分支处有少量脂质沉积;模型组ApoE-/-小鼠主动脉弓管腔内可见大量脂质沉积,尤其在血管分叉处脂质沉积十分明显;GB组ApoE-/-小鼠脂质沉积斑块明显减少(Fig 3)。
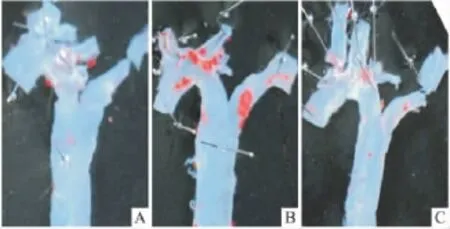
Fig 3 Oil Red O staining of atherosclerotic plaque in C57BL/6J and ApoE -/- mice.Note see Fig 1
2.4 巨噬细胞免疫组化染色 用Mac-3抗体标记巨噬细胞,经过与辣根过氧化氢酶标记的二抗IgG结合显色后呈褐色。结果显示正常组C57BL/6J小鼠的主动脉未见巨噬细胞沉积。对照组ApoE-/-小鼠动脉粥样斑块处可见大量巨噬细胞沉积,斑块中间部位也可见到巨噬细胞沉积,而GB组ApoE-/-小鼠巨噬细胞主要聚集在斑块的表面部位(Fig 4)。
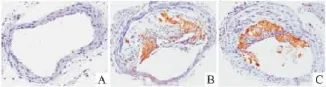
Fig 4 Immunohistochemical staining of macrophage in atherosclerotic plaque in C57BL/6J and ApoE -/- mice.Note see Fig 1.
2.5 血浆 RANTES测定 ELISA法测定血浆RANTES,显示 C57BL/6J组小鼠 RANTES含量为123.81 ng·L-1,模型组 ApoE-/-小鼠 RANTES 含量明显升高,为359.06 ng·L-1,而GB处理的Apo E-/-小鼠 RANTES 为 193.62 ng·L-1。各组之间比较差异存在统计学意义。
3 讨论
近年研究显示[5-6]血小板在动脉粥样硬化的炎症过程中起十分重要的作用。血小板细胞内储存着大量的炎症蛋白,一旦血小板发生活化,这些炎症介质便会释放,参与炎症反应。血小板活化因子具有多种生物活性作用,参与炎症、变态反应、调解中性粒细胞功能等[7]。研究显示[8],GB 对氧化型低密度脂蛋白(ox-LDL)刺激的炎症蛋白ICAM-1(intercellular adhesion molecule-1)表达也有较好的抑制作用。黄贱英等[9]最近报道了GB对缺血/再灌注大脑损伤有保护作用。这些研究均表明GB是一个多靶点药物,对心脑血管系统具有保护作用。根据这些研究,我们推测GB能够通过抑制血小板活化,减少血小板释放反应抑制动脉粥样硬化的进展。我们先前使用GB抑制血小板功能的体外研究结果显示[10],GB 400 和800 mg·L-1能够有效抑制血小板聚集。根据这一结果以及参考动物实验的给药方法,本研究GB 0.6 mg每日给药,实验过程中未发现动物有出血倾向。
ApoE是一个载脂蛋白,ApoE基因变异以及基因敲除能够诱发血脂运输、代谢异常,导致动脉粥样硬化。因此,本研究使用ApoE基因敲除小鼠制备动脉粥样硬化模型,观察银杏内酯B对动脉粥样硬化进展的影响。本研究对各组动物模型血管切片电镜以及HE染色结果均显示,模型组ApoE-/-小鼠粥样斑块中含有较多的空泡区,表明有大量坏死成分。与此相比较,GB处理的ApoE-/-基因敲除小鼠斑块较小,血管壁平滑肌层有明显增生,这些特征表明给予GB药物干预后使血管病变减缓,处于斑块形成的相对早期阶段。巨噬细胞染色的结果显示,GB处理组小鼠动脉粥样局部表面巨噬细胞沉积较多,与大多数研究报告的动脉粥样硬化早期炎症细胞浸润的现象是相符合的。
RANTES是机体内参与炎症反应的主要炎症介质,具有化学趋化作用,存在于血小板、平滑肌细胞及淋巴细胞,但血小板是其主要来源之一[11]。一些研究显示动脉粥样硬化斑块中发现RANTES在斑块局部沉积,表明RANTES直接参与动脉粥样硬化的炎症反应[12-13]。Schober等[14]报道了使用 RANTES抑制剂能够减轻电损伤导致的血管内膜新生以及巨噬细胞浸润,从而减轻动物颈动脉斑块,并证实RANTES对血管内皮细胞的炎症影响与血小板表达的P选择素增加相关联。本研究分析了GB对各组小鼠血浆RANTES含量的影响。模型组ApoE-/-小鼠和GB处理的ApoE-/-小鼠血浆RANTES均较阴性对照组(C57BL/6J)明显增高,其中,阳性对照ApoE-/-小鼠的RANTES含量比阴性对照组高2.9倍。GB处理的ApoE-/-小鼠的RANTES含量较模型组降低了1.85倍,但与阴性对照组比较仍然较高,各组之间差异存在显著性。这一结果可能是由于本研究中的GB的剂量较小,尚不足以完全抑制动脉粥样硬化的发生以及相关的炎症改变。增加GB剂量是否能达到更好的抑制效果有待于进一步探讨。我们在前期的工作中也已经确认表明GB能够有效地抑制胶原(collagen),二磷酸腺苷(ADP)等血小板活化剂诱导的血小板聚集[10]。因此,我们认为GB可能通过抑制血小板释放反应,减轻或延缓动脉粥样硬化的进展。最近还有一些新的来源于血小板的炎症介质不断被发现,Coppinger等[15]报道了3个新的由血小板释放的蛋白cylophilin A、SecretogramingIII和calumenin参与炎症反应,并在动脉粥样硬化的斑块中被检出。这些研究对血小板在动脉粥样硬化炎症反应中的重要作用提出了充分的证据。
综上所述,我们的研究首次报道了PAF受体抑制剂GB有效减轻了ApoE-/-小鼠动脉粥样硬化的程度,并能降低血浆RANTES含量。由于血小板分泌RANTES参与动脉粥样硬化,GB能够有效抑制血小板功能,因此,我们认为GB能减轻或延缓动脉粥样硬化的进展,抑制炎症反应。这些保护效果可能与GB抑制血小板功能相关。本研究为动脉粥样硬化防治提供了新的实验依据。
[1]Aukrust P,Halvorsen B,Ueland T,et al.Activated platelets and atherosclerosis[J].Expert Rev Cardiovasc Ther,2010,8(9):1297-307.
[2]Anfossi G,Russo I,Doronzo G,et al.Adipocytokines in atherothrombosis:focus on platelets and vascular smooth muscle cells[J].Mediators Inflamm,2010,2010:174341.
[3]Evans D J,Jackman L E,Chamberlain J,et al.Platelet P2Y(12)receptor influences the vessel wall response to arterial injury and thrombosis[J].Circulation,2009,119(1):116 - 22.
[4]Touvay C,Etienne A,Braquet P.Inhibition of antigen-induced lung anaphylaxis in the guinea-pig by BN 52021 a new specific paf- acether receptor antagonist isolated from Ginkgo biloba[J].A-gents Actions,1986,17(3 -4):371 -2.
[5]Muhlestein J B.Effect of antiplatelet therapy on inflammatory markers in atherothrombotic patients[J].Thromb Haemost,2010,103(1):71-82.
[6]Kornen R R,Weber C.Platelet-derived chemokines in vascular remodeling and atherosclerosis[J].Thromb Hemost,2010,36(2):163-9.
[7]Benveniste J,Hensn P M,Cochrane C G.Leukocyte-dependent histamine release from rabbit platelets:The role of IgE,basophils and a platelet-activating factor[J].J Exp Med,1972,136(6):1356-77.
[8]Li R,Chen B,Wu W,et al.Ginkgolide B suppresses intercellular adhesion molecule-1 expression via blocking nuclear factor-κB activation in human vascular endothelial cells stimulated by oxidized low-density lipoprotein[J].J Pharmacol Sci,2009,110(3):362-9.
[9]黄贱英,孙建宁,梅世昌,黄纪明.银杏内酯B对缺血/再灌脑损伤大鼠的保护作用[J].中国药理学通报,2008,24(2):269-72.
[9]Huang J Y,Sun J N,Mei S C,Huang J M.Protective effects of ginkgolide B on cerebra l ischem ia reperfusion injury in rats[J].Chin Pharmacol Bull,2008,24(2):269 -72.
[10]姜秀新,管斯斯,鲍 利,等.银杏内酯B对胶原或二磷酸腺苷刺激血小板活化后一氧化氮含量及血管舒张因子刺激磷酸蛋白磷酸化的影响[J].中国组织工程研究与临床康复,2009,13(11):2066-70.
[10]Jiang X X,Guan S S,Bao L,et al.Effects of ginkgolide B on NO generation and vasodilator-stimulated phosphoprotein phosphorylation following platelet activation induced by collagen or adenosine diphosphate[J].J Clin Rehab Tiss Engin Res,2009,13(11):2066-70.
[11]von Hundelshausen P,Weber K S,Huo Y,et al.RANTES deposition by platelets triggers monocyte arrest on inflamed and atherosclerotic endothelium[J].Circulation,2001,103(13):1772 -7.
[12]von Hundelshausen P,Koenen R,Sack M,et al.Heterophilic interactions of platelet factor 4 and RANTES promote monocyte arrest on endothelium[J].Blood,2005,105(3):924 -30.
[13]Veillard N R,Kwark B,Pelli G,et al.Antagonism of RANTES receptors reduces atherosclerotic plaque formation in mice[J].Circ Res,2004,94(2):253 -61.
[14]Schober A,Manka D,von Hundelshausen P,et al.Deposition of platelet RANTES triggering monocyte recruitment requires P-Selectin and is involved in neointima formation after arterial injury[J].Circulation,2002,106(12):1523 -9.
[15]Coppiger J A,Cagney G,Toomey S,et al.Characterization of the protein released from activated platelets leads to localization of novel platelet protein in human atherosclerotic lesions[J].Blood,2004,103(6):2096 -104.

