内吗啡肽在小鼠树突状细胞的诱导表达
李正红,高 琴,叶红伟,单立冬,龚 珊,蒋星红
树突状细胞(dendritic cells,DC)是目前发现的功能最强大的专职抗原递呈细胞(antigen presenting cells,APC),参与抗原的摄取、加工及提呈。DC最大的特点是能够显著刺激处女型或初始型T细胞(naive T cells)增殖,因此DC是机体免疫反应的始动者,在诱导免疫应答过程中具有独特的地位。DC除了单纯的抗原捕获、递呈和对T细胞的协同刺激作用外,在特异性激活幼稚T细胞、联结天然免疫和获得性免疫反应中也起着独一无二的作用。
内吗啡肽(endomorphin,EM)是新发现的一种阿片样四肽。EM有两种:内吗啡肽-l(endomorphinl,EM-1,Tyr-Pro-Trp-Phe-NH2)和内吗啡肽-2(endomorphin-2,EM-2,Tyr-Pro-Phe-Phe-NH2)。它们有特异性的结构,比其他的阿片肽如脑啡肽,对酶的分解作用有更强的耐受性,与Mu阿片受体有更高的亲和力,被认为是 Mu阿片受体的内源性配体[1]。EM-1和EM-2广泛分布于中枢神经系统富含Mu受体的神经元,并参与镇痛[2,17]。
近年来,越来越多的研究表明,内源性阿片肽能在免疫细胞中生成,是细胞免疫应答的有力调控因素。在关节炎大鼠后爪分泌滑液的组织中[3]和在炎症大鼠的炎症爪局部组织及淋巴结中[4],均发现EM-1和EM-2的水平有所升高,并且伴有Mu受体的高表达[3-4]。EM-1和 EM-2在外周免疫细胞的巨噬细胞/单核细胞中都有表达[5],并且通过抑制致炎细胞因子的产生来改变鼠腹腔巨噬细胞的功能[6-8]。尽管有很多的证据提示DC在免疫反应中的作用,但DC是否产生内吗啡肽,国内外尚未见报道。本研究应用免疫荧光染色观察EM-1和EM-2是否在树突状细胞表达,并进一步研究不同的Toll样受体的配体对树突状细胞分泌EM的影响。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 鼠源集落刺激因子(Pepro-Tech,Rocky Hill,NJ);CD11+ 磁珠(Miltenyi Biotech,Bergish-Gladbach,Germany);Alexa Fluor 488 or Alexa Fluor 546标记的二抗(both from Invitrogen,CA,USA);Zeiss LSM 510 共聚焦显微镜;12.5 mg·L-1poly(I∶C),6 mg·L-1CpGODN,1 mg·L-1Pam3Cys(all from InvivoGen,San Diego,CA);1 mg· L-1LPS (lipopolysacchairde,脂 多 糖,Sigma Aldrich,St Louis,MO);抗EM-1多克隆的抗体 (1∶200)和抗 EM-2多克隆的抗体(1∶100),购自Chemicon,USA。抗 CD11c的单克隆抗体(1∶30;clone:HL3)来源于BD-Pharmingen。EIA试剂盒购自Phoenix Pharmaceuticals Inc。
1.1.2 实验动物 C57BL/6J♀鼠购自北京协和医科大学实验动物研究所。
1.2 方法
1.2.1 骨髓来源的 DC的制备与培养 用 Inaba等[16]的方法来培养大量的DC,略作改动。将7~8周龄的正常C57BL/6J鼠颈椎脱位处死,无菌条件下取完整的股骨、胫骨,剔净周围组织,离断干骺端后,用皮试针抽吸RPMI 1640培养液冲洗髓腔,获得单细胞悬液;1 500 r·min-1离心10 min,弃上清后加入适量Tris-NH4Cl破解红细胞,再用PBS洗涤两次后用含10 μg·L-1GM-CSF、体积分数10%胎牛血清的RPMI 1640培养液重悬细胞,种于6孔板,接种密度为1×109~2 ×109·L-1(3 ~4 ml)·well-1。d 3,轻轻吸弃未贴壁细胞、全量换液。d 5,吸弃半量培养基,并补充该量。d 6、7,收集悬浮和半贴壁细胞。
采用CD11c免疫磁珠进行磁性分选纯化树突状细胞。用 20 mmol·L-1PBS(0.15%BSA,pH 7.12)洗涤细胞两次,加入CD11c免疫磁珠,4℃反应20 min,离心洗涤后将细胞悬液加入MS磁分离柱中进行分离纯化,获取CD11c+的骨髓来源的树突状细胞,所有操作根据autoMACS系统的厂商说明书进行 (Miltenyi Biotech,Bergish-Gladbach,Germany)。采用PE标记的仓鼠抗小鼠CD11c mAb,通过流式细胞仪(Florescence-activated cell sorting,FACS)分析纯化前后的DC纯度。
1.2.2 免疫荧光染色 迄今为止,EM及其前体肽的核苷酸序列仍未知,因此用免疫荧光的方法检测它们在DC的产生。采用的抗EM的抗体,系兔抗鼠的多克隆抗体,其特异性已被其他研究[4]所证明。抗EM-1和抗EM-2的抗体与其他的阿片肽(如内啡肽和脑啡肽)之间都没有交叉反应性。在多重的切片中,染色的特异性用一抗或二抗的省略所证实。在这些阴性对照的实验中,没有阳性染色的结果。
为了证实在DC上的EM-1/EM-2的表达,在4孔培养板中培养的DC用双重的免疫荧光技术进行染色,共聚焦显微镜观察。成熟和未成熟的DC载玻片用丙酮固定,随后加入抗EM-1和抗EM-2的多克隆抗体和抗CD11c的单抗进行免疫染色,4℃过夜孵育。洗去一抗后,加入相应的Alexa Fluor 488和Alexa Fluor 546标记的二抗,在室温下孵育1 h。阴性对照包括:省略一抗,省略二抗和同型对照。
1.2.3 TLR配体影响EMs的分泌 由于TLR配体可以促进DC的成熟[19],并且导致致炎细胞因子的释放,推测TLR配体可能影响EM的产生。培养7 d的DC,进行纯化。纯化后的DC以5×105细胞/毫升的浓度培养于48孔培养板中,并且用以下条件来刺激:12.5 mg·L-1poly(I∶C);6 mg·L-1CpG ODN;1 mg·L-1Pam3Cys;1 mg·L-1LPS。细胞培养24 h后,分别收集各孔细胞和培养上清液,检测其EM-1和EM-2的分泌水平。未刺激的DC作为对照。
1.2.4 Enzyme immunoassay(EIA)检测 EM 采用EIA方法检测EMs。本试剂盒采用竞争结合的方法来间接测得EM的浓度。简言之,可识别一抗的二抗预先包被在微量检测板上,反应体系中包括可识别EM的一抗和固定浓度的生物素标记的EM。当加入含EM的样本或EM标准品时,这些未标记的EM与生物素标记的EM竞争结合一抗,经过严格的洗脱,将形成抗原-抗体复合物,包括EM-生物素标记EM-一抗-二抗,由于链亲和素(streptavidin)可与生物素以较高的亲和力结合,因此加入链亲和素标记的辣根过氧化物酶(SA-HRP)后,可以通过颜色的深浅来间接反映样本中的EM浓度。
每孔加入50 μl的待测样本或标准品,25 μl的一抗以及25 μl的生物素标记的EM;室温孵育2 h后,洗脱5次;加入100 μl的链亲和素标记的辣根过氧化物酶,室温孵育1 h;洗脱6次;加入100 μl的底物,室温孵育 1 h;用 100 μl的 2 mol·L-1HCl终止反应;用OD450nm读取光吸收值,并计算结果。
1.3 统计学分析 Mann-Whitney U test用于比较不同试验组的差异。
2 结果
2.1 树突状细胞产生EM CD11c分子系DC的表面膜分子,当用Alexa544标记的二抗进行免疫荧光染色时,DC的细胞膜呈红色。细胞在细胞质内合成EM的前体,并分泌产生EM,因此,当用Alexa 488标记的二抗进行免疫荧光染色时,DC的胞质呈绿色。我们的结果,如Fig 1A所示,说明了EM-1的免疫反应性可以在活化的CD11c+DC的细胞质中被检测到,活化的CD11c+DC具有树突消失和圆形的形态学特性。此外,EM-2的免疫反应性也可以在活化的CD11c+DC中被检测到(如Fig 1B)。在未活化的树突状细胞,EM-1和EM-2阳性细胞较少,当用LPS刺激活化后,EM阳性细胞增加,表明了EM-1和EM-2在DC中可以被诱导性表达。
2.2 TLR配体影响EMs的分泌 免疫磁珠分选的CD11c+细胞,培养在48孔板中,加入不同的TLR配体刺激细胞24 h。收集细胞培养上清液,用EIA试剂盒测量培养上清液中的EM-1和EM-2的浓度。未刺激活化的细胞作为对照。结果表明,用TLR配体刺激活化的树突状细胞,与对照组相比,都能使上清液中EM浓度明显升高。其中,LPS和poly(I∶C)促进EM分泌的效果更加明显,而且不同的TLR配体促进EM-1和EM-2分泌的效果相似(Fig 2)。
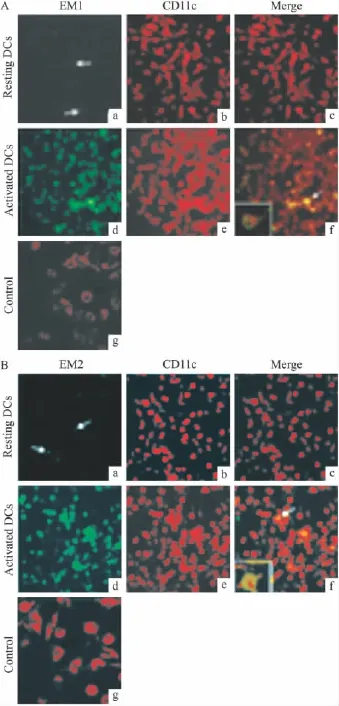
Fig 1 Confocal microscopic pictures of endomorphin expression on DCDouble fluorescence staining showed the co-expression of EM-1(A)or EM-2(B)with CD11c in DC.DCs were activated by LPS for 24 h.Resting DCs were not activated by LPS.d,e,f.:co-expression of endomorphin-1 or endomorphin-2(green)with CD11c+dendritic cells(red)was detected in LPS-activated group;Inset at the left corner of(f)showing co-expression of EM and CD11c in dendritic cell(indicated by arrow)with high magnification.a,b,c:no co-expression of EM with CD11c was detected in non-activated,resting DCs,although a few EMs-positive cells(indicated by arrows)were observed.Control omitting primary antibody against EM
3 讨论
在炎症条件下,多种类型的免疫细胞可以在原位或在其培养物中检测到具有阿片活性的肽类,表明免疫细胞能产生阿片类物质。近年来,相继有报道EMs和Mu受体在不同免疫细胞中表达。例如,在活化的CD4+/CD8+T细胞和B细胞中,Mu受体表达上调[9],在腘淋巴结的髓质区[4]和脾脏[5]中,在巨噬细胞/单核细胞和B细胞中都能检测到EM-1和EM-2。在人体和小鼠的DC都有Mu受体的表达[10]。本研究表明,来源于骨髓的DC,经LPS活化后,能检测到EM-1/EM-2的表达。
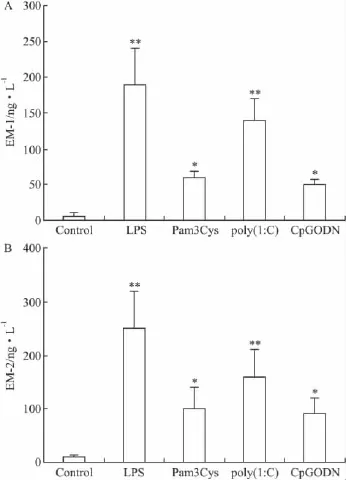
Fig 2 Secretion of endomorphins from TLR ligands-treated DCsThe concentration of EMs in supernatant was measured using enzyme immunoassay kit.Non-activated DCs were used as control.Data were calculated from triplicate independent experiments.A:Concentration of EM-1 released from DCs in the presence of TLR ligands.B:Concentration of EM-2 released from DCs in the presence of TLR ligands.*P < 0.05,**P<0.01 vs control
研究发现[18],TLR存在于 APC(抗原递呈细胞)、B细胞、巨噬细胞及其他细胞的细胞膜上,而且都有一个胞外的富亮氨酸的重复区域和一个介导信号转导的胞质区。实验中用骨髓来源的DC进行离体培养,是为了模拟体内DC成熟的条件,采用不同的Toll样受体的配体进行活化,TLR配体可能影响EM的产生。DC膜上的Toll样受体能感应微生物的产物[11-12]导致致炎因子(TNF-α、IL-1β、IL-6)的表达,诱发局部免疫应答反应[13,19]。实验结果表明,EM-1和EM-2不仅在DC的胞质内表达,而且在培养DC的上清液中也测得到EM-1和EM-2,表明DC不仅能产生EMs,而且还能分泌到周围环境中,至于EMs产生的机制还不太清楚。根据肽类物质生成的一般规律,可能是从前体肽类降解而来,而Toll样受体信号可能参与了调控。
实验结果显示DC生成的EMs能分泌到上清液中,这提示DC可以作为免疫调节因素,使EMs作用于邻近的其他细胞,发挥免疫调节作用。由于DC自身也表达Mu受体[10]。因此,DC分泌的 EMs有可能作用于自身的Mu受体,以自分泌和旁分泌的方式发挥免疫调节作用。事实上,阿片肽也被认为是细胞因子家族的成员,在神经组织和非神经组织中发挥调控作用[14]。
在DC上发现有EMs和Mu受体的诱导性表达,具有重要的生物学意义。设想在炎症早期,DC的渗入和参与,胞质中的蛋白前体在Toll样受体的配体作用下生成EMs。随着DC的成熟,可以迁移至外周免疫组织和一些特异的器官(如发炎的滑膜组织),在组织中,EM-1和EM-2被转运和释放,作用于邻近的其他细胞。成熟的DC提供给T细胞的,不仅是抗原特异性的刺激信号和一系列的共刺激的分子,也释放了一些可以使T细胞分化的细胞因子和其他化学因子。除了T细胞,释放的EM-1和EM-2也可以作用在巨噬细胞,抑制促炎介质的释放,例如,IL-2、IL-12、肿瘤坏死因子(TNF-α)[7]。总之,我们可以合理的推测,DC释放的 EM-1和EM-2可以调节先天的和适应性的免疫应答。此外,DC可以迁移至有炎症的组织,DC分泌的EM-1和EM-2可以作用在初级传入的伤害性神经元的末端,通过抑制P物质和降钙素基因相关肽的产生来发挥强效的镇痛效应,或者调节小胶质细胞的功能[15]。
总之,在CD11c阳性的DC中EM-1、EM-2的诱导性表达,扩展了我们对于免疫系统内阿片肽在细胞内分布的认识,也提示了它们在调控神经内分泌免疫调制和镇痛方面的作用。
[1]Zadina J E,Hackler L,Ge J,et al.A potent and selective endogenous agonist for the mu-opiate receptor[J].Nature,1997,386(6624):499-502.
[2]Fichna J,Janecka A,Costentin J,et al.The endomorphin system and its evolving neurophysiological role[J].Pharmacol Rev,2007,59(1):88-123.
[3]Jessop D S,Richards L J,Harbuz M S.Opioid peptides endomorphin-1 and endomorphin-2 in the immune system in humans and in a rodent model of inflammation[J].Ann NY Acad Sci,2002,966:456-63.
[4]Mousa S A,Machelska H,Schafe M,et al.Immunohistochemical localization of endomorphin-1 and endomorphin-2 in immune cells and spinal cord in a model of inflammatory pain[J].J Neuroimmunol,2002,126(1 -2):5 -15.
[5]Seale J V,Jessop D S,Harbu M S.Immunohistochemical staining of endomorphin 1 and 2 in the immune cells of the spleen[J].Peptides,2004,25(1):91 -4.
[6]Inui Y,Azuma Y,Ohura K.Differential alteration of functions of rat peritoneal macrophages responsive to endogenous opioid peptide endomorphin-1[J].Int Immunopharmacol,2002,2(8):1133 -42.
[7]Azuma Y,Ohura K.Endomorphin-2 modulates productions of TNF-alpha,IL-1beta,IL-10,and IL-12,and alters functions related to innate immune of macrophages[J].Inflammation,2002,26(5):223-32.
[8]Azuma Y,Ohura K.Endomorphins 1 and 2 inhibit IL-10 and IL-12 production and innate immune functions,and potentiate NF-kappaB DNA binding in THP-1 differentiated to macrophage-like cells[J].Scand J Immunol,2002,56(3):260 -9.
[9]Gaveriaux-Ruff C,Matthes H W,Peluso J,et al.Abolition of morphine-immunosuppression in mice lacking the mu-opioid receptor gene[J].Proc Natl Acad Sci USA,1998,95(11):6326 -30.
[10]Makarenkova V P,Esche C,Kost N V,et al.Identification of deltaand mu-type opioid receptors on human and murine dendritic cells[J].J Neuroimmunol,2001,117(1 -2):68 -77.
[11]Akira S.Immunological mechanism in man against infection[J].Nippon Naika Gakkai Zasshi,2001,90(12):2360 -5.
[12]Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5(10):987 - 95.
[13]Lehnardt S,Massillon L,Follett P,et al.Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway[J].Proc Natl Acad Sci USA,2003,100(14):8514-9.
[14]Sharp B M,Roy S,Bidlack J M.Evidence for opioid receptors on cells involved in host defense and the immune system[J].J Neuroimmunol,1998,83(1 -2):45 -56.
[15]Azuma Y,Ohura K,Wang P L,et al.Endomorphins 1 and 2 modulate chemotaxis,phagocytosis and superoxide anion production by microglia[J].J Neuroimmunol,2001,119(1):51 -6.
[16]Inaba K,Inaba M,Romani N,et al.Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J].J Exp Med,1992,176(6):1693 -702.
[17]任维华,霍笑风,吴 宁,等.内吗啡肽研究进展[J].中国药理学通报,2001,17(1):17 -20.
[17]Ren W H,Huo X F,Wu N,et al.Progress in the studies of endomorphins[J].Chin Pharmacol Bull,2001,17(1):17 -20.
[18]叶 红,余味一.药用真菌葡聚糖免疫调节作用的研究进展[J].中国药理学通报,2009,25(2):153 -6.
[18]Ye H,Yu W Y.Progress on the study of the immunomodulating action of glucans from macrofungi[J].Chin Pharmacol Bull,2009,25(2):153-6.
[19]刘道芳,魏 伟,宋礼华.TLRs介导的免疫调节信号通路及其药物作用[J].中国药理学通报,2005,21(6):653 -6.
[19]Liu D F,Wei W,Song L H.Immunoregulation signal pathway mediated by TLRs and its drug role[J].Chin Pharmacol Bull,2005,21(6):653-6.

