褪黑素对HeLa细胞的生长及NF-κB蛋白表达的影响
陈少雅,陈崇宏,杨丽娟,林 菁
褪黑素(melatonin,MT)是生物体内普遍存在的一种吲哚类激素,在人体内主要由松果体合成和分泌。大量研究表明,MT具有镇痛、镇静、调整时差、抗氧化、免疫增强、抗肿瘤[1]等作用,且相对安全。在抗肿瘤及肿瘤辅助治疗方面存在理论价值和应用前景。目前,中、晚期宫颈癌位居十大高死亡率恶性肿瘤之列。宫颈癌术后必须进行化疗,有临床研究表明[2]宫颈癌患者血浆中MT水平较正常人低,故MT用于宫颈癌治疗具备可能性。然而,国外已有的MT对HeLa细胞抑制作用的研究结果存在争议[3]。MT抗肿瘤的机制目前仍不清楚。NF-κB在HeLa细胞中高表达,对肿瘤的发生、发展发挥重要作用,是肿瘤预防和治疗的潜在靶点[4]。因此,本研究旨在对MT抗HeLa细胞增殖活性作进一步探讨,并探究其与NF-κB蛋白表达的关系。
1 材料与方法
1.1 材料
1.1.1 细胞株 人宫颈癌HeLa细胞购于上海中国科学院细胞库。
1.1.2 药品及试剂 MT,Sigma公司产品;RPMI 1640培养基干粉,Hyclone产品;胰蛋白酶为Difco进口分装;小牛血清,杭州四季青生物试剂公司产品;碘化丙啶(PI),吖啶橙(AO),溴化乙锭(EB),四甲基偶氮唑盐(MTT)为Sigma公司产品;其余试剂均为分析纯产品;anti-NF-κB小鼠单抗;anti-β-actin山羊单抗;辣根酶标记兔抗山羊IgG、碱磷酶标记马抗小鼠IgG、碱磷酶标记山羊抗兔IgG,均为Santa Cruz产品;碱性磷酸酶(AP)显色底物为进口分装。
1.2 方法
1.2.1 MTT法检测细胞体外增殖抑制试验 取对数生长期的HeLa细胞,以0.25%胰蛋白酶充分消化后,以培养基配成适当浓度接种于96孔培养板中,180 μl/孔,实验组加入等体积不同浓度的药物20 μl/孔(终浓度分别为 0.008、0.04、0.2 及 1 g·L-1),对照组加入等体积培养液。每组设4个复孔。在药液分别作用1~5 d后,每天取1块培养板,加入5 g·L-1MTT 20 μl/孔终止药物作用,在培养箱中继续孵育4 h后,弃净上清液,加DMSO 150 μl/孔,空白对照孔只加入 DMSO 150 μl/孔,振荡10 min,492 nm波长下用酶标仪测定光吸收值(OD492)。直线回归法计算IC50。
1.2.2 AO和EB双染荧光显微镜观察MT对HeLa细胞形态学的影响 取对数生长期HeLa细胞,2.5 g·L-1胰蛋白酶消化,离心,全培养基稀释成5×107·L-1接种于6孔培养板,待细胞贴壁后加入MT使每孔细胞终浓度为200 mg·L-1,对照组加入等体积含10 ml·L-1无水乙醇的培养液,分别孵育1、2及3 d后,2.5 g·L-1胰蛋白酶消化,离心收集细胞,用PBS洗涤两次后,稀释成1010·L-1细胞悬液,取10 μl细胞悬液与1 μl AO 和1 μl EB 混合(AO、EB终浓度均为4 mg·L-1),滴于载玻片上,用荧光显微镜观察并拍照。
1.2.3 Western blot法检测NF-κB蛋白水平 取对数生长期的HeLa细胞分别以全培养基及含MT(终浓度为0.008、0.04、0.2 g·L-1)培养基孵育 1、2 及3 d,收集不同时间点的细胞,用去污裂解液裂解各组细胞,提取总蛋白,用考马斯亮蓝法测各组蛋白浓度,制备100 g·L-1SDS-PAGE,每泳道加总蛋白90 μg,进行电泳,转膜,丽春红-S 染色,50 g·L-1BSATBST常温下封闭过夜后,分别加入anti-NF-κB小鼠单抗(一抗)、anti-β-actin山羊单抗反应2 h,PBS漂洗2次,TBST漂洗1次,分别加入碱磷酶标记马抗小鼠IgG(二抗)、辣根酶标记兔抗山羊IgG反应1 h,TBST漂洗3次,分别用AP、DAB显色底物(避光反应),NC膜上显色至出现清晰的条带,立即终止显色,洗膜,晾干,拍照,膜永久保存。用 Gel-Pro Analyzer分析软件分析通道蛋白的灰度,相对含量用 NF-κB/β-actin灰度值比表示。
2 结果
2.1 MT对HeLa细胞的抗增殖活性 HeLa细胞的生长曲线显示,随着MT剂量的增加,作用时间的延长,抑制增殖作用明显增强,生长曲线随之下移。MT作用3 d,抑制 HeLa细胞的 IC50为61.71 mg·L-1(Fig 1)。
2.2 AO和EB双染荧光显微镜观察MT对HeLa细胞形态学的影响 荧光显微镜下,对照组经胰酶消化的HeLa细胞呈圆形(Fig 2A);MT 1 g·L-1作用1、2、3 d组,胞膜溶解的坏死细胞随作用时间的延长而逐渐增多,凋亡细胞少见(Fig 2B、C、D)。由此可见,MT主要致HeLa细胞坏死而少致凋亡。
2.3 MT对HeLa细胞NF-κB蛋白水平的影响MT 0.2 g·L-1作用 1、2、3 d,对 HeLa 细胞 NF-κB蛋白水平的抑制作用呈明显的时间依赖性。作用时间越长,抑制作用越明显。MT 0.2 g·L-1作用1、2、3 d NF-κB蛋白水平明显抑制,与对照组比较,P<0.01;MT 0.2 g·L-1作用2及3 d较作用1 d的NF-κB蛋白水平低,MT 0.2 g·L-1作用3 d较作用2 d的 NF-κB 蛋白水平低,P <0.01(Fig 3)。
MT 0.008、0.04 及 0.2 g·L-1作用 3 d,对 He-La细胞NF-κB蛋白水平的抑制作用呈明显的浓度依赖性。MT 0.008、0.04及0.2 g·L-1作用3 d对NF-κB蛋白水平的抑制作用明显,与对照组比较,P<0.01;MT 0.04 及0.2 g·L-1较 MT 0.008 g·L-1组对NF-κB蛋白水平的抑制作用明显,P<0.01;MT 0.2 g·L-1较 MT 0.04 g·L-1对 NF-κB 蛋白水平的抑制作用明显,P<0.01(Fig 4)。
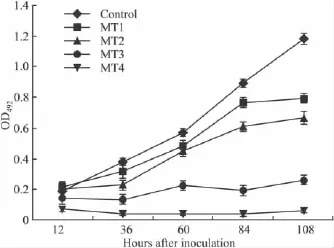
Fig 1 Inhibiting activity of melatonin on HeLa cells by MTT assay( ± s,n=5)MT1:Treated with MT 8 mg·L-1;MT2:With 40 mg·L-1;MT3:With 200 mg·L-1;MT4:With 1 g·L-1
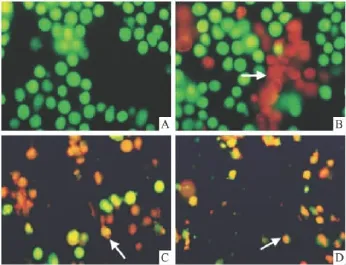
Fig 2 Morphological alterations of HeLa cells stained with AO/EB by fluorescene staining(×400)A:Control;B:Treated with melatonin 1 g·L-1for 1 d;C:for 2 d and D for 3 d.→,necrosis cells
3 讨论
MT作为几无毒性的内源性激素,其抗肿瘤活性及应用前景已引起广泛关注。国内外报道[5-7]多显示MT对体内、外肿瘤有抑制增殖作用。在多种体外培养肿瘤细胞株上,多家实验室均观察到MT可抑制肿瘤细胞的增殖,但有关抗肿瘤活性的有效剂量报道不一[3],可能与体外培养肿瘤细胞系的类别、给药时间、药物的溶解度等实验条件不同有关。本课题组前期工作显示MT对体外培养HeLa细胞系有抑制增殖作用,且主要表现为细胞坏死,坏死程度呈剂量依赖性,未见明显的细胞凋亡。由此可见,MT抑制HeLa细胞增殖是导致细胞坏死为主而非促发细胞凋亡。
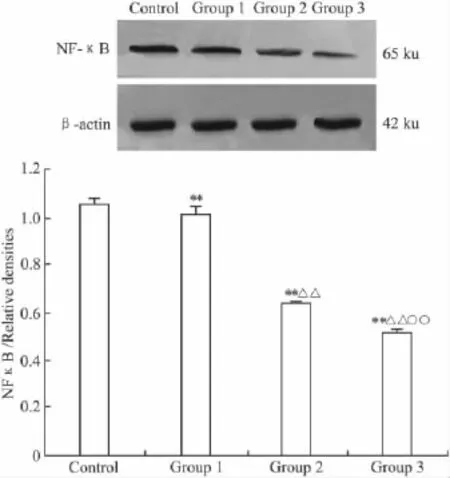
Fig 3 The influences of melatonin on NF-κB levels on HeLa cells by Western blot analysis(±s,n=5)Group 1,treated with MT 0.2 g·L-1for 1 d;Group 2 for 2 d;Group 3 for 3 d.NF-κB/Relative densities,**P <0.01 vs control;△△P<0.01 vs group 1;○○P <0.01 vs group 2
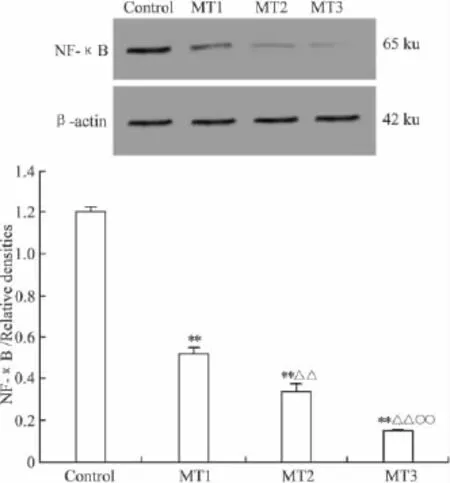
Fig 4 The influences of melatonin on NF-κB levels on HeLa cells by Western blot analysis(±s,n=5)MT1:Treated with MT 0.008 g·L-1;MT2:With 0.04 g·L-1;MT3:With 0.2 g·L-1.NF-κB/Relative densities,**P < 0.01 vs control,△△P <0.01 vs MT1,○○P <0.01 vs MT2
MT的抗肿瘤作用机制广泛而复杂[8-10],目前主要的观点包括抗氧化作用、免疫调节作用、对细胞代谢及细胞周期的影响,调节生长因子,干扰钙调素和微管蛋白的功能,作用于MT1受体调节多种基因表达等。有报道表明,MT通过抑制NF-κB活性而增强TNF-α所致的肿瘤细胞死亡[11];皮质酮抑制NF-κB来调制NA诱导的MT合成[12]。MT对HeLa细胞中高表达的NF-κB是否有影响未见相关报道。
NF-κB是广泛存在于人体组织细胞中的转录因子,最常见的家族成员是p65/p50异源二聚体,对众多基因发挥转录调节作用。NF-κB通常在胞质中与抑制蛋白 IκB 结合呈非活性状态,IκB-α 对 NF-κB的活化起主要调控作用,NF-κB的活化主要依赖于IκB蛋白的磷酸化,而 IκB 蛋白的磷酸化在 IκB 激酶(主要为IκKβ)催化下进行。激活的NF-κB移位入胞核后可上调多种靶基因的表达,包括多种细胞因子的表达,与肿瘤的发生和发展[13]等密切相关。NF-κB在许多疾病发病机制中扮演关键角色[14-15]。有报道显示[16],NF-κB增高可促进肿瘤的增殖与转移,并且导致肿瘤化疗耐药。NF-κB抑制剂已成为目前治疗肿瘤的新策略。
鉴于MT和NF-κB作用及机制的复杂性、关联性,为探究MT抑制HeLa细胞与NF-κB水平的关系,本研究采用Western blot法检测不同浓度的MT对HeLa细胞 NF-κB的蛋白水平的影响。结果提示,MT 0.2 g·L-1作用 1、2 及 3 d,对 HeLa 细胞生长抑制的同时NF-κB蛋白水平下调,从MT作用2 d开始,呈时间依赖性。MT 0.008、0.04及0.2 g·L-1作用3 d,对HeLa细胞 NF-κB蛋白水平的下调呈明显的浓度依赖性。说明MT对HeLa细胞的抗增殖活性与NF-κB蛋白水平的下调可能有关。与文献报道[15]相符。NF-κB与细胞因子的关系复杂,细胞因子TNF-α可导致细胞凋亡和坏死,HeLa细胞的坏死可能与MT抑制NF-κB而增强TNF-α功能有关[11],也可能是MT抗肿瘤的复杂机制共同导致。
综上所述,MT抑制HeLa细胞增殖的机制复杂,下调 NF-κB水平可能与其抗肿瘤机制有关。NF-κB与其信号转导通路上各个抑制环节的关系如何?MT造成HeLa细胞坏死与NF-κB下调影响细胞因子的作用是否关联?有待下一步实验验证,为开发MT及其类似物和NF-κB抑制剂用于肿瘤化疗及化疗增敏方面提供理论基础。
[1]Taies M,Gutierrez-Cuesta J,Ortuño-Sahagun D,et al.Anti-aging properties of melatonin in an in vitro murine senescence model:involvement of the sirtuin 1 pathway[J].J Pineal Res,2009,47(3):228-37.
[2]Karasek M,Kowalski A J,Suzin J,et al.Serum melatonin circadian profiles in women suffering from cervical cancer[J].J Pineal Res,2005,39(1):73-6.
[3]Panzer A,Lottering M L,Bianchi P,et al.Melatonin has no effect on the growth,morphology or cell cycle of human breast cancer(MCF-7),cervical cancer(HeLa),osteosarcoma(MG-63)or lymphoblastoid(TK6)cells[J].Cancer Lett,1998,122(1-2):17-23.
[4]Van Waes C.Nuclear factor-kappaB in development,prevention,and therapy of cancer[J].Clin Cancer Res,2007,13(4):1076-82.
[5]Dong C,Yuan L,Dai J,et al.Melatonin inhibits mitogenics crosstalk between retinoic acid-related orphan receptor alpha(RORalpha)and Eralpha in MCF-7 human breast cancer cells[J].Steroids,2010,75(12):944-51.
[6]Romero A,Egea J,García A G,López M G.Synergistic neuroprotective effect of combined low concentrations of galantamine and melatonin against oxidative stress in SH-SY5Y neuroblastoma cells[J].J Pineal Res,2010,49(2):141-8.
[7]Cabrera J,Negrin G,Estévez F,et al.Melatonin decreases cell proliferation and induces melanogenesis in human melanoma SKMEL-1 cells[J].J Pineal Res,2010,49(1):45-54.
[8]Mazzoccoli G,Vendemiale G,De Cata A,et al.Altered time structure of neuro-endocrine-immune system function in lung cancer patients[J].BMC Cancer,2010,10:314.
[9]Hill S M,Frasch T,Xiang S,et al.Molecular mechanisms of melatonin anticancer effects[J].Integr Cancer Ther,2009,8(4):337-46.
[10]胡世莲.褪黑素抗肿瘤作用及其机制的研究进展[J].中国药理学通报,2008,24(4):428-31.
[10]Hu S L.Melatonin in the treatment of cancer and its mechanism[J].Chin Pharmacol Bull,2008,24(4):428-31.
[11]Sainz R M,Reiter R J,Tan D X,et al.Critical role of glutathione in melatonin enhancement of tumor necrosis factor and ionizing radiation-induced apoptosis in prostate cancer cells in vitro[J].J Pineal Res,2008,45(3):258-70.
[12]Ferreira Z S,Fernandes P A,Duma D,et al.Corticosterone modulates noradrenaline-induced melatonin synthesis through inhibition of nuclear factor kappa B[J].J Pineal Res,2005,38(3):182-8.
[13]Bernal-Mizrachi L,Lovly C M,Ratner L.The role of NF-[kappa]B-1 and NF-[kappa]B-2-mediated resistance to apoptosis in lymphomas[J].Proc Natl Acad Sci USA,2006,103(24):9220-5.
[14]O′Keeffe M,Grumont R J,Hochrein H,et al.Distinct roles for the NF-kappaB1 and c-Rel transcription factors in the differentiation and survival of plasmacytoid and conventional dendritic cells activated by TLR-9 signals[J].Blood,2005,106(10):3457-64.
[15]Tripathi D N,Jena G B.Effect of melatonin on the expression of Nrf 2 and NF-kappa B during cyclophosphamide-induced urinary bladder injury in rat[J].J Pineal Res,2010,48(4):324-31.
[16]Katsman A,Umezawa K,Bonavida B.Chemosensitization and immunosensitization of resistant cancer cells to apoptosis and inhibition of metastasis by the specific NF-kappaB inhibitor DHMEQ[J].Curr Pharm Des,2009,15(7):792-808.

