热杀死结核分支杆菌H37Ra诱导的SD大鼠佐剂性关节炎模型研究
陈佩虹,陈育尧,林晓春,苏健淦,佟 丽
在类风湿关节炎(rheumatoid arthritis,RA)的实验研究中,大鼠佐剂性关节炎动物模型(adjuvant-induced arthritis,AA)是常用的经典实验动物模型,我们以热杀死结核分支杆菌 H37Ra(Mycobacterium tuberculosis H37Ra,Mtb)成功诱导SD大鼠AA模型,该模型操作简单、临床症状直观,其机体免疫炎症反应、细胞因子网络及关节病理改变等与人类RA临床症状相似[1]。本项研究在前期研究工作的基础上,对Mtb诱导SD大鼠AA模型的血液学、关节滑膜病理、T细胞功能的改变进行分析,以综合评价该模型与临床RA类疾病的相似性。
1 材料
1.1 动物及分组 SPF级SD大鼠24只,♂,6~8周龄,体质量(280±20)g,由南方医科大学实验动物中心提供,动物合格证号:SCXK(粤)2006-0015。动物饲养条件:清洁通风环境,室温(23±1)℃,湿度(50±5)%,光照周期为12 h,自由饮食。适应性喂养7 d后随机分为两组,正常对照组12只,AA模型组12只。
1.2 实验试剂 热杀死结核杆菌H37Ra,来自Difco实验室(Detroit,MI,USA);矿物油,美国 Sigma公司产品;红细胞裂解液,Andybio公司产品,批号 090618;Pecy7-CD4、FITCCD25、PE-FOXP3 Rat Antibody及同型对照 Mouse IgG1、FOXP3 Fix/Perm Buffer、Cell Staining,均为 Biolegend 公司产品,批 号 分 别 为 B123582、B116371、B119654、B126005、B125798;大鼠淋巴细胞分离液,天津灏洋公司产品,批号20090304;Annexin V-FITC细胞凋亡试剂盒(内含Annexin VFITC、Propidium Iodide 即 PI、Binding Buffer)及 TUNEL 细胞凋亡试剂盒(内含 Equilibration Buffer、Biotin-11-dUTP、TdT Enzyme、50 ×Proteinase K、Streptavidin-HRP、DAB),均为南京凯基公司产品,批号分别为090725、091125;其它化学试剂购自广州试剂公司,均为AR级;Hanks液、PBS液自备。
1.3 器材 TDL-40B台式离心机,上海安亭公司;LG-R-80血液流变仪,北京世帝公司;BH2荧光显微镜,日本OLYMPUS公司;精密天平,德国Sartorius公司;RM2135切片机、EG1160包埋机、图像采集系统,德国Leica公司;950动物血球分析仪,美国DREW公司;520爪肿测试仪,美国IITC公司;FACS Calibur流式细胞仪,美国BD公司。
2 实验方法
2.1 大鼠模型制备[1]
2.1.1 Mtb诱导剂配制 准确称取Mtb,放入高压消毒的研钵中,在无菌条件下,充分研磨,使Mtb的颜色由灰色变为白色,然后加入少量矿物油,使Mtb与矿物油充分混合,再研磨,最后加入矿物油使Mtb质量浓度为5 g·L-1,将该混悬液吸入特制玻璃注射器中,连接两个注射器于三通管上,使Mtb-矿物油混悬液充分混合均匀,备用。
2.1.2 AA模型制作 将模型组动物固定在大鼠固定器上,剃掉尾根部的毛发,以体积分数为75%的乙醇消毒,然后在尾根部经皮下注射Mtb诱导剂(1 mg/只),注射后,立即用消毒棉球压住注射部位,防止液体渗出。对照组大鼠不做任何处理。
2.2 大鼠血常规、全血及血浆粘度测定 SD大鼠免疫后28 d,用质量浓度为100 g·L-1的水合氯醛麻醉大鼠,腹主动脉采血,取抗凝血,检测外周血白细胞总数(WBC)、淋巴细胞总数(LY)、单个核细胞总数(MO)、红细胞总数(RBC)、血红蛋白含量(Hb)、血小板总数(PLT)、红细胞压积(HCT)、全血粘度(BV)、血浆粘度(PV)、红细胞聚集指数(RE)等。
2.3 大鼠外周血淋巴细胞凋亡实验 SD大鼠免疫后16、28 d,用质量浓度为100 g·L-1的水合氯醛麻醉大鼠,腹主动脉采血;取抗凝血与Hanks液1∶1混合,加入到大鼠淋巴细胞分离液面上,离心,分离单个核细胞;用Binding Buffer悬浮细胞,再加入 5 μl Annexin V-FITC 混匀后,加入 5 μl PI,混匀;室温、避光、反应5~15 min;在1 h内,流式细胞术检测AA大鼠模型外周血淋巴细胞凋亡率。
2.4 大鼠外周血调节性T细胞测定 SD大鼠免疫后28 d,用质量浓度为100 g·L-1的水合氯醛麻醉大鼠,腹主动脉采血;取抗凝血 100 μl,加入 20 μl Pecy7-CD4、FITC-CD25 Rat Antibody,对照管加同型对照抗体,室温避光20 min;加入2 ml红细胞裂解液,室温下10 min后离心吸弃上清;Cell Staining悬浮细胞,离心吸弃上清;加入1 ml FOXP3 Fix Buffer,室温避光20 min后离心吸弃上清;FOXP3 Fix Perm Buffer洗两遍并用100 μl该液悬浮细胞,加入 20 μl PE-FOXP3 Rat Antibody,对照管加同型对照抗体,室温避光30 min;用Cell Staining洗1遍并悬浮细胞;流式细胞术检测AA大鼠模型外周血CD4+CD25+FOXP3+T细胞占CD4+T细胞的比例、CD4+CD25+T细胞占CD4+T细胞的比例。
2.5 大鼠膝关节滑膜细胞凋亡实验 SD大鼠免疫后16、28 d,用质量浓度为100 g·L-1的水合氯醛麻醉大鼠,处死大鼠后取双后膝关节滑膜,常规制作石蜡包埋的组织切片并进行脱蜡、水合;PBS漂洗两遍,加入Proteinase K工作液,21℃ ~37℃反应20 min;PBS漂洗两遍,浸入封闭液中10 min;PBS漂洗两遍,样本周围用吸水纸吸干,每个样本滴加50 μl TdT Enzyme反应液,加盖玻片37℃避光湿润反应60 min;PBS漂洗3遍,样本周围用吸水纸吸干,每个样本滴加50 μl Streptavidin-HRP工作液,加盖玻片37℃避光湿润反应30 min;PBS漂洗3遍,样本周围用吸水纸吸干,每个样本滴加100 μl DAB工作液,室温显色反应10 min;PBS漂洗3遍,400倍光学显微镜下观察滑膜细胞阳性表达情况,阳性细胞(即凋亡细胞)为细胞质着色,呈棕黄色或棕褐色。用图像采集系统拍摄,每张切片任选5个视野,用Image-Pro Plus 6.0图像分析软件测量阳性表达面积(Area)和累积光密度值(integrated optical density,IOD),平均光密度值MIOD=IOD·Area-1。
2.6 大鼠膝关节滑膜病理研究 SD大鼠免疫后16、28 d,用质量浓度为100 g·L-1的水合氯醛麻醉大鼠,处死大鼠后取双后膝关节滑膜,固定24 h,石蜡包埋,将组织进行5 μm连续切片,常规HE染色,100倍光学显微镜下观察AA模型膝关节滑膜病理变化:滑膜细胞有无增生、变性,滑膜有无炎性细胞浸润及肉芽组织形成。
3 结果
3.1 AA模型大鼠外周血常规及血液黏度的变化 Tab 1可见,SD大鼠免疫后28 d,WBC、MO上升,LY下降,但与正常组大鼠比较差异均无统计学意义(P>0.05);Hb下降,PLT、HCT上升,与正常组比较差异均有统计学意义(P<0.05)。Tab 2可见,SD大鼠免疫后28 d,BV、PV上升,与正常组比较差异有统计学意义(P<0.05);RE与正常组比较差异无统计学意义。提示SD大鼠在Mtb免疫后期,血液黏度明显上升。
3.2 AA模型大鼠T淋巴细胞凋亡的变化 Tab 3、Fig 1可见(流式图各象限含义:右上区PI+Annexing V+,为晚期凋亡细胞;左下区PI-Annexin V-,为正常细胞;右下区PI-AnnexinV+,为早期凋亡细胞),SD大鼠外周血淋巴细胞凋亡率在免疫后16 d呈倍数升高,免疫后28 d明显下降。表明在整个实验周期内AA大鼠模型外周血淋巴细胞凋亡变化范围较大,且在后期呈现凋亡缺陷,与正常组比较差异有统计学意义(F=48.286,P <0.01)。
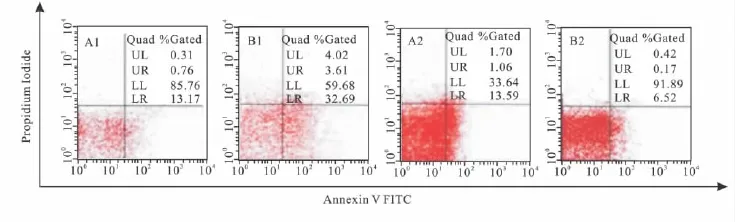
Fig 1 The change of PBL apoptosis ratio after Mtb-immunized adjuvant arthritis in SD rats A1,A2:the control group on the 16 th and 28 th day;B1,B2:the model group on the 16 th and 28 th day
Tab 1 The change of blood routine after Mtb-immunized adjuvant arthritis in SD rats±s,n=6)
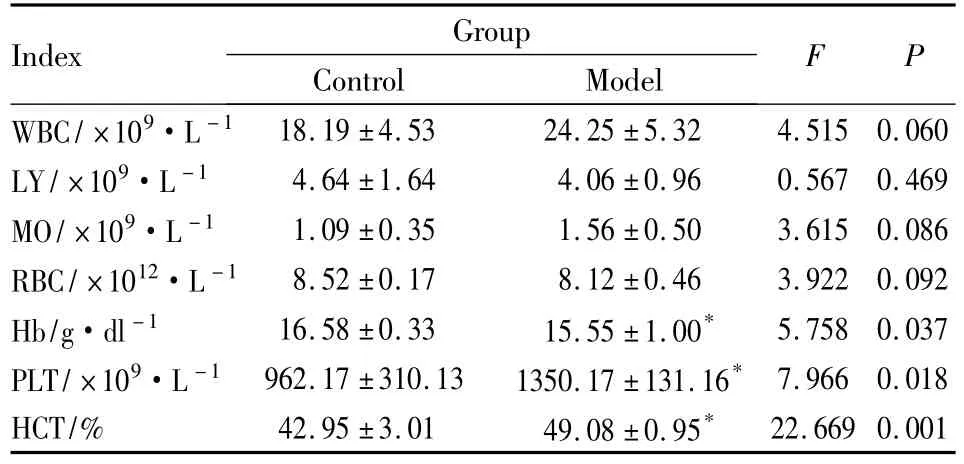
Tab 1 The change of blood routine after Mtb-immunized adjuvant arthritis in SD rats±s,n=6)
*P<0.05 vs control group
Index Group Control Model F P WBC/×109·L-118.19±4.53 24.25±5.32 4.515 0.060 LY/×109·L-1 4.64±1.64 4.06±0.96 0.567 0.469 MO/×109·L-1 1.09±0.35 1.56±0.50 3.615 0.086 RBC/×1012·L-1 8.52±0.17 8.12±0.46 3.922 0.092 Hb/g·dl-1 16.58±0.33 15.55±1.00* 5.758 0.037 PLT/×109·L-1 962.17±310.13 1350.17±131.16* 7.966 0.018 HCT/% 42.95±3.01 49.08±0.95*22.669 0.001
Tab 2 The change of blood rheology after Mtb-immunized adjuvant arthritis in SD rats(±s,n=6)
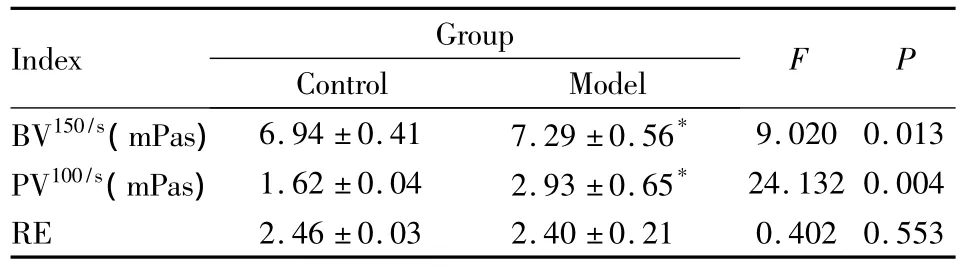
Tab 2 The change of blood rheology after Mtb-immunized adjuvant arthritis in SD rats(±s,n=6)
*P<0.05 vs control group
Index Group Control Model F P BV150/s(mPas)6.94±0.41 7.29±0.56*9.020 0.013 PV100/s(mPas)1.62±0.04 2.93±0.65* 24.132 0.004 RE 2.46±0.03 2.40±0.21 0.402 0.553
Tab 3 The change of peripheral blood lymphocyte(PBL)apoptosis ratio after Mtb-immunized adjuvant arthritis in SD rats± s,n=3)
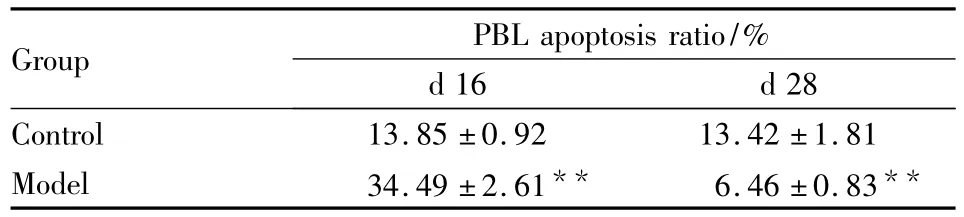
Tab 3 The change of peripheral blood lymphocyte(PBL)apoptosis ratio after Mtb-immunized adjuvant arthritis in SD rats± s,n=3)
Time effect:F=209.388,P <0.01;group effect:F=48.286,P <0.01;time·group effect:F=197.026,P<0.01.**P<0.01 vs control group
Group PBL apoptosis ratio/%d 16 d 28 Control 13.85±0.92 13.42±1.81 Model 34.49±2.61** 6.46±0.83**
3.3 AA模型大鼠调节性T细胞的变化 Tab 4,Fig 2可见(流式图右上区为所检测的CD4+CD25+FOXP3+T细胞及CD4+CD25+T细胞比例),SD大鼠免疫后28 d,外周血CD4+CD25+FOXP3+T细胞占CD4+T细胞的比例、CD4+CD25+T细胞占CD4+T细胞的比例均下降,与正常组比较差异有统计学意义(F=44.966,P=0.003及F=45.521,P=0.003)。表明在SD大鼠免疫后期,外周的调节性T细胞比例水平低下。
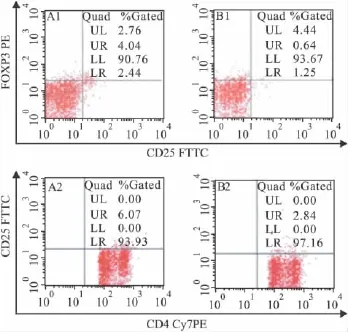
Fig 2 The change of regulatory T cells after Mtb-immunized adjuvant arthritis in SD rats A1/A2:the control group;B1/B2:the model group
Tab 4 The change of regulatory T cells after Mtb-immunized adjuvant arthritis in SD rats±s,n=3)

Tab 4 The change of regulatory T cells after Mtb-immunized adjuvant arthritis in SD rats±s,n=3)
**P<0.01 vs control group
Group CD4+CD25+FOXP3+/CD4+(%)CD4+CD25+T cells/CD4+T cells(%)Control 3.71±0.80 5.34±0.64 Model 0.54±0.20** 2.59±0.34**F 44.933 45.521 P 0.003 0.003
3.4 AA模型大鼠关节滑膜细胞凋亡的变化 Tab 5、Fig 3可见,SD大鼠免疫后16、28 d,关节滑膜细胞凋亡减少,与正常组间比较差异有统计学意义(F=233.398,P<0.01)。表明在实验周期内AA大鼠模型关节滑膜细胞呈现凋亡缺陷。
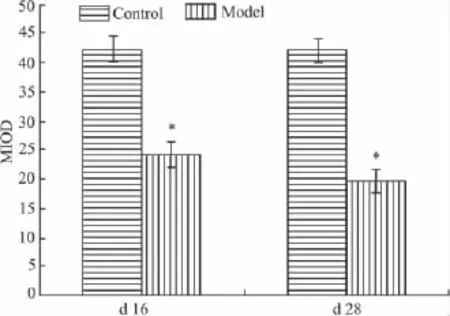
Fig 3 The change of synoviocyte apoptosis after Mtb-immunized adjuvant arthritis in SD rats(n=3)*P<0.05 vs control group
Tab 5 The change of synoviocyte apoptosis after Mtb-immunized adjuvant arthritis in SD rats±s,n=3)

Tab 5 The change of synoviocyte apoptosis after Mtb-immunized adjuvant arthritis in SD rats±s,n=3)
Time effect:F=2.914,P=0.126;group effect:F=233.398,P <0.01;time·group effect:F=2.554,P=0.149.**P <0.01 vs control group.
Group Synoviocyte apoptosis-MIOD(×10-2·μm-2)d 16 d 28 Control 42.07±2.35 41.93±2.04 Model 24.09±2.65** 19.75±2.00**
3.5 AA模型大鼠关节滑膜病理改变 Fig 4 A~D病理切片镜下观察可见:正常组(A)关节滑膜组织平滑光亮,薄而柔润,分布于关节软骨的周缘,分为滑膜衬里层及滑膜衬里下层;滑膜衬里层有1~4层滑膜细胞,细胞排列整齐,表面光滑,无炎性细胞浸润。模型组(B、C、D)关节滑膜组织大多数出现典型的病理改变,滑膜有6~10层甚至20层滑膜细胞,呈轻度到中度变性、中度到极重度异常增生不等,呈短绒毛状或指突状;滑膜有大量炎性细胞浸润,并有肉芽组织形成。
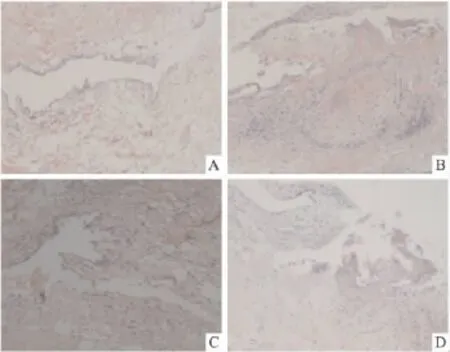
Fig 4 The pathological evidence after Mtb-immunized adjuvant arthritis in SD rats(×100,HE stain)A~D pathological evidence after Mtb-immunized adjuvant arthritis in SD rats.A:the control group;B and C:the model group on 16 th day,D:the the model group on 28 th day,synovial membrane hyperplasia serious and inflammatory cells infiltrated.
4 讨论
4.1 Mtb诱导的SD大鼠佐剂性关节炎模型的特点 本课题组先前研究结果表明[1]用Mtb诱导SD大鼠佐剂性关节炎模型的病情表现及进程与临床RA相近,同时该模型制作方法简单,可重复性强,成模率高,经济实用。
在本项研究中采用相同的模型制作方法,Mtb用量是1 mg/只大鼠,模型成功率为100%,但是模型组炎症出现时间推迟到免疫后第10~13天,炎症高峰出现在免疫后第19~25天,可能是由于本项研究所用SD大鼠的体质量(280 g)超过先前研究时所用大鼠体质量(160 g)所致,建议今后根据所用大鼠的体质量确定Mtb诱导剂的用量。Mtb免疫后期,模型组大鼠出现的症状与之前研究类似,但是限于实验周期,没有根据炎症出现时间推迟而延长观察时间,是本项研究的不足之处。
临床研究表明RA患者大部分存在血液常规异常,贫血占第一位,其次是白细胞减少和血小板增高[2]。血液流变方面,RA患者全血黏度、血浆黏度、纤维蛋白原、免疫球蛋白、血沉均升高,红细胞压积与正常比较差异无显著性[3-4]。本项研究的血液学结果与文献报道有一致之处,但是由于本项研究仅采取了一个时间点的血液学标本,因此只能代表该模型在后期血液学改变,尚不能清楚了解该模型整个病程血液学改变的全貌,有必要在今后研究中进一步观察。
RA是典型的自身免疫性疾病,滑膜细胞和淋巴细胞过度活化、凋亡异常以及滑膜过度增殖是RA发病的重要环节。本结果表明,AA模型大鼠在病程中期外周血淋巴细胞凋亡率急剧升高,后期则比正常水平下降。原因可能是在病理中期外周血淋巴细胞急剧活化、增殖的同时,细胞代偿性凋亡的速度加快;而淋巴细胞代偿性凋亡后至病理后期,细胞凋亡率下降到较低水平出现凋亡障碍。在整个病程中由于淋巴细胞异常活化及凋亡机制障碍,诱导大量炎症因子产生,并通过介导细胞间相互作用,引起组织损伤酶的释放,从而导致关节损伤,引发并促进RA的发生发展。
CD4+CD25+调节性T细胞(Treg)是具有抑制功能的调节性T细胞亚群,约占人和小鼠外周血CD4+T细胞的0.02~0.10[5],这类细胞在维持机体免疫自稳、调控免疫应答方面起重要作用,转录因子FOXP3被认为是CD4+CD25+Treg的特异性标志。在近年的临床研究中,越来越多的证据表明RA患者CD4+CD25+Treg存在异常,但目前国内外对RA患者CD4+CD25+T细胞的研究结果不一致[6]。采用流式细胞术(flow cytometry,FCM)进行细胞内染色检测细胞核内表达的FOXP3分子,在单细胞水平分析FOXP3分子表达,是一种快速、简便的方法。本项研究所采集的标本代表未受药物影响的RA病理后期Treg水平。本结果表明,AA模型大鼠外周血CD4+CD25+FOXP3+细胞占CD4+T细胞比例及CD4+CD25+细胞占CD4+T细胞比例均低于正常组。原因可能是:①因为RA发生,大鼠胸腺功能缺陷导致天然Treg的产生受损;②Treg具有调节效应性T细胞和抗原提呈细胞的功能,Treg向受累的关节内迁移(集聚在关节滑膜内以利于控制局部炎症),导致外周血表达水平降低。
RA最突出的免疫病理基础发生在关节滑膜,病理特征之一为滑膜浸润大量炎性细胞,滑膜细胞增生及血管翳形成,其机制仍未阐明。目前医学界认为RA的发病与细胞凋亡过程异常有关,并有多种细胞参与,包括滑膜细胞、成纤维细胞、淋巴细胞、软骨细胞等。本结果表明AA模型大鼠膝关节滑膜细胞在病理中期及后期的凋亡率均比正常水平降低,表明滑膜细胞存在凋亡缺陷;AA大鼠病理结果显示,膝关节滑膜周围有大量炎性细胞浸润,滑膜增生、变性。
4.2 RA动物模型制备方法的筛选 有研究者提出理想的RA动物模型具备的条件是:①在病原学和发病机制方面与人类相似;②临床表现与组织学改变与人类相似;③模型容易获得,施加相同的实验条件所获得的结果相同;④模型建立后,效果稳定,并且可以长期维持[7]。
本结果结合课题组已有的相关研究成果如模型大鼠的症状、细胞因子水平、T淋巴细胞亚群CD3/CD4/CD8水平、后肢X-射线检测等,综合评价Mtb诱导的AA大鼠模型:该模型材料容易获得,SD大鼠有较高敏感性,制作方法简单;模型建立后维持时间较长;发病原理主要是分子模拟理论,结核杆菌的一个蛋白分子与关节滑膜上的一个糖蛋白分子结构相似,可以被同一株T细胞克隆所识别,从而诱发针对关节的免疫反应;临床表现与组织学改变与人RA相似。目前研究结果提示此模型存在明显的细胞免疫异常,而RA患者多同时表现有体液和细胞免疫功能的异常,关于该模型体液免疫功能是否异常有待后续深入研究。
[1]佟 丽,辛增辉,陈育尧,等.Mtb诱导的SD大鼠佐剂性关节炎模型的建立及评价[J].中国药理学通报,2009,25(2):259-63.
[1]Tong L,Xin Z H,Chen Y Y,et al.Establishment and evaluation of adjuvant-induced arthritis animal model by Mtb in Sprague-Dawley rats[J].Chin Pharmacol Bull,2009,25(2):259-63.
[2]陶丽菊,王小超,陈诗强,等.类风湿性关节炎患者血液学改变特点及其临床意义[J].右江民族医学院学报,2008,30(5):737-8.
[2]Tao L J,Wang X C,Chen S Q,et al.The change patterns of hematology in patients with rheumatoid arthritis and its clinical significane[J].J Youjiang Med Coll Nat,2008,30(5):737-8.
[3]魏金凤,张 力,李艳华.类风湿性关节炎患者血液流变学指标的改变[J].中国血液流变学杂志,2001,11(1):78.
[3]Wei J F,Zhang L,Li Y H.The blood rheology change of rheumatoid arthritis patient[J].Chin J Hemorheol,2001,11(1):78.
[4]帅丽华,卢 敏,胡志坚.血液黏稠度检测在类风湿关节炎中的临床应用[J].江西医学检验,2007,25(6):573-4.
[4]Shuai L H,Lu M,Hu Z J.The clinical application of blood viscosity determination in rheumatoid arthritis disease[J].Jiangxi J Med Laborat Sci,2007,25(6):573-4.
[5]Jonuleit H,Schmitt E.The regulatory T cell family:distinct subsets and their interrelations[J].J Immunol,2003,171(12):6323-7.
[6]陆 翔,赖永榕.类风湿关节炎CD4+CD25+调节性T细胞的表达及其与病情关系探讨[J].广西医科大学学报,2009,26(2):229-31.
[6]Lu X,Lai Y R.Research of relationship between CD4+CD25+regulatory T cells expression and rheumatoid arthritis patients′condition[J].J Guangxi Med Univ,2009,26(2):229-31.
[7]石 磊,李小峰,张莉芸,等.类风湿关节炎动物模型的研究进展[J].中国药物与临床,2009,9(3):215-7.
[7]Shi L,Li X F,Zhang L Y,et al.Research progress of rheumatoid arthritis animal model[J].Chin Remed & Clin,2009,9(3):215-7.

