依托泊苷固体自微乳的研制及大鼠体内生物利用度研究
章 巍,董 蔚,平其能
中国药科大学药剂教研室,南京 210009
依托泊苷(etoposide,VP-16)为鬼臼毒素的半合成产物,属于细胞周期特异性抗癌药物,可能通过直接激活某些内切酶或通过其代谢物作用于S期、G2期的细胞,使细胞分化阻滞于G2期,并与拓扑异构酶Ⅱ结合形成药物-酶-DNA三者之间稳定的可裂性复合物,干扰DNA拓扑异构酶Ⅱ,致使受损的DNA不能修复[1]。目前,依托泊苷是临床上治疗小细胞肺癌、恶性淋巴瘤和睾丸癌的常规用药,同时也可用于治疗急性粒细胞白血病、子宫癌和乳腺癌等多种肿瘤疾病。依托泊苷在水中的溶解度低,37℃时溶解度为 148~153μg·mL-1, 无法满足100 mg/片的剂量溶出时的释药条件;其特性溶出速率每平方厘米仅为0.01 mg·min-1,故溶出过程是其吸收的限速过程之一[2]。自微乳制剂口服后遇体液在胃肠蠕动下自发分散成O/W型微乳。由于微乳粒径小,药物在其中的分散度好,有利于药物的吸收,可以提高药物在体内的生物利用度[3]。与传统的自微乳化制剂相比,固体自微乳制剂具有稳定性增加、贮存时间延长、胃肠道刺激性减少、服用方便等优点,并可通过添加各种固体辅料或采用包衣技术方便地制备缓控释制剂,对难溶性药物而言,是一个极具开发前景的新型制剂[4]。
目前国内外上市的依托泊苷制剂品种主要有注射液和口服软胶囊。VP-16注射液较易引起血液系统及消化系统等不良反应,且不宜静脉推注,静滴时速度不能过快,否则容易引起低血压、喉痉挛等过敏反应;而VP-16软胶囊内容物加水稀释后即析出大量沉淀[5],制剂稳定性有待加强,因此笔者以水难溶性药物依托泊苷为模型制备了具有自乳化性质的固体颗粒,对其体外溶出进行了考察,并对VP-16固体自微乳制剂的大鼠体内药动学进行了初步的研究。
1 材 料
1.1 药品与试剂
依托泊苷原料药(齐鲁制药有限公司);市售依托泊苷软胶囊(批号:100801,连云港恒瑞制药有限公司);注射用中链油(MCT)、长链油(LCT)均购自德国lipoid公司;注射用大豆油(批号:101013,铁岭北亚药用油有限公司);Cremophor®RH40、Cremophor®E L(德国 BASF公司);吐温 80(批号:F 20080203)、微粉硅胶均购自国药集团化学试剂有限公司;聚乙二醇(PEG400,汕头市西陇化工厂有限公司,批号0903041);甲醇(色谱纯);醋酸盐缓冲液(自配);其他试剂均为分析纯;蒸馏水(自制)。
1.2 仪器
高效液相色谱仪(Shimadz uL C-10AT);迪马Diamonsil®C18色谱柱(250mm×4.6m m,5μm);ZRS-8G智能溶出试验仪 (天津大学无线电厂);粒度/Zeta电位测定仪(Marvern Instruments Ltd UK);TGL-16G高速台式离心机(上海医科大学仪器厂)。
1.3 实验动物
健康 Sprague-Dawley大鼠,雄性,体重 200~250g,购自扬州大学比较医学中心;合格证号SCXK(苏)2009-0034;饲养温度(23±2)℃,照明时间为每天 12h。
2 方法和结果
2.1 VP-16固体自微乳制剂的处方及制备工艺研究
2.1.1 VP-16溶解度测定 油相选用 LCT、MCT、大豆油;表面活性剂分别选用Cremophor®EL、Cremophor®R H 40、吐温80;助表面活性剂选用丙二醇、聚乙二醇。测定其饱和溶解度,具体方法为:分别称取上述物质各2 g,加入过量的V P-16,室温搅拌48 h后,3000 r·min-1离心 20min,取上清液 100μL用1000μL甲醇溶解,0.45 μm滤膜过滤,H P L C法进样分析,计算其饱和溶解度。
由表1结果可见,就油相而言,大豆油属长链油,虽然溶解度尚可,但较难微乳化。VP-16在LCT中的溶解度优于MCT,但由于LCT的粘度较大和乳化能力有限,因此选择使用粘度较小、对药物增溶效果好的MCT作为SSMEDDS的油相。表面活性剂中Cremphor®RH40对药物的增溶效果最佳。助表面活性剂中PEG400对VP-16的增溶效果最好,平衡溶解度可达177.588 mg·mL-1。综上所述,油相选择MCT,表面活性剂选择Cremphor®RH40,助表面活性剂选择PEG400进行下一步的试验。

表1 VP-16在不同介质中的溶解度
2.1.2 VP-16自微乳伪三元相图的绘制 将“2.1.1”项下筛选的油相(MCT)、表面活性剂(Cremphor®RH40)和助表面活性剂(PEG400)在不同混合比例下采用滴定法绘制伪三元相图。将Cremphor®RH40和PEG400按照一定的质量比混合,作为Km值(表面活性剂∶助表面活性剂),再和油相按1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1 的比例混合均匀,在搅拌状态下用37℃的蒸馏水进行滴定,肉眼观察,以形成带有蓝色乳光的液体为临界点,记录加入蒸馏水的量,按照Km、油相和水相在临界点时各自的质量分数(w/w),用Origin软件绘制伪三元相图,确定自微乳化的区域。
由图1可见,Km越大形成微乳的范围越广。但是Km逐渐增大,体系中的表面活性剂比例增加,在滴定过程中会出现粘度较大的液晶态,大大延缓体系的自乳化效率。根据伪三元相图的结果将自微乳处方中的Km值定为4∶1,油相的用量为乳化剂和助乳化剂总量的10%。

图1 伪三元相图的制备及自乳化区域的确定
2.1.3 VP-16自微乳的粒径考察 按照前期处方优化结果,称取一定量的MCT、Cremphor®RH40、PEG400混合均匀,再按处方量比例称取VP-16原料药置于混合油相中,在70℃水浴中加热并搅拌,使药物完全溶解,放凉至室温即得VP-16自微乳溶液。
以蒸馏水为稀释介质,将VP-16自微乳最优处方稀释100倍后形成的微乳,测定其粒径和Zeta电位,测得3组微乳处方中,平均粒径最小的为(21.8±1.5)nm,多分散指数为 0.359±0.009。
2.1.4 固体吸附材料的选择 在PEG6000、乳糖、微晶纤维素(MCC PH101)、甘露醇、柠檬酸和微粉硅胶等常用水溶性和水不溶性固体吸附材料中,以最大吸附量作为考察指标,选择依托泊苷自微乳的固体吸附剂。具体方法:分别称取1 g不同种类的固体吸附材料,逐滴加入液体自微乳,边加边混合均匀,使得药液完全吸收成为干燥的粉末,当粉末稍有潮湿时,认为已经达到吸附饱和,记录此时所吸附的VP-16自微乳的量作为该吸附材料的最大吸附量。
由图2可见,水不溶性吸附材料微粉硅胶的吸附能力明显强于其他水溶性材料,达3.08 g·g-1,从后期开发方面考虑,本实验选择微晶纤维素作为固体吸附材料。

图2 不同固体材料对液态自微乳制剂的饱和吸附量(n=5)
2.1.5 VP-16固体自微乳制剂的制备工艺 按表2所示,精密称取处方量的油相、表面活性剂和助表面活性剂置于烧杯中,涡旋使混合均匀成淡黄色透明的空白自微乳。精密称取处方量的VP-16原料药置于上述空白自微乳中,涡旋使药物均匀分散,并于70℃水浴中加热使药物溶解,待完全溶解后取出,于室温下放置,即成VP-16自微乳。加入适量水于上述VP-16自微乳中,边加边搅拌,至形成一种粘度较高的乳剂。称取处方量的固体吸附材料,以上述高粘度乳剂作为粘合剂制软材,所得软材挤压过18目筛制颗粒,并于50℃烘箱中干燥至恒重,经20目筛整粒,收集。
2.1.6 VP-16固体自微乳制剂的溶出度考察 按《中国药典》2010年版溶出度测定第二法进行。溶出介质:恒温蒸馏水 900 mL;水浴温度:(37±0.5)℃;转速:50 r·min-1。投药量为含有50 mg VP-16的固体自微乳制剂和市售制剂依托泊苷软胶囊 (1颗,50 mg), 分别于 2、5、10、15、20、30、45、60 min 取样 5 mL,并同时补充同温度的新鲜溶出介质5 mL,样品经0.45 μm微孔滤膜过滤后,取续滤液20μL经HPLC法测定,并计算累积溶出百分率。
由图3溶出曲线可知,与市售制剂依托泊苷软胶囊相比,自微乳制剂均可以提高VP-16的溶出速度和程度,使其在45 min之内达到溶出度95%以上。

图3 VP-16固体自乳化制剂的体外溶出曲线(n=3)
2.2 VP-16血浆样品分析方法
2.2.1 色谱条件 色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm);检测波长:254 nm;流动相:甲醇-醋酸盐缓冲液(60∶40);流速:1 mL·min-1;柱温:30℃;进样量:20μL。
2.2.2 大鼠血浆样品处理方法 精密移取100μL血浆,加入氯仿 1 mL,涡旋 5 min,4000 r·min-1离心10 min,取下层有机相,45℃空气吹干,加入 100μL流动相复溶,涡旋 10 min,4000 r·min-1离心 10 min,取上清液进样。
2.2.3 血浆标准曲线的建立及方法学的验证 取VP-16储备液,用流动相稀释成浓度为50、100、500、1000、5000、10000、25000 ng·mL-1的标准溶液。取具塞离心管7只,精密移取上述标准溶液各100μL,45℃空气吹干,加入100μL空白血浆,涡旋5 min,按“2.2.1”及“2.2.2”项下处理进样,将所得峰面积与浓度进行线性回归,绘制标准曲线。分别取VP-16标准溶液适量,用大鼠空白血浆配制成低、中、高三个浓度(50、1000、25000 ng·mL-1)的样品,按“2.2.1”及“2.2.2”项下处理进样,考察方法学的回收率与精密度。
实验得到的标准曲线方程为:A=5.886×104C-6.682×103,r=0.9999(n=7),表明在 50~25000 ng·mL-1质量浓度(C)范围内,依托泊苷的质量浓度与峰面积(A)线性关系良好。同时,平均提取回收率在75%~85%,而方法回收率为93%~97%,日内和日间精密度(RSD)均小于5%,因而该方法符合生物样品的分析要求。
2.3 大鼠体内药动学实验
取雄性Sprague-Dawley大鼠18只,随机分为3组,按照20 mg·kg-1[1]分别灌服给予VP-16固体自微乳制剂、市售制剂依托泊苷软胶囊和原料药混悬液。 分别于 0.25、0.5、0.75、1、2、3、4、6、8、12、24 h大鼠眼眶后静脉丛取血约400μL,置于肝素化离心管中,4000 r·min-1离心 10 min,分离血浆,置于-20℃冰箱保存。血浆样品按“2.2.2”项下方法处理样品,按“2.2.1”项下条件进样分析,测定血药浓度。
由图4血药浓度-时间曲线可见,自制固体自微乳制剂40 min后血药浓度可达峰值,比原料药吸收更迅速,和市售制剂几乎同时起效。由表3药动学参数结果可以得出,VP-16固体自乳化制剂的半衰期和MRT较原料药的长,而较市售软胶囊的短。比较AUC发现,VP-16制成固体自微乳化制剂后AUC与原料药相比有了显著的提高,相对生物利用度为148%;而与市售制剂相比,其相对生物利用度为116%。
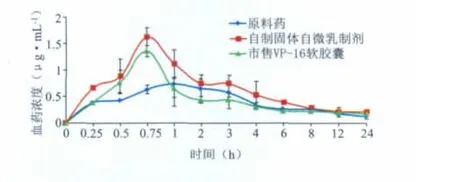
图4 VP-16原料和各制剂经大鼠灌胃给药后的血药浓度-时间曲线

表3 VP-16原料及各制剂经大鼠灌胃给药后的药动学参数(n=6)
3 讨 论
在伪三元相图制备过程中发现,当体系刚开始用蒸馏水滴定时,由于含水量很少,均可以形成油包水的乳剂或微乳,表现为一种透明的或略带乳光的油状液体。一些油相含量较高,且Km较小的体系继续加水变为浑浊的乳白色液体,表明未形成微乳;而油相含量较低,且Km较大的体系继续加水后会变成有蓝色乳光的透明或半透明的微乳液,从外观上判断可认为形成了水包油型的微乳。
由于微粉硅胶作为固体吸附剂时在制粒过程中成形性较差,不利于后期的加工,而微晶纤维素作为一种高度多孔性颗粒或粉末,本身具有良好的吸附性,再加上分子结构中具有众多的亲水性羟基,使得其吸附自微乳后所得的粉末对于药物的溶出几乎没有影响[4]。另外,微晶纤维素是文献报道[5]使用最多的辅料,具有良好的可塑性和成球性,便于后期开发应用,综合上述实验结果,因而选择微晶纤维素作为固体吸附材料制备自微乳化颗粒。
在体外溶出度实验中,两种制剂在水中溶出行为产生差别的原因可能是:VP-16市售软胶囊内容物加水稀释后析出沉淀[5],从而导致溶出后期累积溶出百分数有所下降。
研究表明,采用微乳化技术可提高难溶性药物的口服生物利用度[6-8],其机理主要有以下几个方面:利用油、表面活性剂等成分增加药物的溶解度并改善溶出度;自发形成的细小乳滴具有巨大的比表面积,增加了药物在胃肠道上皮细胞的渗透性;微乳乳滴较低的表面张力和较强的亲水性使其易于通过肠腔黏膜上侧的水化层,使药物可以直接和胃肠道上皮细胞接触,促进药物的吸收;常用的非离子表面活性剂可以抑制一些外排蛋白对药物的外排,进而增加吸收;微乳中的脂质在胰酶和胆汁的作用下发生脂解,形成粒径更小的微乳乳滴和胆盐胶束,可以进一步增加药物的溶解度和促进药物的跨膜吸收转运;处方中的脂质成分可以经肠道淋巴管吸收,减小药物的首过效应,提高生物利用度。
4 结 论
本文制备了VP-16固体自微乳制剂,其溶出度在45 min时达到95%以上。大鼠灌胃给药后其生物利用度较原料药和市售软胶囊均有所提高。同时,从溶出度实验中可见,市售软胶囊在溶出过程中析出大量沉淀,而VP-16固体自微乳制剂则可在释放介质中稳定存在,由此推测市售软胶囊制剂在口服进入机体后,也可能析出大量沉淀,药物富集于胃肠道中,致使生物利用度较低,因而容易引起胃肠道副反应。依托泊苷固体自微乳制剂经口服后,在胃肠蠕动和体液环境下自发形成微乳,并迅速分散到整个胃肠道,吸收面积加大,促进了其吸收进入体循环的速度,进而可能提高了其生物利用度,并降低对胃肠道的副作用。
[1]Slevin ML.The clinical pharmacology of etoposide[J].Cancer,1991,67(1):319-29.
[2]黄爱文,平其能.依托泊苷固体分散体的溶出与大鼠在体肠吸收研究[J]. 中国新药杂志,2007,17(19):1663-7.
[3]张桂侠,杜 青.依托泊苷自微乳的处方研究[J].河北医科大学学报,2008,29(3):401-3.
[4]程玉钊,周建平,吕慧侠.固体自乳化药物传递系统的研究概况[J]. 药学进展,2008,32(2):68-74.
[5]郭胤仕,于海建,邢祖林.低剂量口服依托泊苷治疗晚期肺癌[J]. 中国新药与临床杂志,2002,21(2):119-21.
[6]Vijaykumar N,Pradeep K,Raghavendra P,et al.Solid self-microemulsifying formulation for candesartan cilexetil[J].AAPS Pharm Sci Tech,2010,11(1):9-17.
[7]Kawakami K,Yoshikawa T,Hayashi T,et al.Microemulsion formulation for enhanced absorption of poorly soluble drugs II in vivo study[J].J Controlled Release,2002,81(1-2):75-82.
[8]Trevaskis NL,Charman WN,Porter CJH.Lipid-based delivery systems and intestinal lymphatic drug transport:A mechanistic update[J].Adv Drug Deliv Rev,2008,60(6):702-16.

