单一试剂连续监测法测定α-L-岩藻糖苷酶
王祖莲
(石屏县人民医院,云南 石屏 652200)
AFU是1种溶酶体酸性水解酶,分类名为α-L-岩藻糖苷水解酶 (EC 3.2.1.51)[1]。自从1980年法国学者Deugnier等报道原发性肝癌(PHC)的病人血清AFU活性升高,并经国内外研究证实,已确认AFU是PHC高灵敏的特异性标记物。建立1种方便适用的AFU检测方法尤为重要。
用于AFU测定的方法主要有2类:(1) 以4-甲基伞型酮-α-L-岩藻吡喃糖苷为底物的荧光法[2]。(2) 以对硝基苯-α-L-岩藻糖苷为底物的比色法[3]。前者检测灵敏度高,适用于微量样品及低活性样品的检测,但此法步骤繁琐,又需要荧光光度计,常规应用受到限制。后者是目前临床实验室主要采用的方法,在酸性时AFU水解对硝基苯-α-L-岩藻糖苷产生对硝基酚,水解反应完成后,需用碱性缓冲液终止反应并显色,此测定原理决定了测定为2点终点法,且需设样品空白以去除本底的干扰,操作较繁琐。
随着新合成底物2-氯-4-硝基苯-α-L-岩藻糖苷(CNP-AFU)的出现,以此为底物的速率法也叫连续检测法,近年来普遍应用于临床实验。CNP-AFU速率法采用单一试剂,有较高的灵敏度和精密度,较强的抗干扰性,线性反应时间长,试剂稳定性好。本实验采用了此种方法原理,研究了一些检测条件,建立了单一试剂连续监测法测定α-L-岩藻糖苷酶。
材料和方法 岛津UV-2401PC分光光度计,Cole Parmer pH计,CB171半自动生化仪,HITACHI 7060全自动生化仪。
试剂:基质缓冲液:0.1MMES-NaOH(以下简称MES缓冲液):无水2-N-吗啉乙磺酸(MES, C6H13NO4S, MW=195.2) 19.52g, NaCl 8.5g,NaN30.3g,蒸馏水溶解,用0.1MNaOH溶液调pH为4.8,置于冰箱保存。CNP标准溶液:5.0mmol/LCNP标准溶液,准确称取0.0434g 2-氯-4-硝基苯酚(CNP,C6H4ClNO3,MW=173.56,上海二医大化学教研室提供),用基质缓冲液溶解,配成50ml 5.0mmol/L标准液,置于棕色瓶放冰箱保存。基质溶液 (1.2g/L):准确称取 CNP-AFU(C12H14ClNO7,MW=319.75,上海二医大化学教研室提供)0.3g,用MES基质缓冲液溶解,并加至250毫升容量瓶刻度,置于棕色瓶瓶放冰箱保存。
样本 健康人血清(正常组);PHC患者血清(病理组)。干扰物质 抗坏血酸、胆红素、血红蛋白。
方法原理 用2-氯-4-硝基苯-α-L-岩藻糖苷在AFU催化下,分解成α-L-岩藻糖苷和2-氯-4-硝基苯酚,37℃时在波长405nm处可使吸光度值增加,连续监测吸光度值的变化,可计算出样品中AFU的活性。测试参数:温度为37℃;波长λ=405nm,试剂样品比10∶1,延迟时间60s,测定时间120s。使用如公式计算:
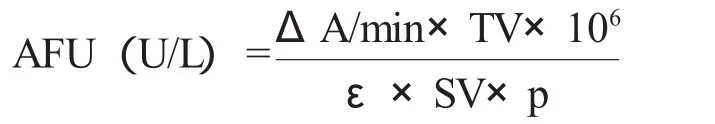
注:ΔA/min:每分钟吸光度变化值;106:将mol换算成μmol;SV:样本体积;TV:反应总体积;ε:产物CNP的摩尔吸光系数;p:比色杯光径。
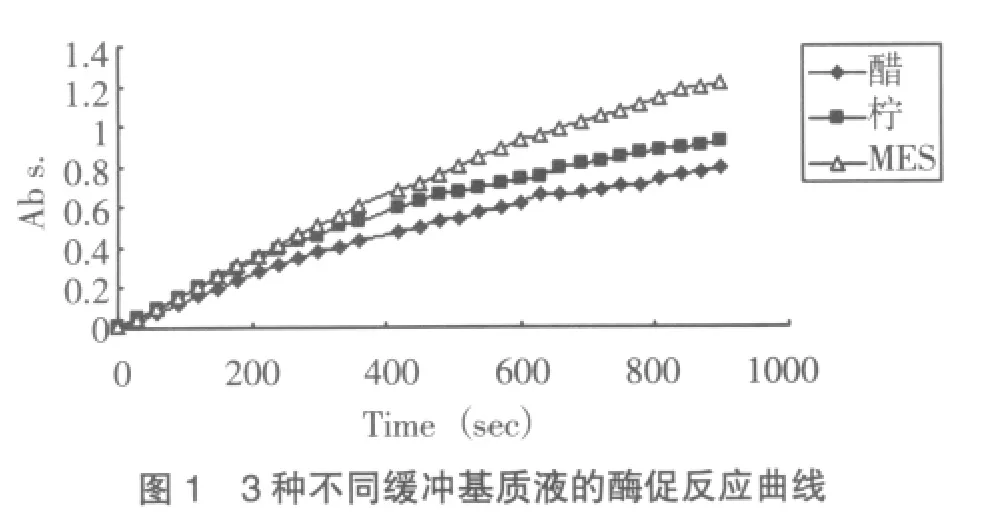
结 果 1.反应体系缓冲液选择 分别以pH5.0,0.1mol/L的柠檬酸、醋酸、EMS缓冲液配制相同浓度底物基质液,测定同一人血清样品。在酶促反应经时曲线和反应线性稳定性方面,MES缓冲液为最佳(见图1),所以实验选用MES缓冲体系。
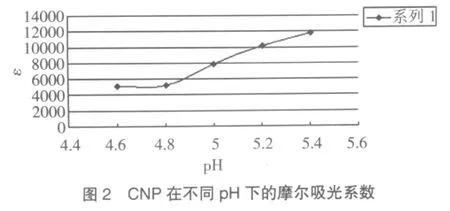
2.CNP摩尔吸光系数:对溶于pH4.6~5.4、0.1mol/L的MES缓冲液中的0.05mmol/L CNP,测定其在波长405nm的吸光度,得到CNP在不同pH处的摩尔吸光系数,见图2。在此pH范围内,CNP在405nm的吸光度是随着pH增大而增大。
3.最适pH的确定 选择5种不同pH值(4.6~5.4) 的MES缓冲液,分别配制浓度为5 mmol/L的5种基质液。对同一样本,分别用这5种基质液测得不同pH下的ΔA/min,再以上面的摩尔吸光系数算出酶活性,见表1。当pH=4.8时,测定的酶活性最大,故选择体系的最适pH是4.8。
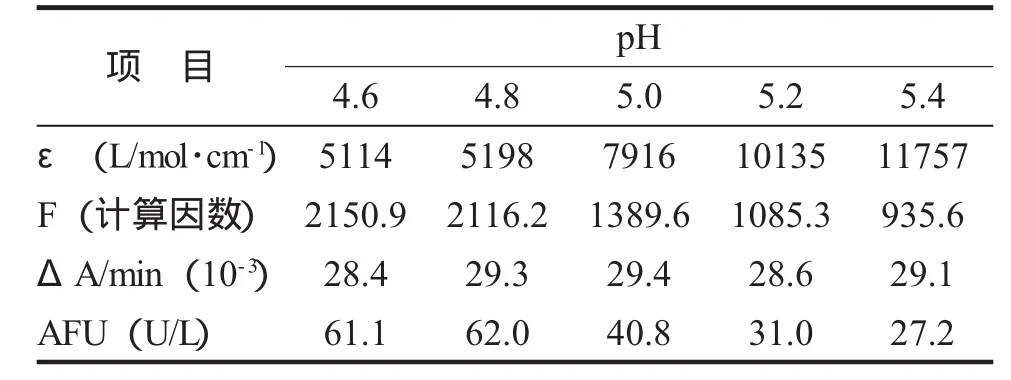
表1 同一样本在不同pH下酶促反应及酶活性
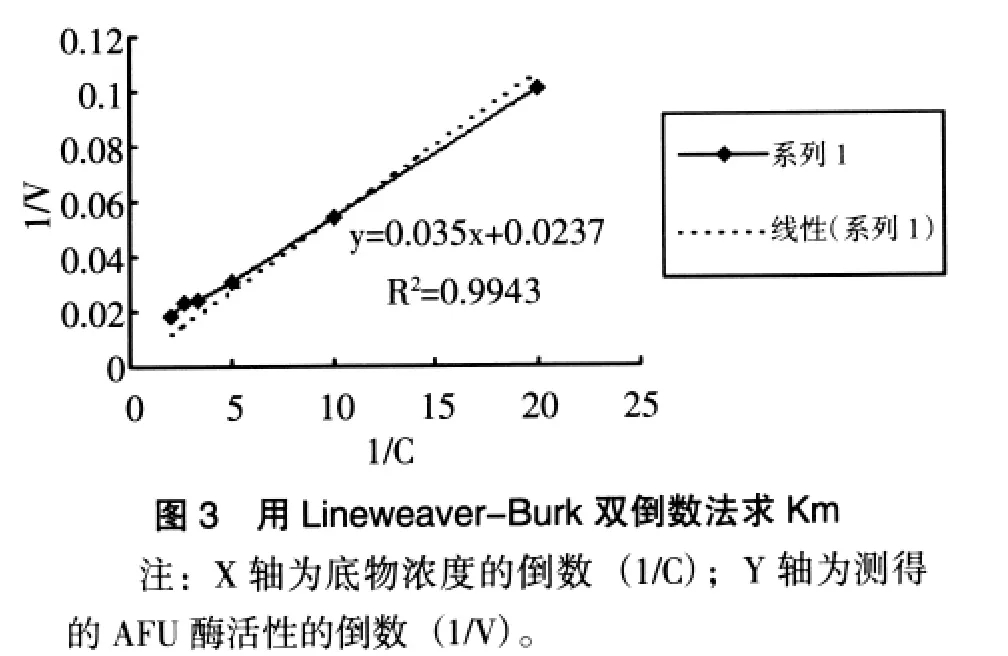
4.底物浓度的确定 以pH4.8的EMS缓冲液配制系列底物浓度 (0.05、0.10、0.20、0.30、0.04、0.5mmol/L) 基质液,在其他条件不变下,用速率法测定同样本AFU酶活性。以Lineweaver-Burk双倒数法作图求出Km值为0.148mmol/L(见图 2,是斜率除以截距,即0.0035÷0.0237≈0.148)。根据米曼氏方程,确立本实验的底物浓度为3.75mmol/L,大约是25倍Km值。
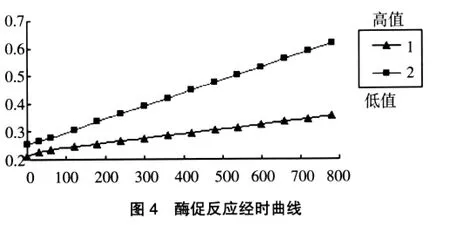
5.酶促反应经时曲线观察及延迟时间和测定时间的确定 以pH4.8、0.1mol/L的EMS缓冲溶液,配成3.75mmol/L的基质溶液,在分光光度计上,取高低2个不同的样本(20,60U/L) 连续扫描800s,观察酶促反应的吸光度变化,从图4可看出延迟时间60s后,整个曲线均匀上升,酶促反应线性时间可达到10min。因此,根据大量的实验结果表明,此速率法的延迟时间确定为60s,测定时间确定为120s。
6.基质液稳定性 将底物浓度为3.75mmol/L的基质溶液,分别置于4℃和37℃避光存放。测定0、1、3、5、7和15d时的基质液空白吸光度,结果表明,置于37℃时,基质液只能保存3d;而存放4℃的基质液在15d内其空白吸光度的变化不大,仍可使用。
7.批内重现性 分别对低、中、高值血清重复7次测定,统计均值,标准查和变异系数,来观察CNPF速率法的批内重现性,结果表明此法批内重现性良好(平均cv2.1%),符合临床诊断试剂的要求(表2)。
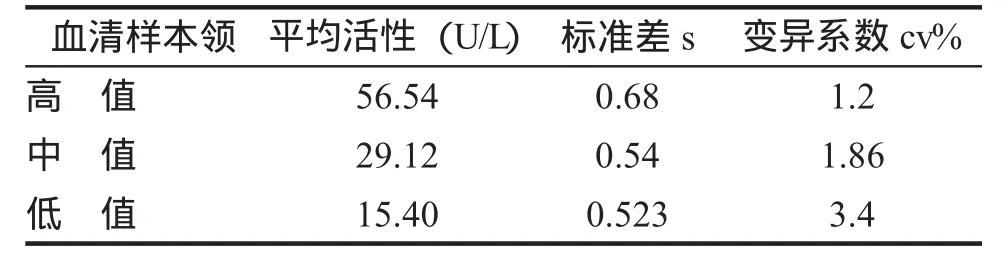
表2 CNPF速率法的内变变异(n=7)
8.抗干扰性能 考虑到人体样本中潜在的干扰物质,对3种可能存在的干扰物质进行了抗干扰性试验,结果发现140mg/L胆红素、350mg/L血红蛋白和6g/L抗坏血酸对AFU酶活性的测定无显著影响。说明该法有较强的抗干扰能力。
9.临床正常和病理组的检测 上述建立的AFU速率法在HITACHI7060自动分析仪上测定了120例健康者和35例经临床确诊为PHC患者的血清AFU。经t检验p<0.001,2组有显著性差异。(见表 3)

表3 正常和病理组的检测
讨 论 1.速率法相比其他检测法具有明显的优点:(1) 新型底物CNP-AFU的出现,是近年来CNPF速率法迅速得以建立,并逐渐普及于临床应用。因为CNPF法所采用的显色原是CNP,其解离常数kPa为5.5,接近于AFU的最适pH值。该pH环境下CNP在405nm处能较好的呈色,无需做样品空白,克服了PNPF方法的缺陷,便于自动分析仪的应用。
(2) 实验进行3种缓冲液体系的筛选,众多实验结果表明:醋酸缓冲液对有些样品产生副作用,发现样品加入醋酸缓冲基质液后变混浊,反应曲线下滑,无法检测样品的活性。柠檬酸缓冲液的体系下,酶促反应的线性时间稍短(约为3min),另外柠檬酸缓冲基质液的稳定性不好。MES为Goods氏系列缓冲剂之一,也是主要的生物缓冲剂。本法选用MES-NaOH缓冲体系,其优点在于:①MES缓冲液对样品无副作用;②在MES缓冲体系下,产物CNP的摩尔吸光系数较高,反之计算因数较低,提高了测试的精密度。③酶促反应的线性时间长(大于10min),提高了速率法在临床应用的可信度。④本实验测得在MES缓冲体系下,AFU酶的Km值为0.148mmol/L,较李兴民等人[4]的研究结果低,使得底物浓度降低,底物的水解速度减少,增加了试剂的稳定性。
(3)实验进行了抗干扰性的研究,结果发现,6g/L抗坏血酸、140mg/L胆红素、350mg/L血红蛋白对AFU酶活性的测定不产生干扰,总体的抗干扰能力与李兴民等人[4]报道建立的方法相当。
2.临床检测方面:(1) 研究发现,溶血的血清样本明显提高AFU测定值,且随着溶血程度的加深,AFU增高幅度变大。可能是红细胞释放的某些成分的干扰,因此在临床应用中注意。在样本的收集和处理时切勿使样本溶血,收到样本后应尽快分离血清并低温保存,以免影响测定结果。至于溶血使AFU升高的确切机制尚待进一步探索。
(2)由于AFU的各同功酶的活性不一,导致人群中AFU含量的变化幅度较大。实验表明,大约4%正常人血清AFU活性低于1U/L,但也有个别样本超出正常范围。本文的正常参考值范围为(21.6±3.94)U/L,比文献值[4]略低,且范围略小。有报道[5],正常人群中血清AFU活性较低者的白细胞AFU活性正常;还特别指出,在临床检测中如遇到AFU活性极低者,不要轻易排除(如对肝癌等诊断) 或肯定(如对岩藻糖苷贮积病的诊断)某疾病的可能性,最好同时检测被检测对象白细胞岩藻糖苷酶的活性,再作定论。
(3)本文建立的AFU速率检测法经过在临床上的初步应用,PHC病人血清的AFU活性明显高于健康者,而且研究结果显示AFU对PHC阳性率高达90%。倘若AFU和AFP联合检测,预计对PHC的检出率可达95%以上。
[1]王坤,施前.实用诊断酶学[M].第2版.上海:上海医科出版社,2000:12.
[2]WOODS.Asensitive flourimetric assayfor α-L-fucosidase[J].ClinchimActa,1975,58:251-256.
[3]TROOST J,VAN DER HEIJDEN MC,STAAL GE.Characterization of alpha-L-fucosidase from two different families with fucosidosis[J].ClinchimActa,1976,73:329-346.
[4]李兴民,司伊康,杨树德.新色原底物的合成及α-L-岩藻糖苷酶速率检测法[J].中华医学检验杂志,1999,22:157-160.
[5]张进平,钟金慧.溶血对α-L-岩藻糖苷酶测定的影响[J].中西医结合杂志,2000,9:1030-1031.

