多烯磷脂酰胆碱注射液对大鼠局灶性脑缺血的保护作用
殷 彦 聂亚雄 朱云龙 尹 剑
南华大学附属第一医院神经内科 衡阳 421001
流行病学调查研究[1]显示:血液中亚油酸含量低,会增加缺血性脑卒中的风险。多烯磷脂酰胆碱注射液是从大豆中提取的磷脂精制而成,富含大量的多不饱和脂肪酸,主要成分有亚油酸(约占70%)、亚麻酸和油酸。目前该药物主要用于治疗各种类型的肝病,能否用于缺血性脑卒中的预防及治疗,尚未见详细报道。本研究根据大脑中动脉闭塞模型(middle cerebral artery occlusion,MCAO),探讨多烯磷脂酰胆碱注射液对缺血性脑损伤的保护机制。
1 材料和方法
1.1 药品及主要试剂 多烯磷脂酰胆碱注射液(成都天台山制药有限公司提供,商品名:易善复),大鼠神经元特异性烯纯化酶ELISA试剂盒和肿瘤坏死因子-αELISA试剂盒(美国RD)。
1.2 实验动物与饲养条件 健康雄性Sprague-Dawley大鼠30只,体质量250~300g,由南华大学动物实验部提供(许可证号:湘SCXK2004-0009),自由进食普通颗粒饲料,饮用自来水,动物房内温度控制在20℃左右,正常昼夜节律。
1.3 栓线及脑缺血模型的制作
1.3.1 栓线的制作:采用单丝尼龙鱼线,鱼线直径为0.24 mm,火烧线头一端使之圆钝直径(0.32±0.02)mm,在距线头18mm、20mm及25mm处用记号笔标记,碘伏浸泡消毒后置于肝素纳中备用。
1.3.2 脑缺血模型:参照Longa法[2]略加修改制作大脑中动脉闭塞模型。大鼠称质量后用10%水合氯醛腹腔注射麻醉,仰卧固定于手术台上,备皮、消毒,取右侧旁正中切口,长约2cm,钝性分离肌肉,充分暴露右侧颈总动脉、颈外动脉、颈内动脉及颅底附近向外走行的翼颚动脉。于翼颚动脉下套线(可不结扎),结扎颈外动脉近分叉处及距分叉10mm处颈总动脉,并在颈总动脉近分叉处套线,用动脉夹夹住颈内动脉,并在距分叉处5mm的颈总动脉上用1mL注射器挑破一小口,插入栓线,通过分叉处时松开动脉夹,继续向颈内动脉处推进,并提拉翼鳄动脉,调整栓线进入方向,插入深度距分叉处约(18.2±0.5)mm,将栓线与颈总动脉固定,彻底止血后缝合肌肉、皮肤,腹腔内注射庆大霉素8000U/kg预防感染,放回饲养笼精心喂养。假手术组操作同上,但不插入栓线。
1.4 神经功能评分 参照Longa5级评分法[2]:0分:无神经功能缺损症状;1分:不能完全伸展左侧前爪;2分:向左侧旋转;3分:行走时向左侧倾倒;4分:不能自行行走,有意识障碍。选取神经功能评分为2分者进入实验研究。
1.5 实验分组及给药方法 将神经功能评分为2分的18只脑缺血大鼠随机等分为模型组、早期药物干预组、晚期药物干预组。模型组:持续给予与药物等量的生理盐水,共5 d;早期药物干预组:造模评分后2h开始给药,连续给药3d,后2d给予等量生理盐水;晚期药物干预组:造模评分后2h开始给予等量生理盐水;术后第3天开始给药,连续给药3 d。术后第6天清晨进行神经功能评分及标本收集。药物剂量:多烯磷脂酰胆碱注射液80mg/(kg·d)。
1.6 血清NSE和TNF-α含量检测 实验终点,心脏取血2 mL,4℃下静置30min后,以1500r/min离心10min,收集血清,参照试剂盒说明检测NSE和TNF-α含量。
1.7 统计学方法 采用SPSS 13.0统计软件进行数据处理;计量资料以均数±标准差表示,采用单因素方差分析,多重比较用LSD-t检验;神经功能评分以中位数及四分位数间距(M±QR)表示,采用秩和检验及完全随机设计多个样本间的比较,以P<0.05为差异有统计学意义。
2 结果
2.1 造模结果 参照Longa法[2]略加修改成功制作大脑中动脉闭塞模型30只SD大鼠,术后神经功能评分2分者18只,神经功能评分3分6只,神经功能评分4分4只,神经功能评分1分2只,神经功能评分0分0只。
2.2 神经功能评分 实验结束后,进行神经功能评分,模型组、早期药物干预组与晚期药物干预组3组间比较差异无统计学意义(P>0.05)。见表1。
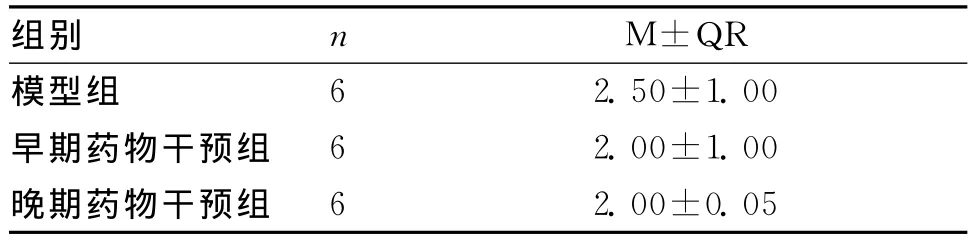
表1 各组神经功能评分
2.3 血清NSE和TNF-α含量 血清NSE含量和TNF-α含量比较,模型组与早期药物干预组、晚期药物干预组间,比较差异有统计学意义(P<0.05);早期药物干预组与晚期药物干预组间比较,差异无统计学意义(P>0.05)。见表2。
表2 各组血清NSE和TNF-α含量(ng/mL,)
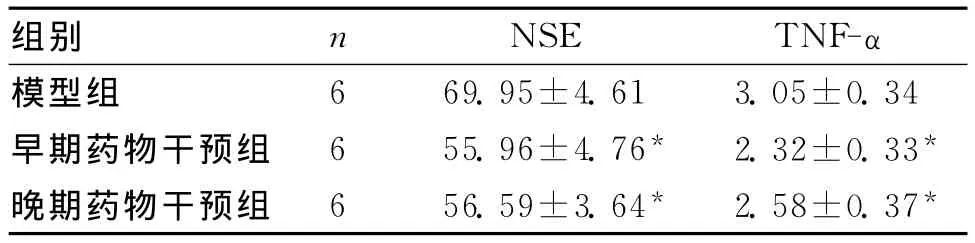
表2 各组血清NSE和TNF-α含量(ng/mL,)
与模型组比较,*P<0.05
组别 n NSE TNF-α模型组6 69.95±4.61 3.05±0.34早期药物干预组 6 55.96±4.76* 2.32±0.33*晚期药物干预组 6 56.59±3.64* 2.58±0.37*
3 讨论
NSE存在于全身各个系统中,主要分布于神经元和神经内分泌组织细胞胞浆和树突的胞质中。大量动物模型及临床实验证明,血液中NSE水平与脑梗死体积及脑损伤程度密切相关,是可用于判断缺血性脑卒中急性期脑损伤程度及预后的可靠指标[3-4],本研究亦支持血液中NSE含量较神经功能评分敏感。本研究参照Longa法[2]并略加修改制作MACO,对NSE的含量进行分析,发现无论早期还是晚期对局灶性脑缺血大鼠注射多烯磷脂酰胆碱注射液,均能明显降低NSE水平,我们有理由支持多烯磷脂酰胆碱注射液有助于缺血性脑损伤的治疗。
众所周知,在缺血性脑损伤中炎症级联反应起到推波助澜的作用,其中TNF-α是最早产生并发挥作用的促炎细胞因子,是炎症反应的始动因素[5],Manolescu BN[6]等采用病例-对照研究发现:脑梗死患者血浆中TNF-α含量显著高于正常人群,Tuttolomondo A[7]等也发现 TNF-α促进动脉粥样硬化,降低血管弹性,增加急性缺血性脑卒中的风险。Haile WB[8]等研究显示:TNF-α增加 Bcl-2的表达,促进细胞的凋亡,参与脑梗死发病过程。本研究通过检测血浆中TNF-α含量,发现使用多烯磷脂酰胆碱注射液后,血液中TNF-α的含量明显降低,表明该药物能够通过减少炎症介质的产生,在改善脑梗死预后中起到一定作用。
多烯磷脂酰胆碱注射液在缺血性脑损伤中的保护机制,可能还涉及:(1)减少氧化应激,Aleynik SI等[9]发现多不饱和脂肪酸通过下调CYP2E1减少氧化产物,提升GSH,并能维持及提升膜蛋白相关蛋白及酶,包括NA+-K+-ATP酶和腺苷酸环化酶,维持体内氧化-抗氧化防御体系的平衡;(2)降低甘油三酯和总胆固醇,减少动脉粥样硬化;(3)降低血压[10];(4)改善糖耐量[11];(5)是体内各种生物膜的重要组成部分,维持生物膜的稳定性,保证体内各种结构及功能的完整性。
目前多烯磷脂酰胆碱注射液是消化科治疗肝病的一种常用药物,并未在神经内科对缺血性脑血管病中得到应用,本研究实为常用药物跨临床科室间应用的一种尝试,由于样本数量及实验条件等限制,我们无法检测血液及脑脊液中多烯磷脂酰胆碱注射液的浓度,故该研究有一定的局限性。值得关注的问题是多烯磷脂酰胆碱注射液的主要成分是亚油酸,其属于(n-6)类脂肪酸,是促炎物质花生四烯酸的前体物质,多烯磷脂酰胆碱注射液在早期是否有促炎性作用,本研究尚未涉及。但目前尚无确切的证据表明(n-6)类脂肪酸类能够拮抗(n-3)类脂肪酸的抗炎作用,且越来越多的研究支持(n-6)类脂肪酸与(n-3)类脂肪酸共同作用,能减少炎性介质的产生,降低炎症反应,且优于其中任意一种[12-13]。
[1]Hiroyasu I,Shinichi S,Utako U,et al.Linoleic acid,other fatty acids,and the risk of stroke[J].Stroke,2002,33:2086-2093.
[2]Longa EZ,Weinstein PR,Carlson S et al.Reversal middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[3]Wockt GC,Roberil RD.Neuron specific enolase serum level after cont roled corial impact injured in the rat[J].Neurotrum,2001,8(5):569-573.
[4]Kaca-Oryńska M,Tomasiuk R,Friedman A.Neuron-specific enolase and S100Bprotein as predictors of outcome in ischaemic stroke[J].Neurol Neurochir Pol,2010,44(5):459-463.
[5]GuY,Kuida K,Tsutsui H,et al.Activition of interferon-γinducing factor mediated by interlekin-1βconverting enzyme[J].Science,1997,275(5297):206-209.
[6]Manolescu BN,Berteanu M,Dumitru L,et al.Dynamics of inflammatory markers in post-acute stroke patients undergoing rehabilitation[J].Inflammation,2010,30(1):211-216.
[7]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Immuneinflammatory markers and arterial stiffness indexes in subjects with acute ischemic stroke[J].Atherosclerosis,2010,213(1):311-318.
[8]Haile WB,Echeverry R,Wu F,et al.Tumor necrosis factorlike weak inducer of apoptosis and fibroblast growth factor-inducible 14mediate cerebral ischemia-induced poly (ADP-ribose)polymerase-1activation and neuronal death[J].Neuroscience,2010,171(4):1256-1264.
[9]Aleynik SI,Leo MA,Takeshige U,et al.Dilinoleoylphosphatidylcholine is the active antioxidant of polyenylphosphatidylcholine[J].Investig Med,1999,47:507-512.
[10]Folsom AR,Ma J,McGovern PG,et al.Relation between plasma saturated fatty acids and hyperinsulinemia[J].Metabolism,1996,45:223-228.
[11]Van Dam RM,Rimm EB,Willett WC,et al.Dietary patterns and risk for type 2diabetes mellitus in U.S.men[J].Ann Intern Med,2002,136:201-209.
[12]Pischon T,Hankinson SE,Hotamisligil GS,et al.Habitual dietary intake of n-3and n-6fatty acids in relation to inflammatory markers among US men and women[J].Circulation,2003,108:155-160.
[13]James AH,Cecilia JH.Brain uptake and utilization of fatty acids,lipids and lipoproteins:Application to neurological disorders[J].J Mol Neurosci,2007,33:2-11.

