无巨核细胞条件下促血小板生成素对骨髓基质细胞纤维形成的影响*
沈建良,黄友章,尹文杰,岑 坚,郑培浩,宫立众,刘 毅
(海军总医院血液科,北京 100048)
动物实验和临床应用已证实,体内应用促血小板生成素(thrombopoietin,TPO)可致骨髓纤维化或骨硬化[1-4]。TPO致骨髓纤维化的机制,目前仍未完全阐明。许多细胞因子,包括转化生长因子-β1(transforming growth factor-β1,TGF-β1)、血小板衍生生长因子、嗜碱性成纤维细胞生长因子、白细胞介素-1(interleukin-1,IL-1)等参与TPO诱导的骨髓纤维化和骨硬化,现认为TGF-β1发挥着枢木丑作用[5]。TGF-β1是一种多效性的细胞因子,既能刺激基质细胞产生细胞外基质,又能促进抑制基质降解的蛋白酶产生。TGF-β1由多种细胞系分泌产生,但主要由单核细胞-巨噬细胞系统和巨核细胞-血小板系统分泌产生。研究表明,单核细胞-巨噬细胞系统在TPO诱导的骨髓纤维化中不起关键作用[3],而一些证据支持巨核细胞-血小板系统在骨髓纤维化发生中的关键作用[6-7]。现认为,TPO是通过与骨髓巨核细胞的TPO受体结合,刺激巨核细胞产生TGF-β1、IL-1和基质细胞活化蛋白等因子,作用于基质细胞,促进纤维化和骨硬化的形成。但是,巨核细胞的存在对于TPO所致的骨髓纤维化形成是否必需,即无巨核细胞存在时TPO能否直接刺激骨髓基质细胞纤维形成,这一问题尚未见文献报道。明确上述问题,对于进一步阐明TPO致骨髓纤维化的机制,寻找骨髓纤维化新的治疗靶点,具有重大意义。为此,作者在体外培养条件下,观察了TPO对基质细胞增殖,细胞外基质形成以及胶原合成和表达的影响。
1 材料与方法
1.1 细胞来源和分组培养
采集健康无血液病患者骨髓细胞(实验标本共10例),制备骨髓单个核细胞(BMMNC)悬液。用改良Dexter培养法[8]进行培养,即 IMDM(Iscove’s Modified Dulbecco Medium,美国G ibco)内含20%胎牛血清(fetal bovine serum,FBS,美国Stemcell)下称基础培养液、3×108/L BMMNC。培养形式分三种,一种是25 cm2培养瓶,每瓶5ml;另一种是24孔培养板,每孔1 ml;第三种是24孔玻片培养板(实验前先在培养板的孔内加入12 mm×0.14 mm圆形玻片),每孔1 ml。置37℃、5%CO2细胞培养箱(RMI3000S-7-VBA,美国)中培养,2 d后用磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗,去除非贴壁细胞。再次加入基础培养液后,进行如下分组实验:对照组(C组):仅加基础培养液;实验1组(T1组):基础培养液内加入2μg/L重组人促血小板生成素注射液(recombinant human thrombopoietin,rhTPO,中国沈阳三生制药有限责任公司生产);实验2组(T2组):基础培养液加入20μg/L rhTPO;实验3组(T3组):基础培养液加入200μg/L rhTPO;实验4组(T4组):基础培养液内加入2000μg/L rhTPO。
培养过程中,每3 d换液1次。细胞汇合达80%~90%时(即培养的 14 d、21 d、28 d、35 d),用胰蛋白酶(美国 R&D)-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA,中国汕头化学试剂厂),(0.25%胰蛋白酶、0.02%EDTA)消化细胞。各组所有细胞分瓶重新悬浮于基础培养液内,按上述分组培养体系继续传代培养。最长培养时间为42 d(第4代)。Ⅲ型前胶原蛋白检测组第28天时终止培养(第2代细胞)进行检测。
1.2 相对增殖指数检测
按上述方法培养的5组细胞,在第14天时行四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT,美国Fluka)检测,以观察不同TPO浓度对细胞相对增殖指数(relative proliferation index,RPI)的影响。
将C组和T3组培养14 d,21 d,28 d,35 d和42 d的细胞,常规胰酶-EDTA消化。取含细胞浓度5×107/L的基础培养液200μl,接种于96孔培养板中,37℃,5%CO2条件下培养3 d后,行MTT试验,以观察同一TPO浓度作用不同时间对RPI的影响。
MTT试验:每孔加入MTT(0.5 g/L)溶液20μl,孵育4h,400×g离心5 min,弃孔内培养液,每孔中加入150μl二甲基亚砜(dimethyl sulfoxide,DMSO,美国Baker),振荡 10min。酶联免疫检测仪(BHL21Elx800,美国)于570nm处测定各孔光密度值(optical density,OD)。
RPI=(实验组OD-对照组OD)/对照组OD
1.3 纤维连接素、层粘素和Ⅳ型胶原检测
在培养的42 d内,每培养7 d,取C组和 T3组24孔培养板内玻片上细胞,用免疫组化试剂盒(中国北京中杉金桥生物技术有限公司)检测纤维连接素、层粘素和Ⅳ型胶原。按亲和-生物素复合物(avidin-biotin complex,ABC)免疫组化技术操作,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,酒精脱水,二甲苯透明封片观察。以 PBS代替一抗,设阴性对照。阴性反应时,细胞标本呈现浅褐色(-);阳性反应时,细胞标本呈现褐色(+)或深褐色(++)。
1.4 Ⅲ型前胶原蛋白检测[9]
取对照组、T1组和 T3组培养第28天的细胞(第2代细胞),调整细胞悬液浓度1.0×104/ml,接种1滴于特殊进口培养皿中央孔中,每组3皿。待细胞贴壁后,加入基础培养液,孵箱培养24h。PBS清洗,70%冰乙醇固定,置4℃冷育30min。PBS清洗,各加入50μl 10%FBS封闭非特异性抗原,室温20min。加入1∶400鼠抗人Ⅲ型胶原单克隆抗体(英国Abcam)10μl,置 4℃湿盒,冷育 24h。PBS清洗,加入1∶8异硫氰酸荧光素(fluorescin iso-thiocyanate,FITC)标记的羊抗鼠单克降抗体(美国Jackson lab)40μl,置4℃湿盒,冷育12 h。将标记好的细胞标本依次置于ZeissLSM510META激光共聚焦显微镜上,测定细胞内被标记的Ⅲ型前胶原蛋白的荧光强度(仪器参数如下:Scan Mode:Plane;Scaling:X:0.88μm,Y:0.88μm;Stack Size:X:900μm,Y:900μm;Scan Z oom:1.0;Objective:ECPlan-Neofluar 10×/0.30M27;Average:Line 2;Pinhole:Ch2:170μm;Filters:Ch2:BP 505-530;Beam Splitters:MBS:HFT488,DBS1:Mirror,DBS2:Mirror,FW1:None;Wavelength:488 nm,80.2%)。选取细胞区域,仪器自动读出荧光强度值(每平方微米数值),取3皿之平均值作为该例标本的荧光强度值。共检测10例。
1.5 统计学处理
2 结果
2.1 不同浓度TPO对基质细胞 RPI的影响
细胞培养体系内加入2μg/L至200μg/L TPO作用14 d时,随着体系内加入TPO浓度的增加,RPI也增高(P<0.01),但剂量高于200μg/L后,这种作用不明显(P>0.05)。说明在一定浓度下,TPO对基质细胞有增殖刺激作用(图1)。

Fig.1 Effects of different concentration of rhTPO on RPI of bone marrow stromal cells
2.2 同一TPO浓度不同培养时间对基质细胞RPI的影响
细胞在200μg/L TPO的作用下,培养14 d,21 d,28 d,35 d,42 d,常规胰酶-EDT A消化,重新悬浮于基础培养液再培养3 d,行MTT试验。结果表明细胞培养体系内含200μg/L的TPO时,在14 d至42 d内各时间点基质细胞RPI差异不明显(P>0.05,图2)。
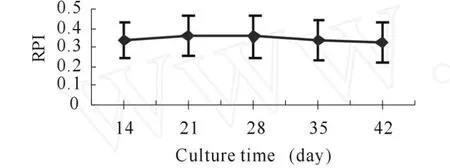
Fig.2 Effects of different exposure time on RPI of bone marrow stromal cells at the same rhTPO concentration
2.3 基质细胞纤维连接素、层粘素和Ⅳ型胶原表达
14 d至42 d的贴壁细胞,进行纤维连接素、层粘素和Ⅳ型胶原检查,对照组与各实验组均有阳性表达,实验组细胞阳性强度(++)高于对照组细胞阳性强度(+),这些分子的表达强度并没有随着培养时间的延长而增强。培养14 d时免疫组织化学检查结果见图3。
2.4 TPO对基质细胞Ⅲ型前胶原蛋白合成的影响
本实验成功地用荧光清晰标记并显示出了基质细胞(成纤维细胞)内的Ⅲ型前胶原蛋白,详见图4。对照组、T1组和T3组的平均荧光强度值分别为(922.15±167.87)、(1099.49±113.29)和(1231.62±193.73)(每平方微米数值,共10例)。T1组与对照组比较,差异显著(t=2.77,P=0.0126),T3组与对照组进行比较,差异非常显著(t=3.82,P=0.0013),T1组和T3组比较,差异不显著(t=1.86,P=0.079)。说明TPO能促进基质细胞内Ⅲ型前胶原蛋白的合成,这种作用的强弱与TPO浓度相关性不强。
3 讨论

Fig.3 Immunohistochemical examination of bone marrow stromal cells on day 14(10×100)

Fig.4 Fluorescence in bone marrow stromal cells in group C,T1 and T3
TPO除能调节巨核细胞的增殖、分化、成熟并分裂形成有功能的血小板外,也能促进脐血造血干/祖细胞体外扩增,增加粒单系、红系等集落生长,增加细胞及细胞总数,有效扩增脐血细胞为巨核前体细胞及巨核系集落形成[10]。TPO体内应用后产生骨髓纤维化已被人们认识,但一般认为是通过巨核细胞等系统产生各种细胞因子介导的,TPO对骨髓基质细胞(主要为成纤维细胞)有无直接的刺激作用,尚未见研究报道。
本研究表明,TPO可刺激基质细胞增殖,RPI随TPO浓度增加而增强,不随作用时间延长而增加。推测机制为一旦静止的基质细胞被TPO激发进入增殖周期,就能维持这种活性。TPO剂量增加,被激发进入细胞增殖周期的细胞数量也增加,故TPO对基质细胞RPI的作用与剂量相关,与作用时间无关。但基质细胞增殖活性提高是否会促进骨髓纤维化形成,尚无研究资料。
我们的实验发现,纤维连接素和层粘素染色在对照组与实验组均显示为阳性,但实验组细胞阳性更强,且这种阳性并没有随着培养时间的延长而增强。正如大家所知,纤维连接素是结缔组织的主要成份之一,也是成纤维细胞的趋化和活性因子。层粘素是细胞外基质的主要结构分子,也是重要的信号分子。这两种分子表达增加说明TPO可直接刺激骨髓基质细胞产生细胞外基质。另外,TPO作用后基质细胞内Ⅲ型前胶原蛋白合成增加,Ⅳ型胶原表达也增加,证明TPO能直接刺激骨髓基质细胞胶原合成和分泌。
我们的体外实验表明,TPO除通过巨核细胞系统产生的细胞因子作用于基质细胞外,也能直接刺激基质细胞,促进纤维形成。我们推测,基质细胞表面可能也具有TPO受体,但这需进一步实验证实。另外,基质细胞是由多种类型细胞组成的复杂细胞群,TPO也可能先作用于其中的某些细胞,使其产生多种细胞因子,进而作用于成纤维细胞,促进其纤维形成。将来应进一步检测培养液内 TGF-β1、IL-1等细胞因子的含量,以证实这一推断。
感谢中国沈阳三生制药有限责任公司为本实验提供重组人促血小板生成素注射液。
[1]Yanagida M,Ide Y,Imai A,et al.The role of transforming growth factor-βin PEG-rHuMG DF-induced reversible myelofibrosis in rats[J].Br J Haematol,1997,99(4):739-745.
[2]Kakumitsu H,Kamezaki K,Shimoda,K,et al.Transgenic mice overexpressing murine thrombopoietin develop myelofi-brosis and osteosclerosis[J].Leu Res,2005,29(7):761-769.
[3]Wagner-Ballon O,Chagraoui H,Prina E,et al.Monocyte/macrophage dysfunctions do not impair the promotion of myelofibrosis by high levels of thrombopoietin[J].J Immunol,2006,176(11):6425-6433.
[4]Douglas V K,Tallman M S,Crige L D,et al.Thrombopoietin administered during induction chemotherapy to patients with acute myeloid leukemia induces transient morphologic changes that may resemble chronic myeloproliferative disorders[J].Am J Clin Pathol,2002,117(6):844-850.
[5]Chagraoui H,K omura E,Tulliez M,et al.Prominent role of TGF-β1 in thrombopoietin-induced myelofibrosis in mice[J].Blood,2002,100(10):3495-3503.
[6]Martyre M C,Romquin N,Le Bousse-Kerdiles M C,et al.Transforming growth factor-βand megakaryocytes in the pathogenesis of idiopathic myelofibrosis[J].Br J Haematol,1994,88(1):9-16.
[7]Villeval J L,Cohen-solal k,Tulliez M,et al.High thrombopoietin production by hematopoietic cells induces a fatal myeloproliferative syndrome in mice[J].Blood,1997,90(11):4369-4383.
[8]黄友章,杨平地,沈建良,等.来源于骨髓和脐带血的基质细胞基本特性的比较[J].北京医学,2002,24(6):399-402.
[9]杨东元,罗锦辉,高建华,等.分类检测定量病理性瘢痕成纤维细胞内前胶原蛋白方法的改进与探讨[J].中国美容医学,2000,9(6):407-409.
[9]Piacibello W,Sanavio F,Garetto L,et al.Differential growth factor requirement of primitive cord blood hematopoietic stem cell for self-renewal and amplificationvsproliferation and differentiation[J].Leukemia,1998,12(5):718-727.

