99Tcm-硫化铼胶体用于前哨淋巴结检测的生物实验——注射剂量与明胶浓度的影响
李洪玉,梁积新,罗洪义,陈宝军,杨春慧,郑德强
(中国原子能科学研究院同位素研究所,北京 102413)
前哨淋巴结(SLN)是接受原发肿瘤淋巴回流的第一个或笫一组淋巴结,是最早可能发生肿瘤转移的特异淋巴结。放射导向的前哨淋巴结活组织切片检查(SLNB)是一种在早期乳腺癌和黑色素瘤处置方面被广泛认可的技术,尤其在肿瘤发病初期,用于检测位于隐匿性区域的前哨淋巴结并对其是否发生癌转移进行评估,对治疗方案的选择具有重要意义[1-6]。
目前用于SLNB的放射性显像剂主要是纳米型药物,有99Tcm-硫化铼胶体、99Tcm-经过滤的硫胶体和99Tcm-HSA[7]。这类显像剂在前哨淋巴结的摄取是基于淋巴结对药物微粒的生理俘获,这是一个可饱和的过程,药物颗粒的大小和给药区域的表面性质会影响药物从注射点引流至毛细淋巴管的速率及淋巴结巨噬细胞吞噬药物的速率。比如,分子颗粒较大时,药物进入淋巴内皮细胞的速率会相对慢些,而其在注射点和前哨淋巴结的滞留会相对多些;微粒直径在20 nm以下的分子则不适于前哨淋巴结显像,因为它们会很快被引流至下一级淋巴结。颗粒度为100 nm左右的胶体药物颗粒较易进入到毛细淋巴管并被巨噬细胞吞噬而滞留在淋巴结,而更大的颗粒则会被胞间隙俘获。因此,该类药物可能存在一些缺点,如:在注射点有高浓集、分子颗粒大小不均、易发生放射性从SLN到2LN的迁移等[8]。99Tcm-硫化铼胶体是一种粒径范围在20~400 nm,并在100 nm有较高分布的药物。
本工作拟采用药盒法制备99Tcm-硫化铼胶体,并将其稀释后再注入小鼠体内,考察注射剂量及稳定剂浓度对99Tcm-硫化铼胶体在小鼠淋巴结放射性摄取及体内生物分布的影响,为开发新型淋巴结显像药物提供参考。
1 实验材料
1.1 主要仪器
99Mo-99Tcm发生器:原子高科股份有限公司产品;FH 463A自动定标器、FT-603型闪烁探头:北京核仪器厂产品;CRC15R 放射性活度计:美国CAPINTEC公司产品;微量注射器:美国Hamilton公司产品。
1.2 主要试剂
1.3 实验动物
Balb/C 小白鼠:60只,雄性,18~22 g,清洁级,由中国医学科学院实验动物研究所提供。
2 实验方法
2.1 99 Tcm-硫化铼胶体室温稳定性
将标记溶液原液于室温下静置5 h,分别于1、2、3、4、5 h采用纸层析分析法分析其放化纯度。
2.2 注射剂量对生物分布的影响
用生理盐水注射液对99Tcm-硫化铼胶体溶液进行 10、100、500、715倍稀释 。
将60只Balb/C小白鼠随机分为5个剂量组,每剂量组12只,每剂量组又分为两组(每组6只),分别于给药后1、4 h处死。每组小鼠由后脚垫皮下注射5μL99Tcm-硫化铼胶体及不同稀释倍数99Tcm-硫化铼胶体稀释液,99Tcm-硫化铼胶体的注射剂量依次为0.343、3.43×10-2、3.43×10-3、6.86×10-4、4.80×10-4μg,按摩脚掌0.5 min;在给药一侧的脚垫处皮下注入专利蓝溶液,再按摩脚掌0.5 min,以便解剖时获取淋巴结位点。注入专利蓝溶液10 min后处死小鼠,取腘窝淋巴结(SLN)、腰淋巴结(次级淋巴结,2LN)、注射点(后足)、肝、脾、血 ,测量放射性计数,计算放射性摄取率(%ID/g)及腘窝淋巴结提取率,计算公式如下:

腘窝淋巴结提取率体现了药物在第一淋巴结滞留的比率,该值越大,说明药物向下一级淋巴结迁移的可能性越小。
2.3 注射体积的影响
Balb/C小白鼠12只,随机分为2组(每组6只),将上述进行715倍稀释的溶液再稀释4倍,之后由小鼠后脚垫皮下注射20μL,分别于注后1、4 h处死小鼠,其它步骤同2.2节。比较注射化学量为4.80×10-4μg时,注射体积为5μL和20μL对99Tcm-硫化铼胶体生物分布的影响。
2.4 明胶浓度的影响
用浓度为3 g/L的明胶溶液对标记原液进行100倍的稀释,溶液中明胶浓度约0.03 g/L。取12只Balb/C小白鼠,随机分为2组,每组6只,由小鼠后脚垫皮下注射5μL该稀释液,分别于注射后1、4 h处死小鼠,其他步骤同2.2节。考察注射剂量为3.43×10-3μg时,明胶浓度对99Tcm-硫化铼胶体生物分布的影响。
3 结果与讨论
3.1 99 Tcm-硫化铼胶体室温稳定性
99Tcm-硫化铼胶体溶液室温放置5 h,放化纯度未见下降低,均在95%以上。
3.2 生物分布
99Tcm-硫化铼胶体的注射剂量对其在小鼠淋巴结及体内分布的影响列于表1。腘窝淋巴结提取率随注射剂量及时间的变化列于表2。
表1 注射剂量对小鼠体内生物分布的影响(,n=6)

表1 注射剂量对小鼠体内生物分布的影响(,n=6)
注射后时间 组织放射性摄取率/(%ID·g-1)反应原液 稀释10倍 稀释100倍 稀释500倍 稀释715倍SLN 5.59±0.84 2.86±0.77 2.77±0.99 2.11±0.11 1.76±0.70 2LN 4.07±0.75 1.04±0.39 0.71±0.55 0.29±0.10 0.54±0.22 1 h 注射点 49.12±3.11 46.25±3.84 64.45±2.88 67.86±2.34 66.02±3.19肝 11.78±1.73 2.29±0.57 1.57±0.37 0.98±0.10 1.15±0.27脾0.26±0.01 0.07±0.01 0.13±0.04 0.12±0.03 0.14±0.08血2.25±0.13 0.74±0.10 0.72±0.14 0.88±0.10 0.66±0.18 SLN 8.47±2.13 5.63±1.34 5.05±0.93 2.04±0.47 1.88±0.28 2LN 4.89±1.19 1.19±0.19 0.84±0.44 0.47±0.06 0.36±0.14 4 h 注射点 48.61±3.27 52.43±2.52 64.15±3.85 70.65±3.10 71.12±1.63肝9.65±1.44 2.54±0.30 1.66±0.79 0.97±0.11 0.95±0.18脾0.24±0.04 0.07±0.01 0.15±0.04 0.14±0.03 0.17±0.04血1.15±0.07 0.50±0.28 0.69±0.23 0.88±0.11 0.81±0.23
表2 注射剂量对腘窝淋巴结提取率的影响(,n=6)

表2 注射剂量对腘窝淋巴结提取率的影响(,n=6)
腘窝淋巴结提取率/%注射后时间反应原液 稀释10倍 稀释100倍 稀释500倍 稀释715倍1 h 27.2 63.6 74.4 86.3 69.3 4 h 42.3 78.9 83.4 77.0 80.9
由表1可知,注射99Tcm-硫化铼胶体原液后,近50%的99Tcm-硫化铼胶体滞留在注射点处,(由粒径较大的药物颗粒引起),但这并不影响未滞留的药物进入淋巴引流至SLN,在SLN的摄取于注射后4 h约8.5%,此时淋巴结处于一种过饱和状态,因此不能滞留的药物颗粒会经淋巴管进入血液,并最终停留在肝和脾内,因此肝的摄取率较高。
注射稀释后的标记溶液后,被注射的药物颗粒数降低,则在前哨淋巴结的摄取未达到饱和状态,因此腘窝淋巴结的放射性会相应降低,且仅有少量胶体颗粒会进入血液,因此,肝和血液中的摄取也相应减少。
由表2可以看出,腘窝淋巴结提取率随剂量减小而升高,且随时间延长升高。
注射体积及明胶浓度对99Tcm-硫化铼胶体在淋巴结及小鼠体内分布的影响列于表3。明胶是一种分散剂,在NANOCIS?药盒中起着稳定剂的作用,用于防止胶体颗粒相互聚集形成聚合体,而大颗粒的聚合体往往会滞留在注射点并造成注射点的高浓集,这也是稀释后注射点的滞留反而会增大的原因。由表3可知,将溶液中明胶的浓度由0.03 g/L增加至3 g/L时,SLN的放射性摄取有大幅提高,但2LN的放射性摄取同时也有较大提高;肝摄取上升了近10倍;注射点的放射性摄取降低,给药4 h后,降低更为明显,由64.15%降至 41.77%。注后1 h,腘窝淋巴结提取率的降低显著,由74.4%降至27.2%。
在同一个时相,注射体积由 5μL增加到20μL时,SLN的放射性摄取有所降低,在注射4 h后由1.88%ID·g-1降至1.08%ID·g-1;在注射点的浓集则有约5%的增加;腘窝淋巴结提取率在注后1 h基本不变,而在注后4 h,由80.9%降至52.8%。这是由于单位体积内药物颗粒数降低,在前哨淋巴结的摄取不能达到饱和状态,因此腘窝淋巴结的放射性会相应降低,且仅有少量胶体颗粒会进入血液,因此,肝和血液中的摄取也相应减少。
注射体积增大,过量的溶剂会对淋巴结产生占位饱和效应,使得其对药物的摄取降低,另外,在动物脚掌这样一个相对狭小的范围里皮下注射,注射的体积过大,不利于药物的吸收,且容易引起注射点发炎渗水的现象。因此,应在合理范围内尽可能减少注射体积。
表 3 注射体积及明胶浓度对体内分布的影响(,n=6)
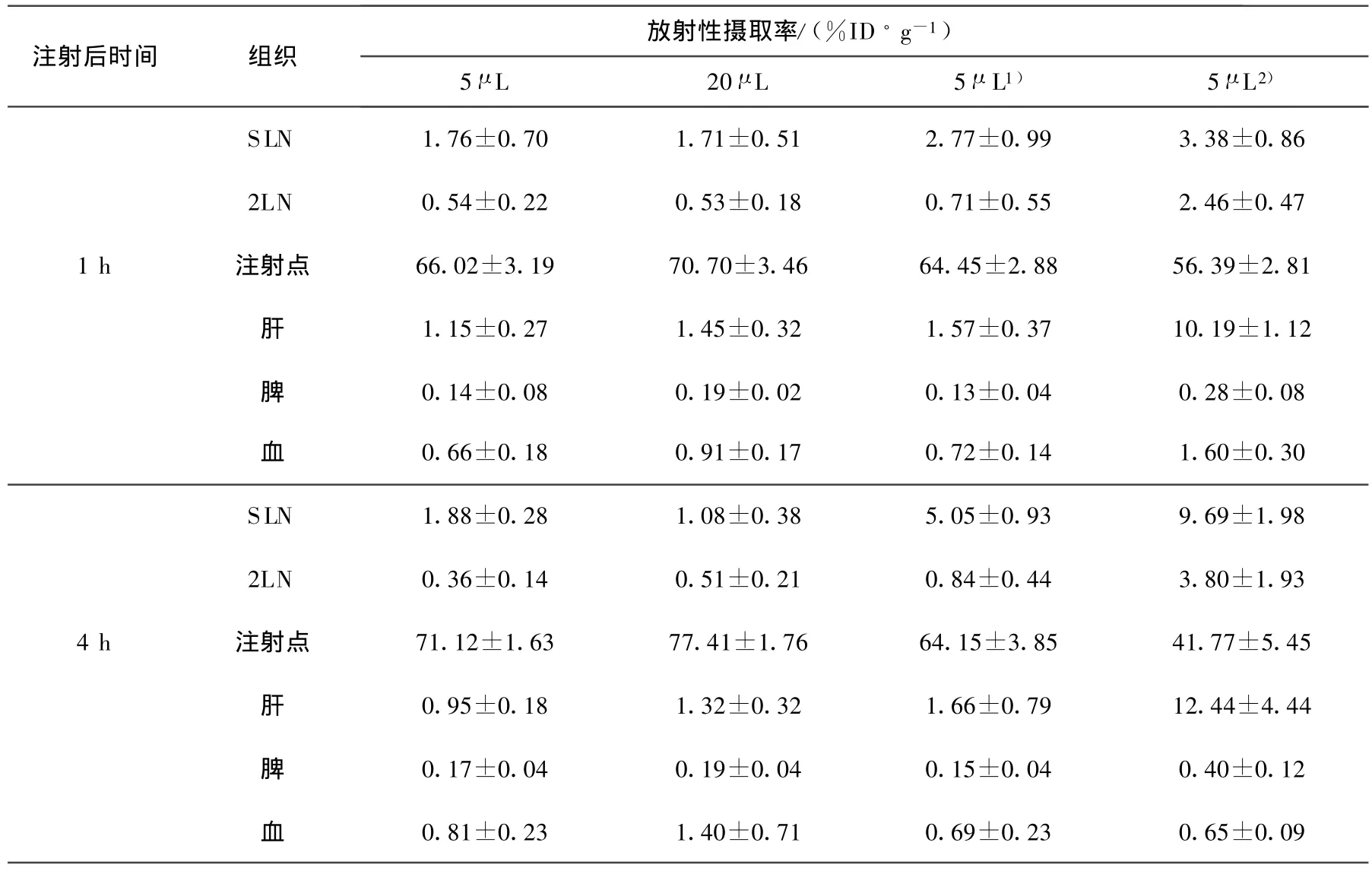
表 3 注射体积及明胶浓度对体内分布的影响(,n=6)
注:1)为溶液中明胶的浓度为0.03 g/L;2)为溶液中明胶的浓度为3 g/L
放射性摄取率/(%ID·g-1)注射后时间 组织5μL 20μL 5μL1) 5μL 2)SLN 1.76±0.70 1.71±0.51 2.77±0.99 3.38±0.86 2LN 0.54±0.22 0.53±0.18 0.71±0.55 2.46±0.47 1 h 注射点 66.02±3.19 70.70±3.46 64.45±2.88 56.39±2.81肝1.15±0.27 1.45±0.32 1.57±0.37 10.19±1.12脾0.14±0.08 0.19±0.02 0.13±0.04 0.28±0.08血0.66±0.18 0.91±0.17 0.72±0.14 1.60±0.30 SLN 1.88±0.28 1.08±0.38 5.05±0.93 9.69±1.98 2LN 0.36±0.14 0.51±0.21 0.84±0.44 3.80±1.93 4 h 注射点 71.12±1.63 77.41±1.76 64.15±3.85 41.77±5.45肝0.95±0.18 1.32±0.32 1.66±0.79 12.44±4.44脾0.17±0.04 0.19±0.04 0.15±0.04 0.40±0.12血0.81±0.23 1.40±0.71 0.69±0.23 0.65±0.09
5 小 结
注射体积增大,会造成淋巴结对药物的摄取降低;注射剂量减少,虽然在淋巴结的摄取减少,但腘窝淋巴结提取率却有较大提升,并且在肝和血液中的摄取也会降低;稀释后保持稳定剂明胶的浓度与原液中的浓度相当时,SLN的放射性摄取有大幅提高,但腘窝淋巴结提取率却显著降低,而且肝摄取也有大幅提高。
注射剂量是影响该类药物在小鼠淋巴结体内生物分布的关键因素,注射剂量和注射体积之间也存在一定的交互作用,因此,应在可行的前提下尽量降低注射体积,同时在进行注射剂量的选择时,应综合考虑注射剂量及明胶浓度对SLN、2LN及注射点的摄取所产生的效应。
[1] Mariani G,Moresco L,Viale G,et al.Radioguided sentinel lymph node biopsy in breast cancer surgery[J].JNucl Med,2001,42:1 198-1 215.
[2] Easson AM,Rotstein LE,McCready DR.Lymph node assessment in melanoma[J].J Surg Oncol,2009,99:176-185.
[3] Takagi K,UΜehara T,Kaneko E,et al.99mTclabeled mannosyl-neoglycoalbumin for sentinel lymph node identification[J].Nucl Med Biol,2004,31:893-900.
[4] Vera DR,Wallace AM,Hoh CK,et al.A Synthetic Macromolecule for sentinel node detection:99Tcm-DTPA-mannosyl-dextran[J].J Nucl Med,2001,42:951-959.
[5] Wallace AM,Hoh CK,Darrah DD,et al.Sentinel lymph node mapping of breast cancer via intradermal administration of Lymphoseek[J].Nucl Med Biol,2007,34:849-853.
[6] 王雪鹃,杨志,林保和,等.前哨淋巴结显像剂99Tcm-IT-Rituximab的制备及其定位性能[J].中华核医学杂志,2006,26:226-230.
[7] Mariani G,Erba P,Villa G,et al.Lymphoscintigraphic and intraoperative detection of the sentinel lymph node in breast cancer patients:the nuclear medicine perspective[J].J Surg Oncol,2004,85:112-22.
[8] Wilhelm AJ,Mijnhout GS,Franssen EJ.Radiopharmaceuticals in sentinel lymph-node detectionan overview[J].Eur J Nucl Med,1999,26:S36-S42.
[9] NANOCIS:Kit for the preparation of technetium[99Tcm] colloidal rhenium sulphide injection(Nanocolloid)Summary of Product Characteristics[EB/OL].(2007-01)[2011-04-11]http://www.radmed.com.tr/usr_img/urunler/nancolloid.pdf.

