18F-FBEM-NGA的合成及结构表征
彭 程,景慧慧,牟甜甜,杨文江,马云川,张现忠
(1.首都医科大学宣武医院 PET中心,北京 100053;2.放射性药物教育部重点实验室,北京师范大学 化学学院,北京 100875)
18F是目前PET显像中使用最多的核素之一,18F标记主要通过亲核取代反应实现。首先通过加速器质子辐照18O富集水获得18F-(比活度约为2.6~21.1 TBq·g-1)。通过亲核取代反应可在芳香环、杂环和脂肪链上取代氢或离去基团(卤素、硝基、季铵盐、磺酸酯基等)直接实现18F标记。生物大分子等对温度和有机溶剂敏感,一般通过标记合成子(Synthon)或辅助基团(Prosthetic Group)后,利用基团上的反应活性部位与生物大分子上的对应基团在温和条件下高效键合,从而实现放射性核素标记。
随着PET临床显像需要的日益增加,18F标记的肽和蛋白类PET药物引起了广泛关注。多肽和蛋白类分子靶向性好,但结构较复杂,含有多个活性位点,对温度、酸碱度以及有机溶剂等较敏感,直接标记法极易造成多肽和蛋白类分子变性而失去靶向性,需要小分子标记中间体通过选择性的定位反应进行标记,所得产物放化纯度和放化产率都较高[1]。N-琥珀酰亚胺-4-[18F]氟苯甲酸酯(18F-SFB)可以通过与蛋白质或多肽中的赖氨酸残基反应实现生物分子的18F标记,合成及纯化方法简单、放化产率高,标记产物的体内稳定性较好,是最适宜的18F标记中间体之一[2-4]。但当生物大分子中含有大量赖氨酸残基时,18F-SFB无法确定标记位点。本工作拟利用18F-SFB与N-(2-氨基乙基)马来酰亚胺三氟乙酸盐反应生成另一种标记中间体N-2-(4-[18F]氟苯甲酰氨基)乙基马来酰亚胺(18FFBEM)[5-7]。理论上,18F-FBEM中的马来酰亚胺双键可以与巯基发生定量反应,可用于标记带巯基的蛋白质和多肽分子。
研究表明[8-9],去唾液酸糖蛋白(ASGP)受体可以与含有乳糖或半乳糖残基的分子特异性结合,利用放射性核素标记的含有半乳糖残基的新乳糖白蛋白类似物对肝功能进行评价。肝受体显像对于肝脏疾病的早期诊断以及指导治疗和预后评价有重要的临床意义,因此相关研究在我国具有更重要的实际意义。本研究小组与北京协和医院、解放军总医院等密切合作,研制出一系列肝受体显像剂[8-12]。
本工作拟尝试用所合成的18F-FBEM对新乳糖白蛋白进行标记,制备得到一种新的18F标记新乳糖白蛋白(18F-FBEM-NGA),并对标记蛋白的性质进行初步评价。
1 主要实验材料
1.1 主要试剂
18O-H2O:丰度97%,美国剑桥同位素公司产品;K 222(纯度≥99%)、N-(2-氨基乙基)马来酰亚胺三氟乙酸盐(纯度≥95%):Fluka公司产品;三(2-甲酰乙基)膦盐酸盐、N-羟基琥珀酰亚胺(97%):Sigma-Aldrich公司产品;叔丁基肼盐酸盐(纯度为98%):Acros Oganics公司产品;对氟苯甲酸(纯度为98%)、N,N'-二环己基碳二亚胺(纯度为99%)、O-(N-琥珀酰亚胺)-1,1,3,3-四甲基脲四氟硼酸酯、N,N-二异丙基乙胺(纯度为99%):Alfa Aesar公司产品。其他试剂均为国产分析纯。无水乙腈、无水DMSO均在实验前进行无水处理并加分子筛,用封口膜密封保存。
1.2 主要仪器
X-6显微熔点测定仪:北京泰克仪器有限公司产品;Hitachi 260-50红外光谱仪:日本日立公司产品;FJ-391型同位素活度计:北京核仪器厂产品;Venusil MP-C18柱(5μm,10 mm×250 mm):Agela Technologies Inc.产品;Kromasil C4柱(5μm,4.6 mm×250 mm,30 nm):瑞典Eka Chemicals产品;Model 626 HPLC:美国Alltech公司产品;Shimadu 10AVp高效液相色谱仪:日本岛津公司产品;HiTrap脱盐凝胶柱(Sephadex G25):GE公司提供;RDS 111回旋加速器:德国西门子公司提供。
2 实验方法
2.1 19 F-FBEM的合成
稳定参考物质19F-FBEM合成路线示于图1。稳定的19F-SFB按参考文献[2]合成。用1.05 g对氟苯甲酸、0.86 g N-羟基琥珀酰亚胺和1.55 g N,N'-二环己基碳二亚胺在四氢呋喃(THF)中0~5℃下反应1 h。粗产物经无水乙醇重结晶,得到0.6 g白色针状晶体,即为19FSFB。计算产率。采用1H NMR、IR对产品结构进行鉴定。
取 84.3 mg19F-SFB、50 mg N-(2-氨基乙基)马来酰亚胺三氟乙酸盐和1 mL N,N-二异丙基乙胺在乙腈中40℃下反应20 min。反应结束后在40℃下旋干溶剂,粗产物经柱层析分离纯化,洗脱剂为V(二氯甲烷)∶V(甲醇)=50∶1,得到浅黄色粉末,即为19F-FBEM。采用1H NMR、ESI-MS对产品结构进行鉴定。
2.2 18 F-FBEM的合成
18F-FBEM合成路线示于图2。
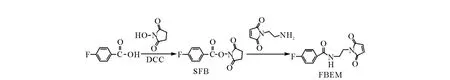
图1 19 F-FBEM的合成路线
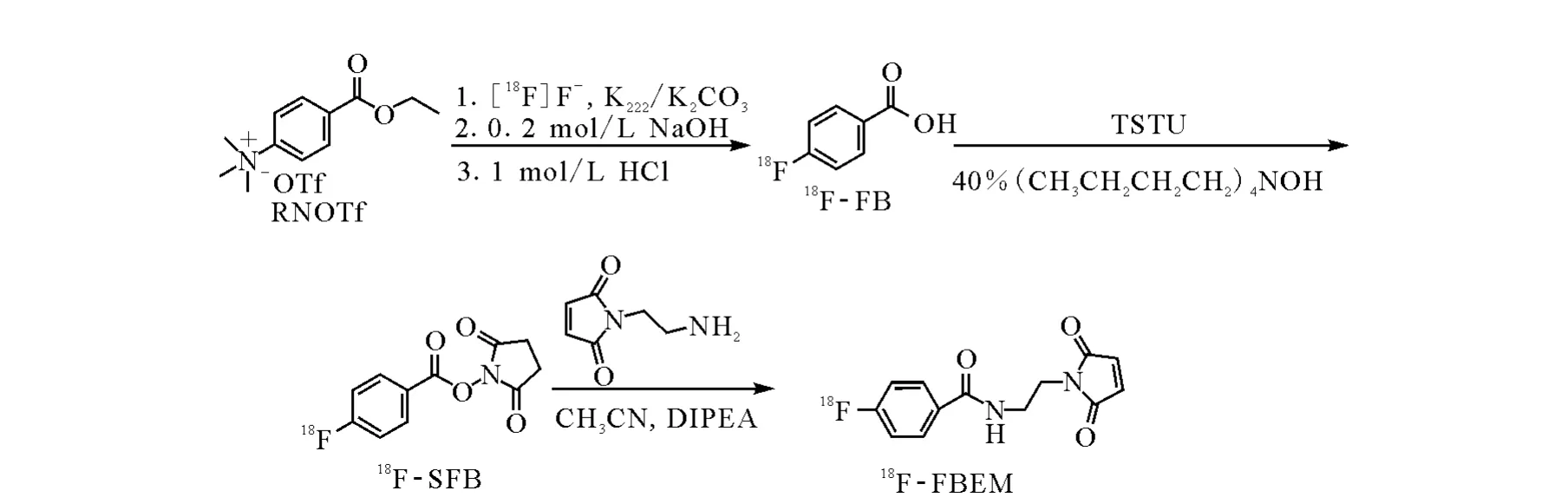
图2 18 F-FBEM的合成路线
18F-的获得:采用RDS111回旋加速器通过18O(p,n)18F核反应(11 MeV,30μA的质子束流连续轰击靶60 min)制得约22.2 GBq18F-,并用4-(4-甲基哌啶)吡啶阴离子交换树脂(QMA分离柱)捕获纯化。
18F-FBEM的合成方法如下 。
(1)用 1 mL K 222的乙腈溶液(含 14 mg K222)和 0.5 mL K 2CO3水溶液(含 3 mg K2CO3)将18F-淋洗到反应瓶中。120℃下用氮气吹干。
(2)反应瓶中加入1 mL标记前体 RNOTf(4 mg,11μmol)的DMSO溶液,120℃下反应20 min。
(3)再加入0.5 mL 0.2 mol·L-1的NaOH溶液,120℃下反应10 min。反应液用水冷却后,加入0.5 mL 1 mol·L-1盐酸。
(4)将反应液用水稀释至约10 mL,通过活化的Sep-Pak C18柱,之后先用10 mL二次水淋洗,用氮气吹干,然后用3 mL加1%TFA的乙腈洗脱,得到18F-FB。
(5)向18F-FB中加入30μL 40%Bu4NOH,120℃下用氮气吹干。加入17 mg TSTU(溶于1 mL无水乙腈),80~100℃下反应5 min。加入500μL 5%醋酸溶液稀释。
(6)将上述溶液用水稀释至约10 mL,通过活化的Sep-Pak C18柱,先用10 mL二次水淋洗,用氮气吹干,然后用2.5 mL二氯甲烷洗脱。50~60℃下用氮气吹干二氯甲烷,再加入少量乙腈,120℃下用氮气吹干,得到18F-SFB。测量产品的活度,计算放化产率。采用HPLC分析产品,与稳定参考物质比较并测定放化纯度。
(7)将1 mg N-(2-氨基乙基)马来酰亚胺三氟乙酸盐溶于800μL无水乙腈后加入含有18FSFB的反应瓶中,再加入20μL N,N-二异丙基乙胺。40℃下反应20 min,旋干乙腈,然后加入50μL三氟乙酸,得到18F-FBEM。
(8)用 600μL水稀释18F-FBEM,用 HPLC对其进行分离纯化。加水将洗脱液稀释至20 mL,通过活化的Sep-Pak C18柱,先用10 mL二次水淋洗,用氮气吹干,后用3 mL乙腈洗脱,得到18F-FBEM。测量产品的活度,计算放化产率。采用HPLC分析产品,与稳定参考物质比较,并测定放化纯度。
2.3 18 F-FBEM-NGA的合成
2.3.1 NGA(新乳糖白蛋白)的预处理
根据文献[8-10]方法制备并预处理NGA。用含 10 mmol·L-1酒石酸钾钠、40 mmol·L-1邻苯二甲酸氢钾的溶液稀释0.5 mol·L-1SnCl2·2H 2O的盐酸(1 mol·L-1)溶液100倍,再用1 mol·L-1NaOH 调p H 至5.4。取出300μL该亚锡溶液加入100μL(2 mg)NGA中,此时SnCl2·2H2 O约过量 500倍,密封,室温保存21 h后进行标记。
2.3.218F-FBEM-NGA的合成
18F-FBEM-NGA的合成路线示于图3。将HiTrap脱盐凝胶柱(Sephadex G25)用25 mL淋洗液(0.05 mol/L p H 7.5的磷酸缓冲液)平衡,控制流速在1~10 mL/min。将0.5 mL还原好的NGA用1 mL注射器上样,先用1 mL淋洗液淋洗后,收集1 mL淋洗液,得到除去杂质的还原NGA溶液,回收率>95%。
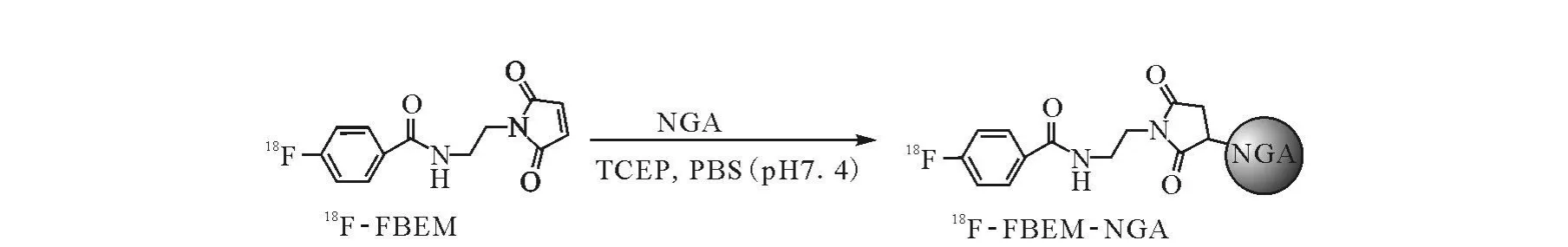
图3 18 F-FBEM-NGA的合成路线
取处理好的NGA溶液250μL溶解18FFBEM,转移到1.5 mL小离心管中。将1 mg三(2-甲酰乙基)膦盐酸盐(TCEP·HCl)溶于100μL PBS(pH 7.4)后加入该反应液中。用0.2 mol·L-1的NaOH 溶液调节 p H 至 7.0~7.5。室温反应20 min。
将HiTrap脱盐凝胶柱(Sephadex G25)用25 mL淋洗液(0.05 mol/L pH 7.5的磷酸缓冲液)平衡,控制流速在 1~10 mL/min。将0.25 mL标记好的18F-FBEM-NGA用 1 mL注射器上样,先用1 mL淋洗液淋洗后,收集1 mL淋洗液,得到除去杂质的18F-FBEM-NGA溶液,回收率>95%。测量活度,计算放化产率。HPLC分析并计算放化纯度。
2.4 18F-FBEM-NGA的体外稳定性
将经过凝胶柱纯化的18F-FBEM-NGA在室温下磷酸盐缓冲液(PBS,pH 7.4)中放置3.5 h,用HPLC分析其放化纯度。
3 结果与讨论
3.1 结构表征
3.1.119F-SFB的结构鉴定
19F-SFB的 产 率 为 33.8%。1H NMR(CDCl3):δ:2.919(s,4H,-CH2-CH2-),7.201(t,2H,Ar-H),8.175(m,2H,Ar-H)。IR(KBr)/cm-1:ν(OH):3491,ν(-CO-O-C):1 775、1 730。结果表明,合成产物为目标产物19F-SFB。
3.1.219F-FBEM的结构鉴定
1H NMR(CDCl3):δ:3.660(d,2H,NHCH2),3.838(d,2H,N-CH 2),6.652(s,1H,NH),6.754(s,2H,H-C=C-H),7.114(t,2H,Ar-H),7.776(t,2H,Ar-H)。IR(KBr)/cm-1:ν(NH):3 347,ν(C=O):1 706,1 625。ESI-MS:C13 H 11 FN 2O3,m/z:263.3([M+H]+),与理论值262.08基本一致。以上结果表明,合成产物为目的产物19F-FBEM。
3.2 18 F-FBEM的放化产率及放化纯度
18F-SFB和18F-FBEM的HPLC分析结果示于图4(所用HPLC的参数条件:Alltech高效液相色谱仪和Venusil MP-C18半制备柱;分析条件为:A相:水;B相:甲醇;流速:5 mL/min;淋洗梯度:0~5 min:5%B;5~8 min:5%B→40%B;8~25 min:40%B →90%B)。由图4可见,18F-SFB的放射性计数峰的保留时间为18.7 min,与标准品19F-SFB的紫外吸收峰的保留时间18.6 min吻合,说明18F-SFB标记成功;18F-FBEM的保留时间为16.7 min,与标准品19F-FBEM的紫外吸收峰的保留时间16.6min相吻合,表明18F-FBEM标记成功。
18F-SFB衰变校正后的放化产率为47.9%。由18F-SFB制得18F-FBEM的反应经衰变校正后的放化产率为20.5%。总放化产率约为9.8%。放化纯度大于98%。
3.3 18 F-FBEM-NGA放化产率及放化纯度
由18F-FBEM标记NGA得到18F-FBEMNGA的反应经过衰变校正后的放化产率为15.9%,放化纯度大于98%。
有关18F-FBEM-NGA合成的HPLC分析结果示于图 5(所用 HPLC的参数条件:Shimadu 10AVp高效液相色谱仪和 Kromasil C4柱;分析条件为:A相:水(含0.1%TFA);B相:乙腈(含0.1%TFA);流速:1 mL/min;淋洗梯度:0~30 min:30% →70%B)。由图 5可知,18F-FBEM-NGA的保留时间为14.6 min,18F-FBEM的保留时间为5.7 min,NGA保留时间为14 min,经过放射性标记后,对NGA的HPLC保留时间影响不大,18F-FBEM-NGA的制备获得成功。
国外报道18F-FBEM标记多肽和蛋白类分子的放射性衰变校正放化产率为 10%~20%(以18F-为起始物计算)[5-7]。本研究的结果与之相比较低,推测原因可能与NGA的预处理方法有关,亚锡对二硫键的还原作用可能不够强,导致与18F-FBEM反应的自由巯基数较少。此外三(2-甲酰乙基)膦盐酸盐可能会与18F-FBEM反应[6],从而降低18F-FBEM与NGA反应的放化产率。可改用其他还原剂,如DTT(1,4-二硫代苏糖醇))对NGA进行预处理,避免使用三(2-甲酰乙基)膦盐酸盐。通过化学手段对蛋白进行处理增加其自由巯基数量,或者蛋白与N-(2-氨基乙基)马来酰亚胺先反应,增加蛋白中活性氨基数量,再利用18F-SFB进行标记以提高标记率。相关研究工作正在进行中。
3.4 18 F-FBEM-NGA的体外稳定性
18F-FBEM-NGA室温下放置3.5 h的HPLC分析谱示于图5d。由图5d可见,体外放置3.5 h后18F-FBEM-NGA放化纯度大于95%,说明18F-FBEM-NGA的体外稳定性较好。
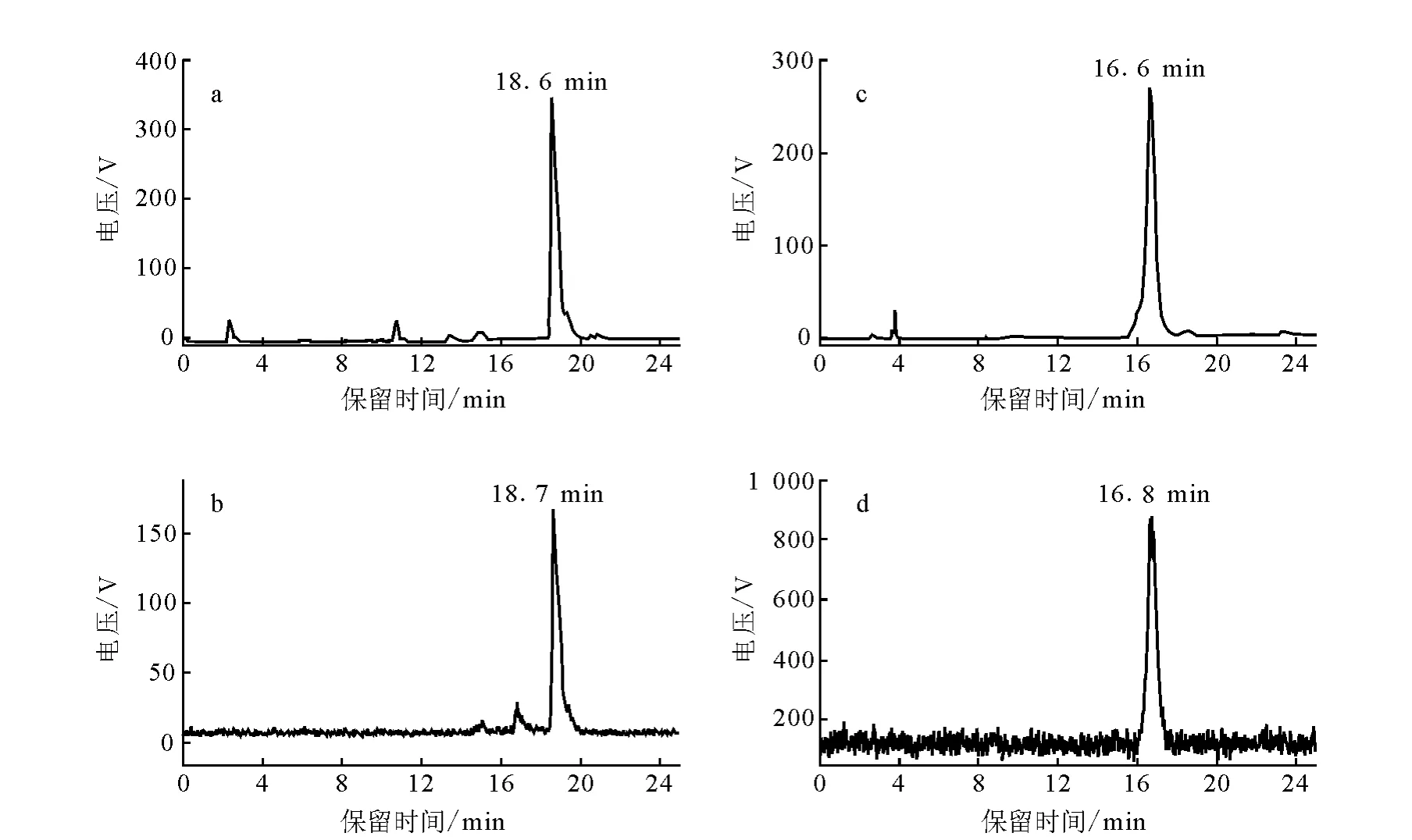
图4 18 F-FBEM合成的相关HPLC分析谱图a——19 F-SFB;b——18 F-SFB;c——19F-FBEM;d——18 F-FBEM
4 小 结
本工作合成了18F-FBEM,并尝试用18FFBEM标记了NGA。18F-FBEM经过放射性衰变校正放化产率为 9.8%,放化纯度大于98%。18F-FBEM-NGA经过放射性衰变校正放化产率为15.9%,放化纯度大于98%。其在磷酸盐缓冲液(p H 7.4)中室温下放置3.5 h后,放化纯度仍大于95%,可见18F-FBEM-NGA具有较好的体外稳定性。标记总时间约3.5 h(包括HPLC分离纯化时间),自动化合成路线正在设计中。
综上所述,利用该18F标记辅助基团可以有效进行蛋白类分子的标记,并有可能获得不同生物性能的标记化合物,作为改善标记化合物性能或获得新型标记化合物的一种新途径,值得进一步研究。

图5 18 F-FBEM-NGA合成的相关HPLC分析谱图a——NGA;b ——18 F-FBEM-NGA;c——18F-FBEM;d—— 18 F-FBEM-NGA
[1] 王明伟,尹端沚,汪勇先.常用18F标记中间体的合成及其应用研究[J].核技术,2006,29(1):63-71.
[2] 程登峰,尹端沚,王明伟,等.N-琥珀酰亚胺4-[18F]氟苯甲酸酯的合成[J].核技术,2006,29(12):917-920.
[3] Mou Tiantian,Yang Wenjiang,Peng Cheng,et al.[18F]-labeled 2-methoxyphenylpiperazine derivative as a potential brain positron emission tomography imaging agent[J].Applied Radiation and Isotopes,2009,67:2 013-2 018.
[4] 张赟,吴战宏,傅喆,等.半自动化合成N-琥珀酰亚胺-4-18F-氟苯甲酸酯[J].同位素,2009,22(1):60-64.
[5] Cai Weibo,Zhang Xianzhong,Wu Yun,et al.A Thiol-reactive18F-labeling agent,N-[2-(4-18FFluorobenzamido)Ethyl]maleimide,and synthesis of RGD peptide-based tracer for PET imaging of αvβ3integrin expression[J].The Journal of Nuclear Medicine,2006,47(7):1 172-1 180.
[6] Kramer-Marek Gabriela,Kiesewetter Dale,Martiniova Lucia,et al.[18F]FBEM-ZHER2:342-Affibody molecule:a new molecular tracer for in vivo monitoring of HER2 expression by positron emission tomography[J].European Journal of Nuclear Medicine and Molecular Imaging,2008,35:1 008-1 018.
[7] Kiesewetter DO,Orit Jacobson,Lixin Lang,et al.Automated radiochemical synthesis of[18F]FBEM:athiol reactive synthon for radiofluorination of peptides and proteins[J].Applied Radiation and Isotopes,2011,69:410-414.
[8] 毛一雷,董一女,杨文江,等.肝细胞受体显像剂99Tcm-GSA的制备及其药盒化[J].同位素,2008,21(2):88-94.
[9] 杨文江.99mTc标记的肝ASGP受体显像剂的制备及药盒化研究[D].北京:北京师范大学,2008.
[10]杨文江,郑立春,丁重阳,等.99mTc标记的一种抗植物蛋白抗体及其生物分布[J].北京师范大学学报:自然科学版,2008,44(1):64-67.
[11]杨文江,张现忠.肝ASGP受体显像剂的研究进展[J].同位素,2009,22(3):177-186.
[12] Yang Wenjiang,Mou Tiantian,Peng Cheng,et al.Fluorine-18 labeled galactosyl-neoglycoalbumin for imaging thehepatic asialoglycoprotein receptor[J].Bioorganic&Medicinal Chemistry,2009,17(21):7 510-7 516.

