甘薯渣酒精发酵条件优化
岳昌海,朱许慧,侯文贵,李凭力*
(1.天津大学化工学院,天津 300072; 2.天津市膜科学与海水淡化技术重点实验室,天津 300072; 3.天大天久科技股份有限公司,天津 300072)
传统乙醇发酵工艺采用粮食高温蒸煮然后发酵的方式,不仅耗费大量能源,而且稀酸和高温对设备损坏极大,副产物较多[1-5]。现阶段生产乙醇的原料主要是粮食,近些年粮食价格上涨等其它因素导致高乙醇成本。再加上国家节能减排以及非粮食酒精政策的出台,使粮食酒精受到很大限制。许多研究者正在寻找可替代的发酵原料,如秸秆、木材或生产中的某些副产品等。近年来,生淀粉乙醇发酵工艺在国内外受到了高度重视[6-8],我国对生料酿酒的研究20世纪90年代进入快速发展期[9],许多学者利用各种生物酶制剂对生料发酵进行了研究[10-11]。甘薯渣是甘薯提取淀粉后的副产品,在许多加工 厂中堆积如山,酸化腐败,造成环境污染。而且粉渣中蛋白质含量很低,纤维素含量较高,也不适合做饲料使用。本研究以甘薯渣为原料,生料发酵生产乙醇。这不仅能克服传统发酵生产乙醇高能耗的缺点,而且就原料的取材符合国家的非粮乙醇政策。
1 试验部分
1.1 主要仪器及药品
甘薯渣,产于河北行唐县,湿甘薯渣含水分约83.2%,干燥后原料含淀粉约48%左右,偏酸性,pH值在6.5~7.0之间;生料酒曲,可用于生料酿酒,湖南中南食品科学研究院生产;活性干酵母,酿酒用耐高温型,湖北安琪股份有限公司生产;耐高温α-淀粉酶(液化酶),Liquozyme SC,液态酶,活力7 199 IU,诺维信(中国)生物技术有限公司生产;糖化酶,Suhong GA 475,液态酶,活力2 000 IU,中外合资苏州宏达制酶有限公司生产;纤维素酶,固态粉末状,活力16 670 IU,北京百灵威科技有限公司生产;葡萄糖,分析纯;乙醇,分析纯;硫酸,分析纯。
UV-722分光光度计(上海第三分析仪器厂);668型真空干燥箱(江苏省东台县电器厂);9790Ⅱ高效气相色谱(温岭福立分析仪器有限公司);PHS-25型数字酸度计(上海精科);LD5-2A型低速离心机(北京医用离心机厂)。
1.2 试验方法
1.2.1正交试验设计
采用正交试验设计,研究发酵条件例如pH值、发酵温度、发酵时间等对甘薯渣无蒸煮一步发酵生产乙醇的影响,并选定最适宜因素水平配比组合。
在甘薯渣无蒸煮一步发酵过程中,原料中水分含量直接影响物料的浸润程度。而且酵母乙醇发酵过程是典型的产物抑制,水量的多少可以影响抑制程度的大小。因此要确定原料的含水量。对于酶及酵母等具有生物活性的物质,要保证其最大活性,必须选择最适宜pH值和最适宜温度,因此发酵料的pH值及发酵时温度也是影响发酵的重要因素。最后,发酵时间的长短直接影响着酶对底物的作用效果以及酵母消耗酶解产物并发酵成乙醇的过程,故也将发酵时间作为一个因素考虑在内。
因此,选择温度、pH值、发酵时间、含水量以及酒曲量5个影响因素,可以有效得出试验规律,为实现生料发酵产乙醇、提高产率提供依据。
基于生料发酵现有的条件,根据生物酶活性的最适宜条件和酵母生长的最适宜环境,各因素选取4个水平,如表1所示。
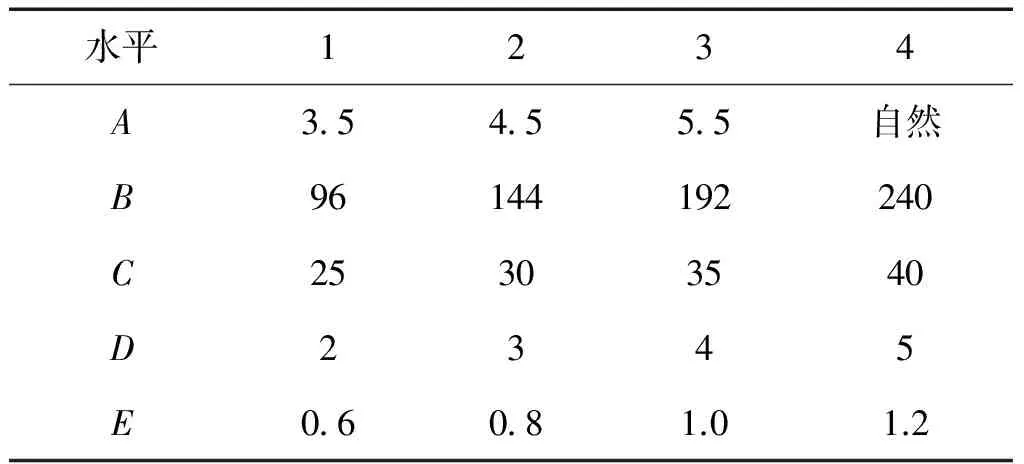
表1 因素与水平表
A:pH值;B:发酵时间 /h;C:发酵温度/℃;D:水料比;E:酒曲含量/% 。
本试验考察5个因素,各因素均取4个水平,由于各个因素之间没有交互作用,因此可使用L16(45)正交表。
1.2.2单因素试验
正交试验得出的最适宜配比需要进一步验证。固定发酵的4个影响因素,改变另1个因素,考察此因素的不同水平对试验结果的影响,并得出各因素的最适宜值。
将干燥过的甘薯渣捣碎后与适量的40 ℃蒸馏水混匀,加入适量生料酒曲,混匀,密封于500 mL广口瓶中,放入恒温箱中,在特定温度下进行发酵。观察发酵料的颜色变化和封口薄膜的鼓起情况。在酵母发酵过程中产生一部分CO2,会使薄膜鼓起,从鼓起程度可以判断发酵程度。同时瓶中的发酵料会由灰色变为啤酒黄色,而且块料变松散。
1.3 分析方法
1.3.1乙醇浓度的测定
在生料甘薯渣发酵试验中,乙醇含量的分析方法如下:将发酵醪放入蒸馏锅中蒸馏,通过蒸汽带走发酵醪中的乙醇,并经冷却,收集,得到乙醇和水的冷凝液。利用酒精计或气相色谱测定溶液中乙醇含量。
1.3.2乙醇理论产率的计算
酵母发酵淀粉产生乙醇的过程分两步:淀粉水解成糖;葡萄糖经酵母发酵生成乙醇和CO2。反应式如下:
(C6H10O5)n+162nH2O→18nC6H12O6180
C6H12O6→1802C2H5OH+2×462CO22×44
1 g淀粉理论上生产乙醇量为:2×46/162=0.567 9 g,则1 g干料理论上产生乙醇量为:1×48%×0.567 9=0.272 g。
1.3.3pH值测定
用蒸馏水清洗发酵料,滤纸过滤,得到清液将其定容,用PHS-25型数字酸度计测定。
1.3.4原料水分的测定
用电子天平称取5~10 g原料,放入烘箱,在110 ℃下烘6~7 h(以达到恒重为准),取出,置于干燥器内冷却30 min后,称重。
2 结果与讨论
2.1 正交试验结果与讨论
甘薯渣生料发酵生产乙醇正交试验结果如表2所示。
由表2中的极差R可知,影响乙醇产率的主次因素顺序为:发酵pH值>水料比>发酵时间>发酵温度>曲量。
从图1可以看出,乙醇产率随发酵pH值的增加而增加,取原料自然pH值时发酵结果最好,有必要进一步研究提高pH对发酵结果的影响;乙醇产率随发酵时间的延长而增加,在发酵时间192 h时,乙醇产率较高,超过192 h后,乙醇产率有下降趋势;当水料比在2时,乙醇产率较大,但不能确定2就是最适宜,可以进一步研究减小水料比对发酵的影响;发酵温度适中,在35 ℃时乙醇产率最大,高于酵母菌最适生长温度;酒曲添加量在1.0%时乙醇产率最大,当超过1.0%时,乙醇产率有下降趋势。
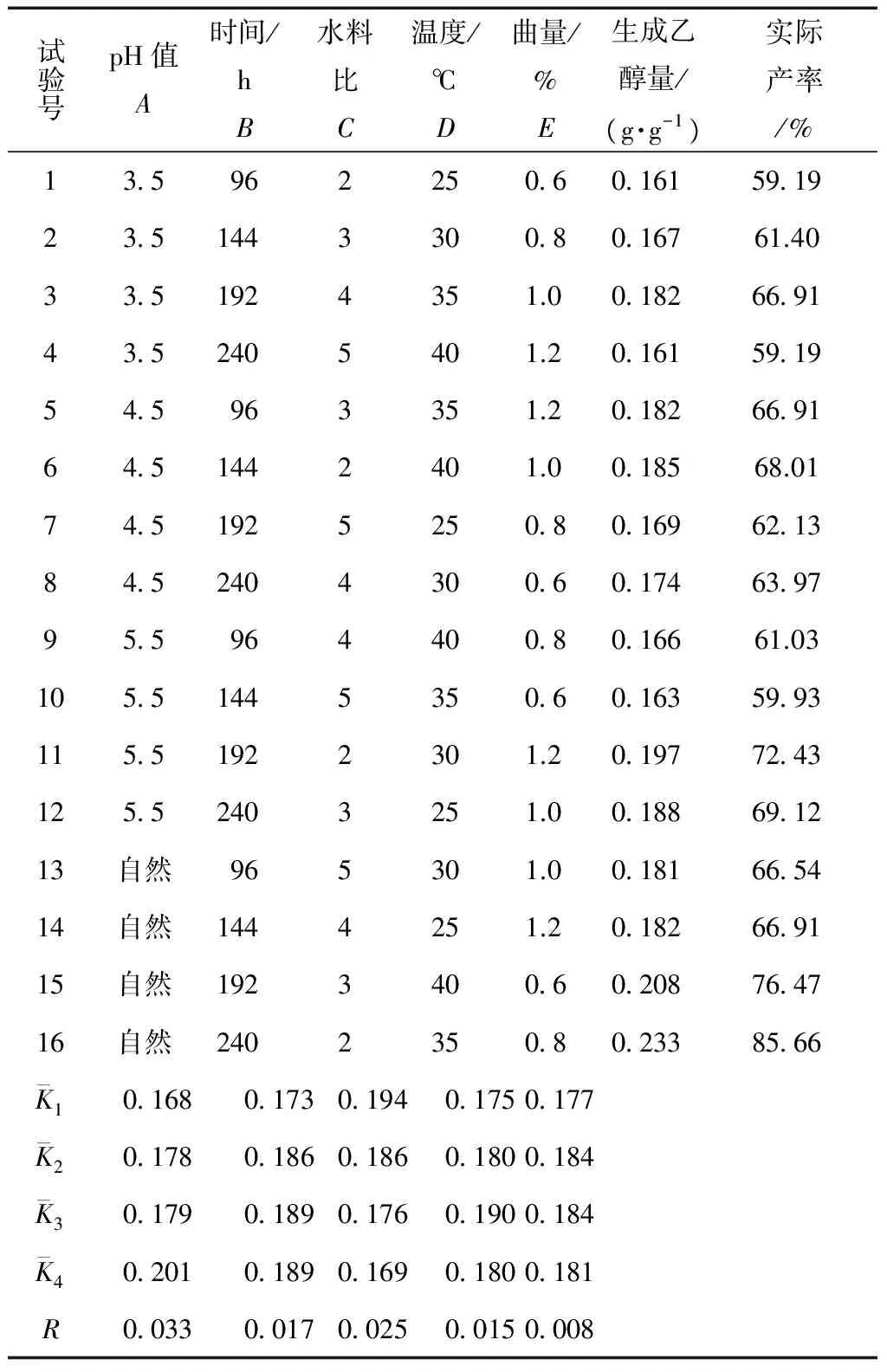
表2 试验结果
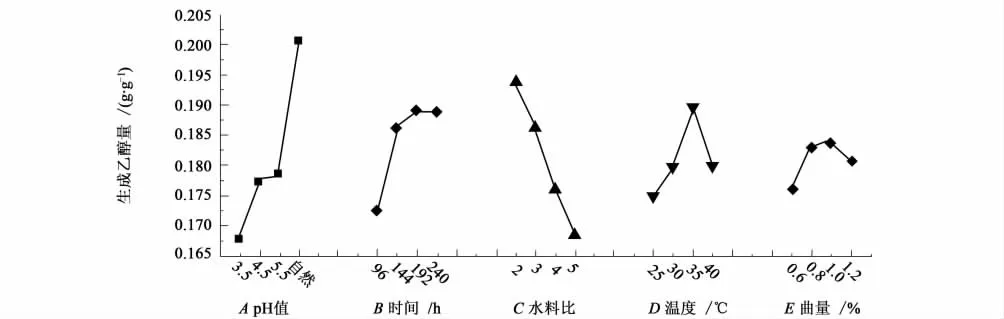
图1 因素水平趋势图Fig.1 Trend lines of factor levels
因此得出可能最适宜发酵方案是:A4B3C1D3E3,即:发酵pH值为原料的自然pH值,水料比为2,发酵时间为192 h,发酵温度为35 ℃,曲量为原料质量的1.0%。在此条件下发酵验证。发酵结果无水乙醇生成量为0.24 g/g,达理论值的87.8%。在此基础上做单因素试验,结果列于2.2节。
2.2 单因素试验结果与讨论
在正交试验基础上对每一个影响发酵的因素进行研究,分别对试验结果进行讨论。
图2是不同pH值对乙醇产率的影响。
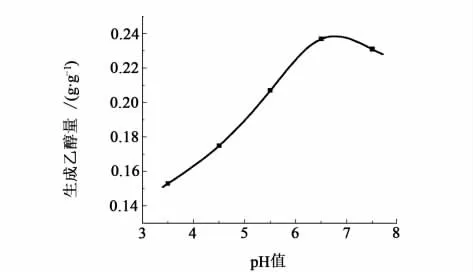
图2 不同pH值对乙醇产率的影响Fig.2 Variation of ethanol yield under pH
从图2可以看出,在pH值为6.5和7.0之间时乙醇产率可达最大值。随着pH值的降低,氢离子会将菌体细胞膜内阳离子置换出来,导致细胞内物质外泄,细胞死亡[13-14]。所以随pH值的降低乙醇产率也降低。当pH值超过7时,乙醇产率逐渐下降。因为碱性环境改变了菌体的发酵途径,致使乙醇产量减少,甘油产量增加。甘薯在加工完生产淀粉后本身就略呈酸性,约为6.5左右,所以选择原料的自然pH值,符合发酵条件,而且工艺更简单。
对于生料甘薯渣来说,淀粉颗粒基本上是完整而团聚的,表露出来的可与酶结合的活性位点很少[16-17],因此很难被淀粉酶轻易降解。如果淀粉经高温蒸煮后,会因为分子间氢键的断裂而变得膨胀松散,易于酶解的进行和发酵。另外,原料甘薯渣中含有大量的纤维素,妨碍了酶与淀粉的接触,减缓了发酵速度。所以适当延长发酵时间,可以使降解酶有充分的时间与淀粉颗粒接触并将其降解,有利于酵母发酵。图3给出了发酵时间对乙醇产率的影响。
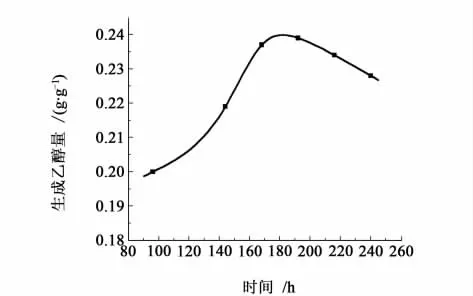
图3 发酵时间对乙醇产率的影响Fig.3 Influence of fermentation time on yield of ethanol
从图3可以看出,在180 h时发酵效果最好。但发酵时间持续过长,生长杂菌的几率就会变大,有的细菌以乙醇为营养碳源,消耗乙醇并且产生酸,致使发酵后酸度加大、产品产量下降。
合适的加水比是获得最适宜的工艺条件的前提。传统的乙醇工业采取液态发酵,水料比通常在3.0以上,这使后期的蒸馏能耗增加,而且造成大量的废水无法回收。如果水料比太小,水分不易将干燥的物料充分浸润,乙醇产率就会很低。不同水料比的结果见图4。
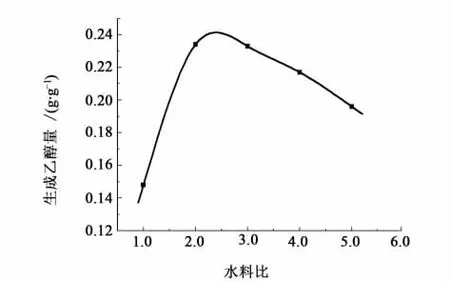
图4 水料比对乙醇产率的影响Fig.4 Influence of water-material ratio on yield of ethanol
从图4中可以看出,在水料比2.4时乙醇产率最大。水料比再增大,不仅会影响乙醇产率,而且给后期的水处理带来麻烦。
温度是影响微生物存活的重要因素之一。在发酵过程中,温度对乙醇产率的影响很明显。因各种生物酶活性的最适宜温度、酵母生长的温度以及产物的生成温度不一定相同,所以需要找到一个合适的温度使乙醇产率最大[17,18]。温度是保证酶活性的重要条件,一般随发酵温度升高,酶反应速率加快,而且菌体细胞膜的流动性增大。乙醇发酵温度略高于酵母正常生长温度,这有利于酶的活性处于较高水平并且维持细胞膜高渗透性,利于营养物的进入和乙醇与CO2的排出。所以在发酵试验过程中,需要调整温度以找到最佳条件使产品产率最大。不同发酵温度对应的结果如图5。
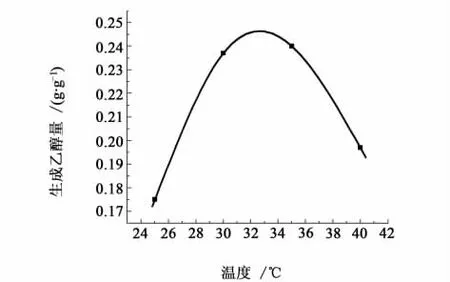
图5 发酵温度对乙醇产率的影响曲线图Fig.5 Influence of fermentation temperature on yield of ethanol
从图5中可以看出,乙醇产率随温度的升高而升高,在33 ℃时达最大。当温度再升高时,乙醇产率逐渐下降。因为酶本身很容易因过热而失去活性,使酵母质量下降,发酵能力变差,甚至菌体会过早的衰亡。较高的温度不仅抑制酵母发酵,还会使耐高温的乳酸菌等细菌有可能快速繁殖,消耗葡萄糖及乙醇等而产生酸,增加发酵醪酸度。
一般来讲,乙醇的形成是菌体代谢的结果,故菌体浓度越大,产物的产量就会越高。酒曲添加量的影响见图6。
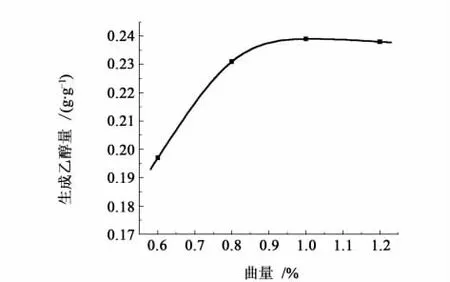
图6 曲量对乙醇产率的影响曲线Fig.6 Influence of amount of Koji on yield of ethanol
从图6可知,随着酒曲添加量的增加,乙醇产率增大,但超过0.9%后,增加趋缓甚至有降低的趋势,可能原因有2个:1)接种量过大,菌体浓度较高时,增加发酵醪黏度,而且由于空间条件的限制、菌体之间的相互作用以及营养物质的相对稀少等因素,致使菌体繁殖较慢,活性降低甚至过早衰亡[19-20];2)接种量过大使菌体大量消耗原料糖分,从而降低乙醇的产率。因此,在曲量为1.0%时产率最大,考虑到乙醇生产成本,发酵时酒曲添加量取0.9%合适。
综上,由单因素试验得出的最适宜发酵条件为:发酵pH值为原料的自然pH值,发酵时间为180 h,水料比为2.4,发酵温度为33 ℃,酒曲添加量为0.9%。并在此最适宜条件下做发酵试验进行验证。试验结果如表3所示。
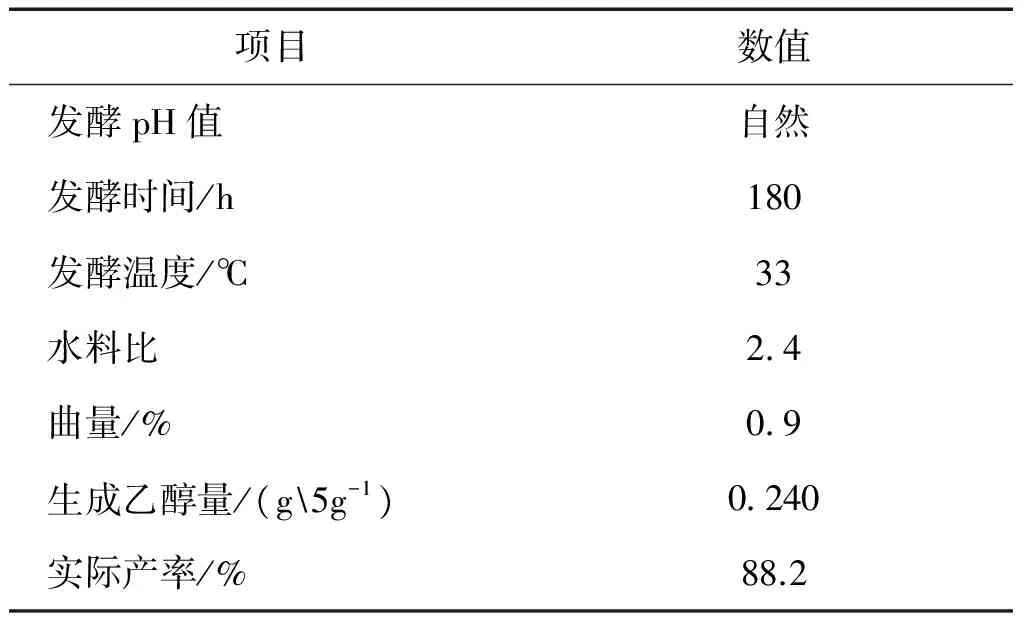
表3 最适宜条件的验证试验及其结果
单因素试验得出的最适宜条件较正交试验得出的最适宜条件略有不同。在单因素试验得出的最适宜条件下,发酵取得了更好的结果。
3 结 论
1)影响甘薯渣生料发酵乙醇产率的主次因素顺序为:发酵pH值>水料比>发酵时间>发酵温度>曲量。
2)甘薯渣生料发酵生产乙醇的最适宜条件组合为:发酵pH取原料的自然pH值,发酵时间取180 h,水料比取2.4,发酵温度取33 ℃,酒曲添加量为0.9%。
3)在最适宜条件下,对甘薯渣进行生料发酵,1 g干料产乙醇0.240 g,达到理论值的88.2%。
参考文献:
[1]ROBERT E. Process for the production of glucose:US, 3770589 [P].1973-11-6
[2]BROWN J M,BEMIS W A,MONROE F A.Dextrose syrup:US,2438033 [P].1948-4-12
[3]WALLERSTEIN L,GRAY P P. Production of dextrose:US, 2583451 [P].1952-1-22
[4]HARTIG H P.Sugars derived from starch[J].Food Technol Aust,1957,9:73-83
[5]HONSCH W M.Preliminary work for the manufacture of wheat starch glucose[J].Starch-Starke,1957,9(3):45-47
[6]方靖,方善康. 无酵母生淀粉酒精发酵的研究[J]. 食品与发酵工业,1992,1(5):7-12
[7]谢舜珍,严自正,张树政. 生淀粉酶产生菌的分离和筛选[J]. 微生物学通报,1992,19(3):267-270
[8]FLORP Q,HAYASHIDA S.Production and characteristics of raw starch-digesting glucoamylase from a protease-negative glycosidase-negative Aspergillus awamori var. kawachi mutant[J]. Appl Environ Microbiol,1983,45:905-912
[9]黄平.生料酿酒技术[M].北京:轻工业出版社,2001
[10]贾树彪,李盛贤,吴国锋.新编乙醇工艺学[M]. 北京:化学工业出版社,2004
[11]方善康,朱明田.无蒸煮生淀粉酒精发酵研究[J]. 食品与发酵工业,1988,2(3):13-19
[12]GYAMERAH M,GLOVER J.Ethanol by continuous fermentation using a combination of immobilized yeast and solvent extraction[J]. Advances in Fermentation,1983,4: 203-210
[13]PYE E K,HUMPHREY A E. The Biological Production of Liquid Fuels from Biomass[EB / OL].Univ Penn,Interim Report to USDOE,1979-01-01
[14]JARZEBSKI A B,MALINOWSKI J J,GOMA J.Modelling of ethanol fermentation at high yeast concentrations[J].Biotechnol Bioeng,1989,34(9):1 225-1 230
[15]STARZAK M,KRZYSTEK L.Macroapproach kinetics of ethanol fermentation by Saccharomyces cerevisiae:Experimental studies and mathematical modeling[J].Chemeng and Bioeng,1994,54(3):221-240
[16]CHERYAN M,MEHAIA M A.Membrane Separations in Biotechnology[M]. New York: Marcell-Decker, 1986
[17]GARCIA H S,MALCATA F X,HILL C G,etal.Use of candida rugosa lipuse immobilized in a spiral wound membrane reactor for the hydrolysis of milkfat[J].Enzyme Microb Tech,1992,14(7):535-544
[18]UDRIOT H,AMPUERE S,MARISON I W,etal. Extractive fermentation of ethanol using membrane distillation[J].Extractive Biotech Lett, 1989,11(7):509-511
[19]ALKASRAWI M,ERIKSSON T,BORJESSON J,etal.The effect of Tween-20 on simultaneous saccharification and fermentation of softwood to ethanol[J]. Enzym Microb Technol, 2003,33:71-78
[20]WALSH P K,LIU C P,FINDLEY M E,etal. Ethanol separation form water in a two-stage adsorption process[J]. Biotech Bioeng Symp,1983,13(5):629-64

