荸荠秆枯病菌生物学特性研究
潘丽,朱志贤,吕茹婧,郑露,黄俊斌
(华中农业大学植物科学技术学院/湖北省作物病害监测和安全控制重点实验室,武汉,430070)
荸荠秆枯病菌生物学特性研究
潘丽,朱志贤,吕茹婧,郑露,黄俊斌
(华中农业大学植物科学技术学院/湖北省作物病害监测和安全控制重点实验室,武汉,430070)
为研究湖北地区荸荠秆枯病的发生规律,研究了其对不同理化环境和营养条件的需求。试验结果表明,荸荠秆枯病菌(Cylindrosporium eleocharidis)菌丝生长和分生孢子萌发温度为5~35℃,最适温度为25~30℃;病菌菌丝最适宜在马铃薯葡萄糖培养液(PDB)中生长,最适宜在绿豆汁培养基(MBA)上产孢。pH值为4~10时,病菌菌丝均能生长,pH值为6~7时最适宜其生长;病菌能利用多种碳源和氮源,碳源以蔗糖和淀粉利用效果最好,氮源以酵母膏和蛋白胨利用效果最好;病菌菌丝的最低致死温度为50℃水浴10 min,分生孢子最低致死温度为55℃水浴10 min。
荸荠;秆枯病;荸荠柱盘孢;生物学特性
2008-2010年,荸荠秆枯病在湖北团风县方高坪镇荸荠种植基地发生严重,使得荸荠减产率达20%以上,重病田甚至绝产绝收,严重影响了荸荠的产量和品质,给荠农造成巨大的经济损失。为弄清湖北地区荸 荠秆枯病菌 (Cylindrosporium eleocharidis)对不同理化环境和营养条件的需求,笔者对其生物学特性进行了较为系统的研究,以期为研究该病害的发生规律和防治技术提供重要的理论依据。
1 材料与方法
1.1 不同培养基上荸荠秆枯病培养性状的观察及产孢量的测定
将荸荠秆枯病菌供试菌株TF2009-1(下同)分别接种到有PDA、PSA、OMA、OTA、CA、MBA、VA、CWA培养基的平板上,于25℃恒温培养箱中光照培养,10 d后观察菌落的形态和颜色,并拍照。15 d后在菌落表面加入5 mL无菌水,用玻璃涂棒刮取表层菌丝,经2层擦镜纸过滤得到分生孢子悬浮液,将其分装至2 mL离心管中,5 000 r/min离心1 min,离心后用接种枪将离心液吸至1个1.5 mL离心管中,定容至1 mL,然后用血球计数板测量分生孢子悬浮液浓度。每处理3个重复。
1.2 不同培养液对菌丝生长量的影响
将上述8种培养液(培养基配方中不加琼脂)设为8个处理,每处理4个重复。量取100 mL培养液加至250 mL三角瓶中,每瓶接入1块直径为6 mm的在PDA平板上培养7 d的菌落边缘的菌丝块,封口后置于25℃、180 r/min恒温摇床中光照培养,10 d后称量菌丝干质量。
1.3 不同温度对菌丝生长和分生孢子萌发的影响
供试菌株在PDA平板上培养7 d后,用孔径为6 mm的无菌打孔器在菌落边缘打取菌丝块,移至新鲜的PDA平板中央。设置5,10,15,20,25,30,35,40℃共8个不同的温度处理,将接好菌的培养皿封口后分别置于不同温度的恒温培养箱中光照培养,每处理5个重复,10 d后用十字交叉法测量菌落直径,比较不同温度对病菌菌丝生长的影响。
将5 mL无菌水滴在PDA平板上生长15 d的菌落表面,用无菌玻璃涂棒刮取表面菌丝,经2层擦镜纸过滤得到分生孢子悬浮液,然后用2 mL离心管分装,离心后去上清,用血球计数板测量悬浮液浓度,再加入无菌水将分生孢子悬浮液浓度调至105个/mL,然后用无菌玻璃涂棒将100 μL分生孢子悬浮液均匀涂布在2%的水琼脂平板上,分别置于上述8个不同温度的恒温培养箱中,每处理5个重复,24 h后统计分生孢子萌发率。
1.4 不同光照对菌丝生长和分生孢子萌发的影响
供试菌株在PDA平板上培养7 d后,用孔径为6 mm的无菌打孔器在菌落边缘打取菌丝块,移至新鲜的PDA平板中央,然后将平板置于25℃恒温箱中培养。设置连续黑暗、12 h光暗交替和连续光照3个处理(光源为普通日光灯18 W、22 cm,下同),每个处理5个重复,10 d后用十字交叉法测量菌落直径,比较不同光照条件对菌丝生长的影响。
分生孢子悬浮液的制备同1.3。用无菌玻璃涂棒将100 μL分生孢子悬浮液均匀涂布在2%的水琼脂平板上,设置连续黑暗、12 h光暗交替和连续光照3个处理,光照强度及培养温度同上,24 h后统计分生孢子萌发率(%)。
1.5 不同pH值对菌丝生长的影响
用0.1 mol/L NaOH和0.1 mol/L HCl调节PDA培养基的pH值,pH值分别设置3,4,5,6,7,8,9,10,11。在不同pH值的平板上接种直径为6 mm的新鲜菌丝块,置于25℃恒温培养箱中光照培养,每处理4个重复,10 d后用十字交叉法测量菌落直径。
1.6 不同碳源和氮源对菌丝生长量的影响
以 Czapek培养液(2.00 g KNO3,1.00 g KH2PO4,0.5 g KCl,0.5 g MgSO4·7H2O,0.01 g FeSO4,30.0 g蔗糖,1 000 mL蒸馏水)为基础培养液[1]。用含碳量相同的淀粉、D-甘露醇、D-半乳糖、葡萄糖、L-山梨醇、麦芽糖、柠檬酸、果糖、乳糖代替其中的30.0 g蔗糖,以不加碳源作对照,各处理4个重复。向250 mL的三角瓶中加入100 mL Czapek培养液,每瓶接入1个直径为6 mm的新鲜菌丝块,置于25℃、180 r/min的恒温摇床中光照培养,10 d后称量菌丝干质量。
以Czapek培养液为基础培养液[1],用含氮量相同的酵母膏、蛋白胨、甘氨酸、谷氨酸、硝酸铵、氯化铵、尿素和硝酸钠代替其中的2.00 g硝酸钾,以不加氮源作对照,每处理4个重复。病原菌培养及菌丝干质量称量方法同上。
1.7 菌丝体及分生孢子致死温度测定
①菌丝致死温度测定 用直径为6 mm的无菌打孔器在PDA培养基上培养7 d的菌落边缘打取菌丝块,将菌丝块置于加有1 mL无菌水的2 mL无菌离心管中,分别在35,40,45,50,55,60℃水浴锅中处理10 min后取出冷却,每处理5个重复,将菌丝块取出,置于PDA平板上于25℃光照培养,10 d后观察其生长情况。
②分生孢子致死温度测定 分生孢子悬浮液的制备方法同1.3。将其浓度调至105个/mL,移取1 mL分生孢子悬浮液于1.5 mL的eppendorf管中,分别置于35,40,45,50,55,60℃的水浴锅中处理10 min后取出冷却。每处理5个重复,将各重复中的100 μL孢子悬浮液用无菌玻璃涂棒均匀涂布在2%的水琼脂平板上,于25℃光照培养,24 h后在光学显微镜下观察分生孢子萌发情况,统计孢子萌发率。
1.8 数据统计与分析
用DPS 3.01软件分析光照条件、温度、pH值、不同碳源和氮源对菌丝生长、分生孢子萌发及产孢量的影响,并用Tukey法比较不同处理间的差异显著性(P=0.05)。用Excel软件作图。
2 结果与分析
2.1 不同培养基对TF2009-1产孢量的影响
TF2009-1在不同培养基上的菌落形态和培养性状有差异,在OMB和CA上菌丝生长较稀疏。由图1可知,TF2009-1在各培养基上产孢量有显著性差异,在MBA上产孢量最高,为17.3×105个/mL,其次为CWA、OTA和CA,产孢量分别为7.7×105,4.3×105,4.0×105个/mL,在 OMA、VA、PSA和PDA上的产孢量最低,分别为2.4×105,2.2×105,2.1×105,1.6×105个/mL。

图1 不同培养基对TF2009-1产孢量的影响
2.2 不同培养液对菌丝生长量的影响
TF2009-1在不同培养液中的菌丝生物量存在显著性差异。在PDB中菌丝生物量最高,为10.987 mg/mL,其后依次为 PSB、CWA、OTB、MBB、VB和CB,分别为9.517,7.093,6.150,4.360,3.770,3.572,3.190 mg/mL,在OMB中菌丝生物量最低,为3.190 mg/mL(图2)。

图2 不同培养液对TF2009-1菌丝生长的影响
2.3 不同温度对菌丝生长及分生孢子萌发的影响
菌丝在5~35℃的温度范围内均能生长,最适宜生长温度为25~30℃,5,10,35℃时,菌丝生长受到明显抑制,40℃时菌丝不能生长(图3)。

图3 不同温度对TF2009-1菌丝生长的影响
分生孢子在5~35℃温度范围内均能萌发,15~ 35℃较适宜萌发,萌发率达80.0%以上;25℃最适宜萌发,萌发率为93.3%;5℃时抑制孢子萌发,萌发率仅为24.0%;40℃时孢子不能萌发(图4)。

图4 不同温度对TF2009-1分生孢子萌发的影响
2.4 不同光照对菌丝生长及分生孢子萌发的影响
TF2009-1在PDA平板上连续光照、12 h光暗交替、连续黑暗条件下培养10 d后菌落平均直径分别为7.04,7.28,7.20 cm,三者间无显著性差异(图5)。
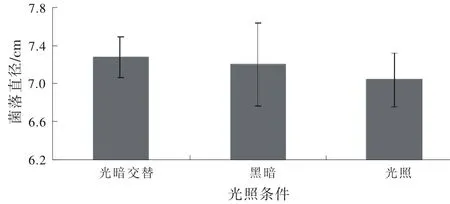
图5 不同光照对TF2009-1菌丝生长的影响
分生孢子在连续黑暗、12 h光暗交替、连续光照条件下培养24 h后,分生孢子萌发率分别为97.7%,97.8%,96.7%,三者间无显著性差异(图6)。

图6 不同光照对TF2009-1分生孢子萌发的影响
2.5 不同pH值对菌丝生长的影响
TF2009-1在不同pH值的培养基中生长,菌落平均直径存在显著性差异。培养基的pH值为3.0~ 10.0时,菌丝均能生长;pH值为4.0~10.0时,菌落平均直径大于6.0 cm,较适宜菌丝生长;培养基pH值7.0时,病原菌生长最快,菌落平均直径为8.03 cm;pH值3.0时,菌落生长最慢,菌落平均直径为5.36 cm;培养基pH值为4.0,5.0,6.0,8.0,9.0和10.0时,菌落平均直径分别为6.65,6.83,7.55,7.38,6.54,6.09 cm; pH值为11.0时,菌丝不能生长(图7)。

图7 不同pH值对TF2009-1菌丝生长的影响
2.6 不同碳源对菌丝生长的影响
TF2009-1在供试的10种不同碳源培养液和不加碳源(CK)的培养液中均能生长,菌丝生物量存在显著性差异,其中病菌对蔗糖和淀粉的利用效果最好。180 r/min摇菌,光照培养7 d后,菌丝生物量分别为2.760,2.613 mg/mL;对D-甘露醇和D-半乳糖的利用效果次之,其菌丝生物量分别为1.133,1.130 mg/mL;对葡萄糖、L-山梨醇、麦芽糖、柠檬酸和果糖的利用效果较差,其菌丝生物量小于0.944 mg/mL;对乳糖的利用效果最差,其菌丝生物量为0.520 mg/mL,与CK中菌丝生物量0.527 mg/mL相比无显著性差异(图8)。
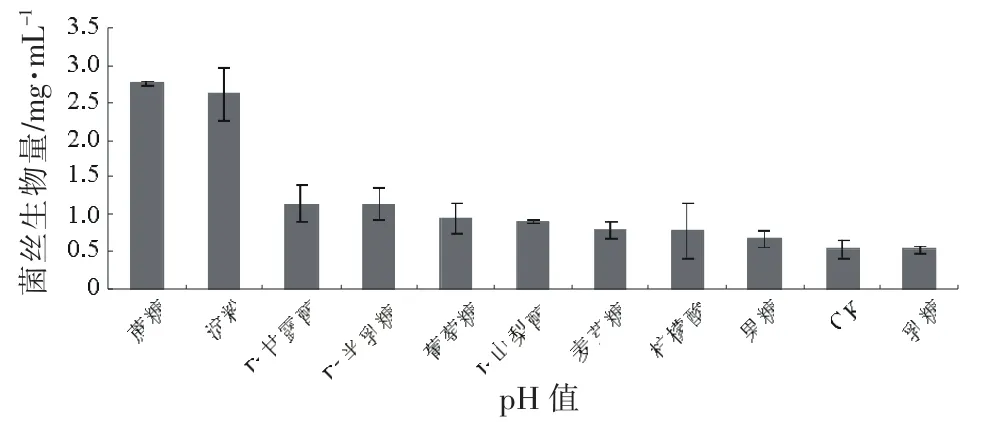
图8 不同碳源对TF2009-1菌丝生长的影响
2.7 不同氮源对菌丝生长的影响
TF2009-1在供试的9种不同氮源培养液和不加氮源(CK)的培养液中均能生长,菌丝生物量存在显著性差异。病原菌对酵母菌和蛋白胨的利用效果最好,菌丝生物量分别为6.795,6.168 mg/mL;对甘氨酸、谷氨酸、硝酸铵、氯化铵、硝酸钾、尿素和硝酸铵的利用效果较差,其生物量均小于1.235 mg/mL,且相互间无显著性差异(图9)。

图9 不同氮源对TF2009-1菌丝生长的影响
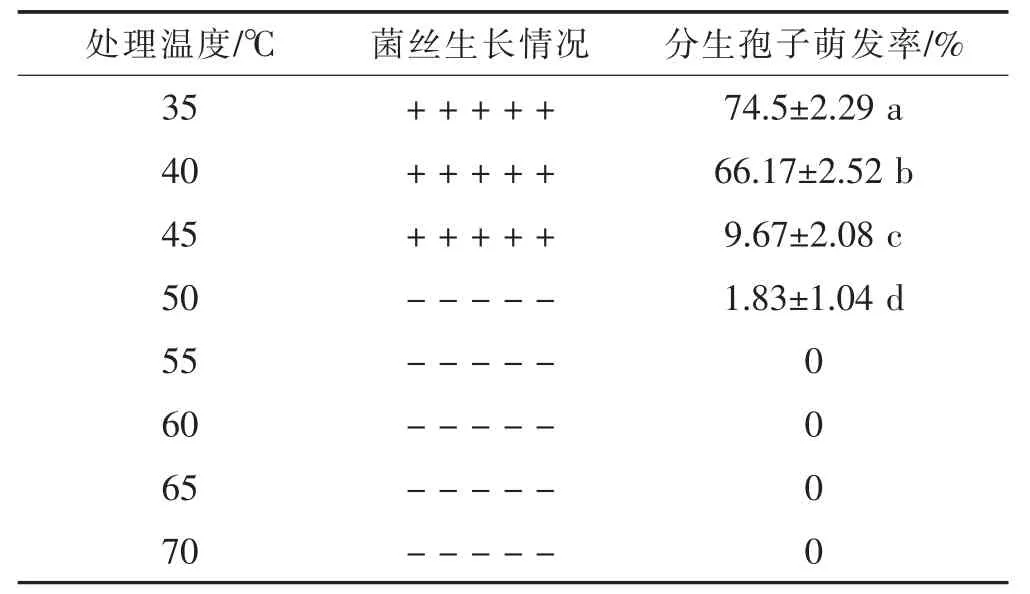
表1 菌丝和分生孢子致死温度测定
2.8 菌丝体及分生孢子致死温度测定
TF2009-1菌丝块在50℃水浴中处理10 min后其菌丝不能生长,说明菌丝的最低致死温度为50℃水浴处理 10 min;分生孢子悬浮液在55℃水浴中处理10 min后,分生孢子不能萌发,说明分生孢子的最低致死温度为55℃水浴处理10 min(表1)。
3 小结与讨论
国内外尚无C.eleocharidis生物学特性的相关报道。本次荸荠秆枯病菌生物学特性研究结果表明,在连续光照、12 h光暗交替和连续黑暗条件下,病菌均能正常生长,且菌落平均直径无显著性差异;分生孢子在2%水琼脂平板上均可萌发,且其萌发率无显著性差异;该菌菌丝在PDA平板上培养时,在5~35℃内其均能生长,最适温度为25~30℃;分生孢子在2%水琼脂平板上,于5~35℃内均可萌发,最适温度为25~30℃。据梁钧等[3]和李清铣等[5]报道,从广西和江苏两地荸荠秆枯病病茎上分离的荸荠柱盘孢生长温度分别为8~ 32℃和5~32℃,最适温度分别为25~30℃和23~29℃,其中李清铣等[5]还指出荸荠柱盘孢分生孢子的萌发温度为10~32.5℃,最适温度22~27.5℃。这与本研究结果基本一致,说明在中国南方和中部地区该菌对温度的适应能力差异不大。该菌在供试的8种培养液中均能生长,且菌丝生物量存在显著性差异,在PDB中菌丝生物量最大,OMB中最小。该菌在供试的8种培养基中均能产孢,且产孢量存在显著差异,在MBA上产孢量最高,OMA、VA、PSA和PDA上最低。该菌菌丝在pH值为3.0~10.0的PDA培养基上均能生长,且菌落平均直径存在显著性差异,pH值为6.0~7.0时菌丝生长最快,pH值为11.0时菌丝不能生长。梁钧等[3]报道,从广西荸荠秆枯病病茎上分离的荸荠柱盘孢菌生长最适宜pH值为6.47;李清铣等[3]报道,从江苏荸荠秆枯病病菌上分离的荸荠柱盘孢菌生长较适宜pH值为4.7~ 7.2,这与本研究结果基本一致,说明该菌较适宜在偏酸性环境中生长。
荸荠秆枯病菌能够利用多种碳源和氮源,在无碳或无氮条件下也能生长,在不同碳源和氮源中菌丝生物量均存在显著性差异。供试碳源中以蔗糖和淀粉的利用效果最好,D-甘露醇和D-半乳糖的利用次之,利用最差的是葡萄糖、L-山梨醇、麦芽糖、柠檬酸和果糖,但与CK相比无显著性差异。供试氮源中以酵母膏和蛋白胨的利用效果最好,对甘氨酸、谷氨酸、硝酸铵、氯化铵、硝酸钾、尿素和硝酸铵的利用效果较差,与CK相比差异不显著。李清铣等[5]报道荸荠秆枯病菌在不同碳源中对淀粉的利用效果最好,其次为果糖和乳糖,麦芽糖利用较差,蔗糖和葡萄糖的利用效果最差,病菌几乎不能生长;氮源中以蛋白胨和天冬酰胺利用效果最好。梁钧等[3]报道荸荠秆枯病菌在不同碳源中对葡萄糖、D-甘露醇和蔗糖的利用较好,麦芽糖次之;氮源中则以甘氨酸等的利用效果最好,硫酸铵、硝酸铵、尿素等的利用最差。这与本研究结果差异较大,推测可能是由于3个地方种植的荸荠品种不同,也可能是因为荸荠秆枯病菌存在生态地理型差异。
荸荠秆枯病菌菌丝和分生孢子的最低致死温度分别为50℃水浴处理10 min和55℃水浴处理10 min。病菌菌丝生长和分生孢子萌发受处理时间与处理温度的影响,该试验结果为选择适宜的处理温度和时间,应用热处理法来控制荸荠秆枯病提供了参考。不同热处理方法、时间和温度对病原菌存活力的抑制作用还需要进一步的研究。
[2]方中达.植病研究方法.3版[M].北京:中国农业出版社,1998.
[2]黄彰欣.植物化学保护实验指导[M].北京:中国农业出版社,1993:56-59.
[3]梁钧,赖传雅.荸荠秆枯病菌生物学性状研究[J].广西农业大学学报,1995,14(4):288-294.
[4]Freeman S,Nizani Y,Dotan S,et al.Control ofColletotrichum acutatumin strawberry under laboratory,greenhouse,and field conditions[J].Plant Disease,1997,81:749-752.
[5]李清铣,王连荣.江苏荸荠秆枯病的发生、危害及病原菌鉴定[J].扬州大学学报:农业科学版,1985(4):20-22
Research on Biological Characteristic ofCylindrosporium eleocharidis
PAN Li,ZHU Zhixian,LV Rujing,ZHENG Lu,HUANG Junbin
(College of Plant Science Technology,Huazhong Agricultural University/Key Lab of Crop Disease Monitoring and Safety Control in Hubei Province,Wuhan 430070)
Biological characteristic ofCylindrosporium eleocharidisindicated that the range of temperature for mycelia growth and conidia germination both were 5-35℃,and the optimal range of temperature for both were 25-30℃;potato dextrose liquid medium (PDB)was the most favorable for mycelium growth,and mung bean agar medium (MBA)was the optimal for sporulation.The range of pH value for mycelia growth was 3-11,with the optimal pH value of 6-7.Among the tested carbon and nitrogen source in Czapek liquid medium,sucrose,amylum,yeast extract and peptone were the most favorable for mycelia growth.The lethal temperature for mycelia and conidia was 50℃,10 min and 55℃,10 min,respectively.This is the first report of biological characteristic ofC.eleocharidisin Hubei province,the causal agent of Chinese water chestnut stem blight.
Chinese water chestnut;Stem blight;Cylindrosporium eleocharidis;Biological
10.3865/j.issn.1001-3547.2011.16.027
农业部公益性行业科研专项(200903017)
黄俊斌(1963-),男,通信作者,教授,研究方向为植物真菌病害与分子植物病理学,E-mail:junbinhuang@mail.hzau.edu.cn
2011-07-05

