生物肽SP对NK细胞NKG2D/NKG2A受体表达的影响
周爱平,顾鹏毅,傅炜昕,梁再赋
(中国医科大学实验技术中心一部暨国家中医药管理局中药生物工程Ⅲ级科研实验室,辽宁沈阳110001)
P物质(Substance P,SP)是发现最早的神经肽之一,属于哺乳动物速激肽家族,广泛分布于神经系统和其他外周组织器官内,具有多种生理功能,SP发挥生理作用的主要途径是NK-1受体介导的[1]。国内外研究报道SP的镇痛作用显著强于吗啡,且无成瘾性副作用[2]。此外,SP具有消除口渴以及强化抗癌药物杀伤力的作用,有望作为抗癌病人的辅助药物。近年来SP对免疫功能的调节作用越来越受到人们的关注,已有实验证明在多种免疫细胞上均有SP的特异性受体,SP能以神经内分泌的方式作用于各种免疫细胞,参与免疫调节,促进免疫功能[1,3-4]。自然杀伤细胞(natural killer cell,NK)是机体内重要的淋巴细胞亚群,在抗感染,抗肿瘤,免疫调节及造血系统等方面发挥重要作用。目前有关SP对NK细胞功能影响的报道较少。以NK92-MI细胞作为研究体系,研究了SP对NK细胞生物学功能的调节作用,已有结果显示SP在生理浓度范围可增强NK细胞的杀伤活性,且SP通过增加杀伤介质及功能性受体的表达来调节NK细胞的杀伤功能[5]。为进一步探究SP活化NK细胞并调节其生物学活性的效应分子,还检测了SP对NK92-MI细胞活化性受体NKG2D和抑制性受体NKG2A表达的影响,以深入揭示SP对NK细胞功能影响的内在机制。
1 材料与方法
1.1 材料
1.1.1 细胞株NK-92MI细胞株购自中国生命科学院细胞库,用含12.5%胎牛血清和12.5%马血清的α-MEM完全培养基,传代培养;K562细胞株用含10%胎牛血清的RPMI-1640培养基,常规培养。
1.1.2 主要试剂α-MEM干粉(GIBCO,美国),马血清及胎牛血清(Hyclone,美国),SP(Sigma,美国),Real-Time PCR试剂盒(大连宝生物公司),噻唑蓝(MTT;华美生物技术公司),抗NKG2A-PE和抗NKG2D-APC单抗(R&D System,美国)。
1.1.3 引物设计用Primer 6.0软件设计引物,由金斯特生物科技公司合成,引物序列见表1。

表1 Real-Time PCR所用引物Table 1 Primers used in Real-Time PCR
1.2 方法
1.2.1 MTT法测定NK92-MI细胞的杀伤活性①制备效应细胞:取对数生长期的NK92-MI细胞(4×105/mL)用不同浓度的SP(终浓度分别为10-6、10-8、10-10、10-12、10-14mol/L)作用24 h,作为效应细胞;②用96孔培养板,分别加入效应细胞和靶细胞(K562细胞)各100 μL/孔,设效、靶细胞比为4∶1;同时加入MTT(5 mg/mL,10 μL/孔),与效、靶细胞共同孵育4 h;③将培养板离心、弃上清,加入DMSO并振荡溶解甲臢,用酶标仪于570 nm波长测定OD值。根据以下公式计算NK细胞杀伤率:
NK细胞杀伤率=(1-(实验组OD值-效应细胞对照组OD值)/靶细胞对照组OD值)×100%
1.2.2 Real-Time PCR法测定NKG2D和NKG2A的mRNA表达水平NK92-MI细胞(约1×107个)经不同浓度(终浓度分别为10-8、10-10、10-12、10-14mol/L)SP处理24 h。①异硫氰酸胍(Trizol)法提取细胞总RNA;紫外分光光度计比色,测定RNA纯度;②cDNA的合成:RT反应体系为10 μL(5×Prime Script TM缓冲液4 μL、Prime Script RT酶混合物Ⅰ0.5 μL、Oligo dT引物0.5 μL、随机引物0.5 μL、无RNA酶水3.5 μL、样品RNA 1 μL);反转录反应条件:37℃、15 min(反转录反应),85℃、5 s(反转录酶的失活);③PCR反应:反应体系为20 μL(SYBY Primix Ex TaqTM10 μL、PCR上游引物0.4 μL、PCR下游引物0.4 μL、参比ROX DyeⅡ0.4 μL、无菌双蒸水6.8 μL、cDNA模板2 μL);反应条件:95℃,30 s(预变性);95℃,5 s;60℃,34 s(40个循环);④应用ABI PRISM 7500 Real-Time PCR System进行检测,测定各样品Ct值;以18S rRNA作为参照基因,用2-ΔΔCt法比较实验组相对表达量与对照组的倍数差异,计算公式如下:

1.2.3 流式细胞术检测NKG2D和NKG2A的膜表达取对数生长期的NK92-MI细胞与不同浓度的SP(浓度同上)共孵育24 h;用人IgG封闭Fc受体后,与荧光标记抗体(NKG2D-APC和NKG2A-PE)共同孵育30~45 min;上流式细胞仪检测细胞阳性表达率。
1.2.4 统计学分析所有数据均经SPSS13.0统计分析软件包处理,所得实验数据均以均数±标准差(¯χ±SD)表示,各组间均数比较采用一维方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果与分析
2.1 SP对NK92-MI细胞杀伤活性的影响
SP作用24 h后,10-14~10-8mol/L的SP对NK92-MI细胞杀伤活性均有明显增强作用,与对照组比较有统计学意义;而10-6mol/L的SP对其杀伤活性无明显作用,结果见图1。
2.2 SP对NK92MI细胞NKG2D和NKG2A的mRNA水平的影响
结果如图2所示,作用24 h,各浓度SP对NK92-MI细胞NKG2D的mRNA表达均有上调作用,与对照组(无SP刺激)比较,差异有显著性(P<0.01)。各浓度SP也可增加NK92-MI细胞NKG2A的mRNA表达,与对照组比较均有显著性差异(P<0.01)。

图1 SP对NK92-MI细胞杀伤活性的影响Fig.1 Effects on NK92-MI cytotoxicity by SP
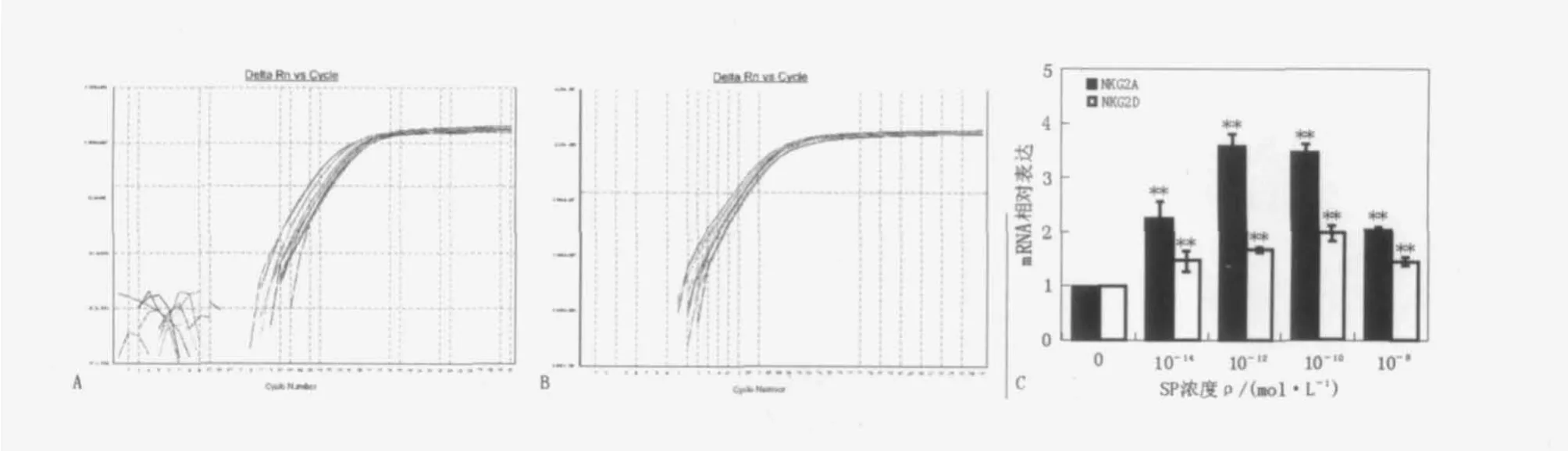
图2 SP对NK92MI细胞NKG2D/NKGA的mRNA水平的影响Fig.2 Effects on mRNA expression of NKG2D/NKG2A in NK92-MI cell by SP
2.3 SP对NK92-MI细胞NKG2D和NKG2A膜表达的影响
结果见图3、4,各浓度SP均可增加NKG2D的膜表达,与对照组(无SP刺激)比较,有显著性差异(P<0.05);各浓度SP对NK92-MI细胞NKG2A的膜表达均有不同程度的上调,仅浓度为10-14mol/L组,与对照组比较无统计学意义。且各浓度SP刺激NKG2D表达增加的程度高于NKG2A(表2)。
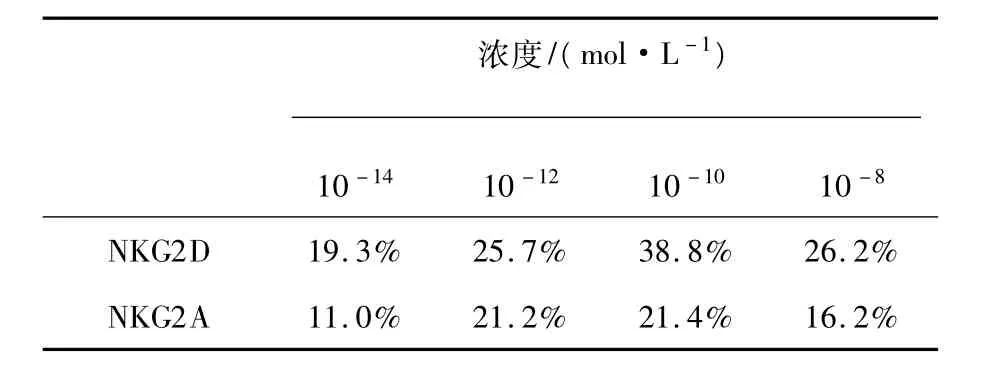
表2 SP上调NK92-MI细胞NKG2D/NKG2A膜表达水平的比较Table 2 Compare in up-regulation of NKG2D and NKG2A by SP

图3 SP对NK92-MI细胞NKG2D膜表达的影响Fig.3 Effects on expression of NKG2D in NK92-MI cell by SP

图4 SP对NK92-MI细胞NKG2A膜表达的影响Fig.4 Effects on expression of NKG2A in NK92-MI cell by SP
3 讨论
SP是体内最常见的神经肽,是神经内分泌和免疫系统共同的化学语言。SP对免疫功能的多个方面均有促进作用,在体内体外均可调节多种免疫细胞的功能[3,6-7]。SP可以影响淋巴细胞的增殖、分化,诱导免疫球蛋白和细胞因子的合成,并能够调节Th细胞的活性和其他一些免疫细胞的活性。SP对杀伤性淋巴细胞的活性也有影响,SP可刺激外周血NK细胞的迁移和细胞毒活性,并调节炎症部位的NK细胞分泌IFN-γ,某些疾病状态至外周血SP浓度升高而抑制NK细胞杀伤活性,也有研究表明过高浓度的SP对外周血NK细胞的杀伤活性有下调作用[7-9]。可见,SP在不同条件下所起的作用具有复杂性和多样性。我们已经证实SP对人外周血中NK细胞杀伤活性有双向调节作用,本项研究应用NK92-MI细胞为研究对象,通过MTT比色法检测SP对NK92-MI细胞杀伤活性的影响,结果显示较低浓度(10-14~10-8mol/L)的SP对NK-92MI细胞的细胞毒性有明显的增强作用(效靶细胞比为4∶1),说明生理浓度范围的SP可促进NK细胞的杀伤活性。
NK细胞是机体天然存在的抗肿瘤细胞,无需预先致敏,无MHC限制性,能直接杀伤靶细胞,其活性的高低与疾病的发生、发展及转归有密切的关系。NK细胞受体基因的平衡对维持NK细胞和/或T细胞受体平衡和机体的免疫自稳状态意义重大。NK细胞受体是其功能发挥的分子基础,NK细胞依赖于其表面表达的多种能与MHC或非MHC配体结合的受体,传递活化或抑制信号,调节其生物学活性[10]。活化性受体NKG2D表达于所有静止和活化的人类NK细胞,但NKG2D与其他NKG2蛋白无同源性,同CD94也没有关系,人类NKG2D受体仅与DAP10蛋白结合。当前已证明NKG2D受体启动NK细胞细胞毒性机制依赖于颗粒分泌途径,NKG2D/DAP10与其相应配体分子结合后,激活自然杀伤细胞内的Jak2、Stat5、MIPK和AKt/蛋白激酶等多糖信号转导途径,拮抗MHCⅠ类分子所转导的抑制信号,激活自然杀伤细胞的细胞毒性,即NKG2D-DAP10复合体的交联引发细胞颗粒释放和细胞毒作用[11-12]。不同NK细胞亚群细胞表达不同抑制性受体KIR和CD94/NKG2A组合,CD94/NKG2A的配体是HLA-E分子,表达于靶细胞上的HLA-E分子对CD94/NKG2A+NK细胞的杀伤活性具有抑制作用[11]。CD94/NKG2和KIR在功能上相互补充,这使得NK细胞对不同病理情况引发的HLA表达的细微和较大变化均有感应。NKG2A和NKG2D平衡的变化很大程度上决定着NK细胞的功能状态,抑制性受体介导抑制信号的质和量帮助决定NKG2D介导效应功能的水平。
为进一步探讨NK92-MI细胞的杀伤功能增强的原因,通过流式细胞术和Real-Time PCR检测对杀伤活性有增强作用的浓度范围的SP对NK92-MI细胞表面NKG2D/NKG2A表达水平的影响。结果表明各浓度SP均上调NKG2D的膜表达和mRNA水平(两者变化趋势完全一致);该浓度范围的SP同样可明显增强NKG2A的mRNA表达,仅10-14mol/L的SP对NKG2A膜表达的作用较对照组无差别,提示此组NKG2A膜表达受到抑制;其他浓度的SP使NK92-MI细胞NKG2D膜表达上调的幅度相对较大,说明NKG2A/NKG2D平衡被打破,活化信号超过抑制信号而占优势,进而诱导NK92-MI细胞产生和分泌杀伤介质、发挥杀伤功能。而且已研究证实SP可以通过促进杀伤介质穿孔素和颗粒酶的产生及增加NK细胞独有的活化性受体NCR的表达来调控NK细胞的杀伤活性[5]。
综上所述,生理浓度的SP可以增强NK细胞的杀伤活性,SP调节NK细胞功能性受体NKG2A/NKG2D的表达强度,可能为其调控NK细胞杀伤活性的分子机制之一。临床应用NK细胞进行过继生物治疗时,SP的联合应用即可保证NK细胞杀伤肿瘤的效果,还可以缓解病人的疼痛、口渴等症状。为了进一步确定这种可能性,今后将建立动物模型进行体内实验,深入研究NK细胞联合应用SP的治疗作用及其作用机制。
[1] Koon HW,Pothoulakis C.Immunomodulatory properties of substance P:the gastrointestinal system as a model[J].Ann N Y Acad Sci,2006,1088:23-40.
[2] Yasphal K,Wright DM,Henry JL.Substance P reduced tailflick latency:implications for chronic pain syndrome[J].Pain,1982,14(2):155-167.
[3] Katsanos GS,Anogeianaki A,Orso C,et al.Impact of substance P on cellular immunity[J].J Biol Regul Homeost A-gents,2008,22(2):93-98.
[4] Steven D.Douglas and Susan E.Leeman.Neurokinin-1 receptor:functional significance in the immune system in reference to selected infections and inflammation[J].Ann.N.Y.Acad.Sci,2011,1217:83-95.
[5] Fu WX,Qin B,Zhou AP,et al.Regulation of NK92-MI Cell Cytotoxicity by Substance P.Scandinavian Journal of Immunology[J].Scand J Immunol,2011,74(2):107-113.
[6] Kulka M,Sheen CH,Tancowny BP,et al.Neuropeptides activate human mast cell degranulation and chemokine production[J].Immunology,2008,23(3):398-410.
[7] Carina Strell,Anne Sievers,Philipp Bastian,et al.Divergent effects of norepinephrine,dopamine and substance P on the activation,differentiation and effector functions of human cytotoxic T lymphocytes[J].BMC Immunology,2009,10:62-76.
[8] Lighvani S,Huang X,Trivedi PP,et al.Substance P regulates natural killer cell interferon-γ production and resistance to Pseudomonas aeruginosa infection[J].Eur J.Immunol,2005,35(5):1567-1575.
[9] Feistritzer C,Clausen J,Sturn DH.et al.Natural killer cell function mediated by the neuropeptide substance P[J].Regulatory Peptides,2003,116(1-3):119-126.
[10] Marras F,Bozzano F,De Maria A.Involvement of Activating NK Cell Receptors and Their Modulation Pathogen Immunity[J].J Biomed Biotechnol,2011,2011:152430.Epub.
[11] Lorenzo Moretta,Cristina Bottino,Daniela Pende,et al.Surface NK receptor and their ligands on tumor cells[J].Seminars in Immunology,2006,18(3):151-158.
[12] Upshaw JL,Arneson LN,Schoon RA,et al.NKG2D-mediated signaling requires a DAP10-bound Grb2-Vav1 intermediate and phosphatidylinositol-3-kinase in human natural killer cells[J].Nat Immunol,2006,7(5):524-532.

