约氏疟原虫Pys48核酸疫苗传播阻断效应的实验研究
单颖,刘英杰,郑丽,刘军,延娟,曹雅明*
(1.中国医科大学免疫学教研室,辽宁沈阳110001;2.辽宁医学院免疫与病原生物学教研室,辽宁锦州121000;3.中国医科大学病原生物学教研室,辽宁沈阳110001)
疟疾作为一种严重威胁人类生命健康的感染性寄生原虫疾病,据2010年WHO报告,2009年全球疟疾病例超过2亿人,导致近百万患者死亡[1],给全球尤其是发展中国家带来了严重的健康危害和经济负担[2],因此需要更多和/或更好的控制方法来最终消灭这种疾病。而抗疟原虫有性阶段的传播阻断疫苗(TBV)虽然不能直接阻止疟原虫的感染,但能够阻止疟原虫通过媒介按蚊从感染者到未感染者的传播[3],最终完全消灭疟疾。因此,有效的TBV的研制开发必将带来明显的社会效益和经济效益,而深入探讨其候选抗原的免疫原性和传播阻断效应具有重要的科学意义和应用价值。核酸疫苗能够在宿主体内表达具有构象结构的抗原,诱发机体全面的免疫应答,其作为新型疫苗开发策略已广泛应用于包括疟疾疫苗的开发研究中[4]。P48蛋白作为TBV的候选抗原,是表达于配子体和蚊阶段配子表面的主要蛋白[5]。近年来发现来自疟疾流行区的人体血清中存在抗P48的抗体,其与传播阻断免疫活性相关[6-7]。本教研室前期已经构建了P.y17XL Pys48核酸疫苗,并对其免疫活性进行了初步探讨[8]。在此,本研究进一步利用成功构建的P.y17XL Pys48核酸疫苗免疫BALB/c小鼠后,通过P.y17XL攻击小鼠,进一步探讨核酸疫苗的免疫原性和传播阻断效应,以期为有效疟疾疫苗的研制开发提供新的理论依据。
1 材料与方法
1.1 实验动物免疫及P.y17XL攻击
将含有100 μg Pys48核酸疫苗的PBS缓冲液100 μL接种于6~8周雌性BALB/c小鼠的皮下肌肉内,对照组注射100 μL含有100 μg空质粒,分别于初次免疫后4周和8周,以等量质粒进行2次加强免疫。最后1次免疫4周后,经腹腔感染1×106P.y17XL寄生的红细胞(PRBC,日本爱媛大学分子寄生虫学教研室惠赠)。
1.2 方法
1.2.1 P.y17XL配子体分离[9]P.y17XL感染BALB/c小鼠,待感染率达40%~50%(配子体率5%左右),乙醚麻醉,心脏采血,经Fll纤维素柱去除白细胞,45%的Percoll密度梯度离心分离,室温2 000 r/min离心20 min,收集中间灰白层配子体,PBS清洗2次,取10 μL涂布载玻片,Giemsa染色,光镜下计数配子体含量,剩余配子体经0.01%皂甙-PBS裂解红细胞膜,-80℃冻存。1.2.2血清特异性抗体水平检测以5 μg/mL的配子体抗原包被96孔酶标板,5%脱脂奶粉PBS封闭1 h。以PBS缓冲液连续倍比稀释免疫后不同时间的小鼠血清,每孔100 μL。37℃孵育2 h,PBST清洗3次,每次5 min。加入5 000倍稀释的HRP标记的羊抗鼠IgG,孵育1 h,底物显色,待对照组开始显色即终止反应,酶标仪检测492 nm处OD值。结果判定:以吸光度大于阴性对照均值+3S.D作为阳性反应的标准。抗体效价为实验组和阴性对照组光吸收比值≥2.1时的最大稀释倍数。
1.2.3 体外培养合子和动合子尾静脉采集P.y17XL(1×106PRBC)感染疫苗免疫后小鼠的第3天血液10 μL于0.5 mL离心管中,加入动合子培养液(RPMI 1640,50 μg/mL次黄嘌呤,25 mmol/L Hepes,20%FCS,24 mmol/L NaHCO3,5 U/mL青霉素,5 μg/mL链霉素,pH 8.4)90 μL。24℃培养24 h,收集培养悬液,经PBS洗净、等量PBS悬浮后,取1 μL悬液滴于荧光载片(每个样本2个复孔),空气干燥,冷丙酮固定10 min。用含5%脱脂奶粉的PBS 37℃封闭30 min,PBS洗涤。加入FITC标记的羊抗鼠IgG(50×稀释)20 μL,37℃孵育60 min,封片,荧光显微镜下计数合子和动合子的形成数量。
1.2.4 统计学分析使用SPSS11.0统计软件对数据进行处理,标本采用独立样本t检验对数据做统计分析。
2 结果与分析
2.1 免疫血清特异性抗体水平
初次免疫4周后,疫苗免疫组小鼠血清抗体水平即开始升高。2次加强免疫后抗体一直维持较高水平,与空质粒组相比差异显著(P<0.05)(图1)。
2.2 BALB/c小鼠初次及加强免疫后血清抗体效价
Pys48核酸疫苗初次免疫后,抗体效价为1∶1 000,初次加强免疫效价为1∶3 200,再次加强免疫后抗体效价达1∶5 000(图2A),而空质粒组免疫后特异性抗体并未出现明显升高(图2B)。
2.3 合子及动合子培养及计数
与对照组P.y17XL感染相比,疫苗免疫组P.y17XL攻击后,其感染的血液经动合子培养基培养,可见合子和动合子的数量明显减少,具有显著差异(表1)。
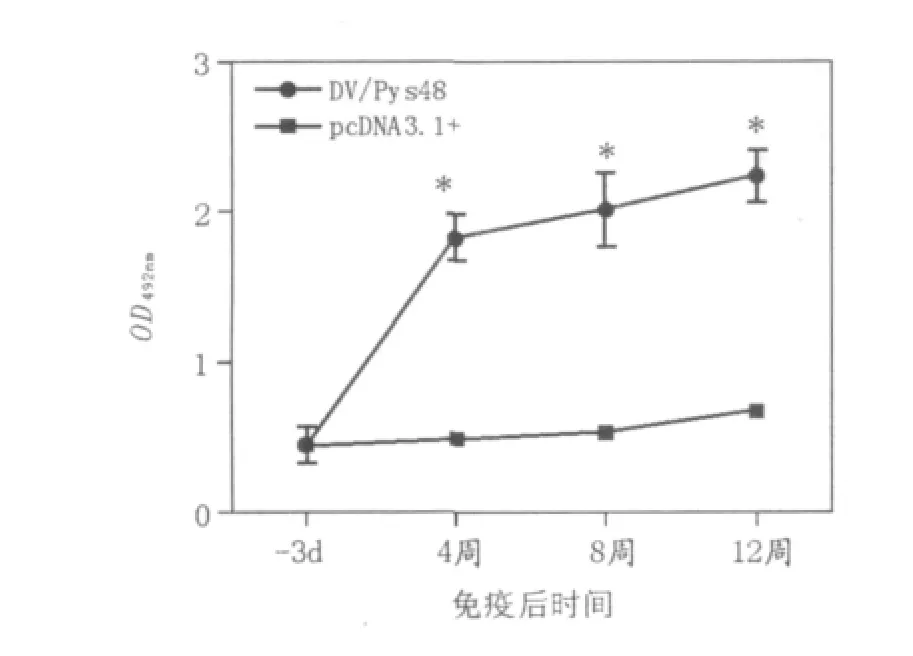
图1 BALB/c小鼠初次及加强免疫后特异性抗体水平Fig.1 Antibody level of BALB/c mice after 1stand boosting immunization

图2 BALB/c小鼠初次及加强免疫后特异性抗体效价Fig.2 Antibody titer of BALB/c mice after 1stand boosting immunization

表1 合子和动合子计数Table 1 The number of zygotes and ookinetes
3 讨论
重组蛋白的免疫原性依赖于抗原表位结构的正确折叠,佐剂的使用及多重免疫[10-11],然而核酸疫苗能够满足这些需求,DNA核酸疫苗作为一种新发展的疫苗研究方案,既可诱导体液免疫应答,又能够诱导细胞免疫应答[12]。在本实验中,Pys48核酸疫苗初次免疫后,小鼠血清特异性抗体即开始升高,效价约为1∶1 000,首次加强免疫后血清抗体效价约为1∶3 200,再次加强免疫相同剂量的疫苗血清抗体效价高达1∶5 000。由此表明,Pys48核酸疫苗免疫小鼠后,在小鼠体内成功表达,并诱发显著的体液免疫应答,产生特异性抗体。
由于P48蛋白自脊椎动物宿主体内疟原虫的有性阶段即配子体阶段开始表达,表达时相明显早于疟原虫有性阶段另一阻断靶位蛋白P25蛋白,自然感染可产生加强免疫效果[13],在宿主体内激发更高效价的特异性抗体,发挥传播阻断效应。因此探讨传播阻断疫苗免疫后所建立起来的免疫效应,通过再感染验证其是否具有传播阻断作用,将为有效疫苗的研制开发提供重要的理论依据。本研究结果发现,Pys48核酸疫苗免疫小鼠再感染,于感染后第3天经过体外培养含有配子体的感染血液中合子和动合子的数量明显减少,与对照组相比差异显著。提示Pys48核酸疫苗免疫BALB/c小鼠后通过在机体内所表达的蛋白抗原,建立起有效的免疫效应。当机体再次受到该抗原攻击时,可能激发宿主体内产生高效价的特异性抗体,中和配子体表面的相应抗原,从而影响了合子和动合子的发育,有效阻断疟疾的传播。综合分析认为,Pys48核酸疫苗具有良好的免疫原性,免疫小鼠后可以建立有效的传播阻断效应。
[1] WHO:World Malaria Report.2010.vii年度报告.
[2] Feachem RG,Phillips AA,Hwang J,et al.Shrinking the malaria map:progress and prospects[J].Lancet,2010,376(9752):1566-1578.
[3] Arévalo-Herrera M,Solarte Y,Marin C,et al.Malaria transmission blocking immunity and sexual stage vaccines for inter-rupting malaria transmission in Latin America[J].Mem Inst Oswaldo Cruz,2011,106(1):202-211.
[4] Dhama K,Mahesh Mahendran PK,Gupta A,et al.DNA vaccines and their applications in veterinary practice:current perspectives[J].Vet Res Commun,2008,32(5):341-356.
[5] David A.Malaria gametocytogenesis[J].Molecular and Biochemical Parasitology.2010,172(2):57-65.
[6] Bousema JT,Drakeley CJ,Kihonda J,et al.A longitudinal study of immune responses to Plasmodium falciparum sexual stage antigens in Tanzanian adults[J].Parasite Immunol,2007,29(6):306-317.
[7] Bousema JT,Sutherland CJ,Chrucher TS,et al.Human immune responses that reduce the transmission of Plasmodium falciparum in African populations[J].International Journal for Parasitology,2011,41(3-4):293-300.
[8] 郑丽,孟红蕊,姜懿凌,等.疟原虫配子体蛋白Pys48核酸疫苗的构建与免疫活性观测[J].寄生虫与医学昆虫学报,2010,17(2):81-84.
[9] Cao YM,Tsuboi T,Torii M.Nitric oxide inhibits the development of Plasmodium yoelii gametocytes into gametes[J].Parasitology International,1998,47(2):157-166.
[10] Haddad D,Maciel J,Kumar N.Infection with Plasmodium berghei boosts antibody responses primed by a DNA vaccine encoding gametocyte antigen Pbs48/45[J].Infection and Immunity,2006,74(4):2043-2051.
[11] Duffy PE,Kaslow DC.A novel malaria protein,Pfs28,and Pfs25 are genetically linked and synergistic as falciparum malaria transmission-blocking vaccines[J].Infect.Immun,1997,65(3):1109-1113.
[12] Kaslow DC,Bathurst I,Lensen T,et al.Saccharomyces cerevisiae recombinant Pfs25 adsorbed to alum elicits antibodies that block transmission of Plasmodium falciparum[J].Infect.Immun,1994,62(12):5576-5580.
[13] Lobo CA,Dhar R,Kumar N.Immunization of mice with DNA-based Pfs25 elicits potent malaria transmission-blocking antibodies[J].Infection and Immunity,1999,67(4):1688-1693.

