休哈塔假丝酵母乙醇发酵性能的研究
熊许洁,徐勇*,张晓燕,勇强,余世袁
(1.南京林业大学化学工程学院,江苏南京210037;2.林木遗传与生物技术教育部重点实验室,江苏南京210037;3.江苏省生物质绿色燃料与化学品重点实验室,江苏南京210037)
木糖是木质纤维原料中的仅次于葡萄糖的第二大糖组分,其高效的微生物发酵与转化是制约此类资源生物炼制的重要因素,也是纤维素燃料乙醇制备的技术瓶颈之一[1-3]。葡萄糖乙醇发酵的工业生产技术十分成熟,主要采用酿酒酵母(Sacchromyces cerevisiae)或运动发酵单胞菌(Zymomonas mobili),但是自然界中十分缺乏能够有效发酵木糖的微生物菌株,这成为了纤维素燃料乙醇工业化生产的技术瓶颈之一,研究和开发高性能的木糖发酵生产菌株一直是本领域的难点和重点[4-6]。前期研究表明,仅有休哈塔假丝酵母(Candida shehatae)和毕赤树干酵母(Pichia stipitis)等几个菌株具备木糖乙醇发酵工业化应用的发展潜力[4,7-8],但是对于它们糖类发酵特征、代谢调控网络及分子机制的基础性研究工作仍然十分薄弱[9-11],尤其是有关休哈塔假丝酵母的报道较少[12-13],严重制约了菌种的遗传改良和发酵工艺等相关研究。因此,进一步开展休哈塔假丝酵母的木糖代谢特征和发酵规律的研究十分必要。
1 材料与方法
1.1 材料
1.1.1 菌种休哈塔假丝酵母C.shehatae(ATCC 122984)由美国ATCC提供,经南京林业大学生物化工研究所驯化后保藏。
1.1.2 培养基酵母活化和增殖培养基(g/L):木糖10.0~20.0,蛋白胨10.0,酵母浸膏5.0;发酵基础培养基(g/L):采用单一木糖、单一葡萄糖或2种糖混合作为碳源,添加不同种类的氮源或发酵抑制物,再以无菌的柠檬酸缓冲液调节pH 5.0~6.0;氮源配方[14](终浓度,g/L):氮源Ⅰ(蛋白胨3.0,酵母浸膏3.0);氮源Ⅱ(尿素2.0,酵母浸膏2.0,磷酸二氢钾2.0);氮源Ⅲ(硫酸铵5.0,磷酸二氢钾3.0,硫酸镁0.5)。除注明外,其他发酵均采用氮源Ⅲ;添加发酵抑制物:在灭菌后的发酵基础培养基中直接添加适量的甲酸或乙酸,再以无菌的柠檬酸缓冲液调节pH 5.0~6.0。
1.2 方法
1.2.1 酵母培养与发酵在250 mL的摇瓶中加入50 mL活化培养基并以0.25 μm封口膜封口,经121℃灭菌25 min后冷却至30℃,由试管斜面接入菌种,转入振荡摇瓶在30℃和170 r/min条件下进行摇荡培养和发酵。培养至一定时间后,以4 000 r/min离心回收酵母,再转入增殖培养基增殖一轮,然后离心回收酵母,再接入不同的发酵培养基。根据初始糖浓度控制发酵液中的酵母浊度维持在一定的吸光度值(OD600nm)。定时取样0.5 mL进行色谱分析及细胞浊度测定。所有数据采用双平行实验的结果,控制平行误差在5%以下。
1.2.2 分析和计算方法①发酵液的色谱分析检测[15]:采用美国Agilent 1200型高效液相色谱仪(HPLC),以Aminex HPX87-H色谱柱分析和检测发酵液中的主要成分。色谱条件:柱温55℃,采用示差折光检测器(RI)以外标法检测。测定样品经10 000 r/min离心5min后取上清液,再经0.45 μm滤膜过滤后用于HPLC分析;②计算方法:糖利用率表示消耗糖的质量浓度与发酵初始糖的质量浓度的百分比。乙醇发酵得率是指发酵液中生成的实际乙醇量占所消耗糖所产生的理论乙醇量的相对百分比。其中,葡萄糖乙醇发酵的理论得率以0.51计,木糖以0.46计;③酵母浓度(OD600nm)的测定:采用比浊法,取发酵液经4 000 r/min离心5 min后再以0.9%生理盐水重复洗涤2遍,稀释至一定浓度后在1 cm光径的比色皿中测定600 nm处的吸光度值。
2 结果与分析
2.1 氮源配方对木糖发酵的影响
氮源是构成酵母细胞物质和一些代谢产物的必需营养元素,直接影响糖发酵的代谢流。取葡萄糖与木糖质量比为1∶3,以80 g/L的混合糖为底物碳源来评价氮源对酵母发酵性能的影响。考虑氮源对酵母的发酵和细胞生长均存在着较大的影响,为了全面观察和表征两者的变化,采用较低的初始酵母浓度(OD600nm=3.0)对3种典型的氮源配方进行比较发酵实验,发酵22 h后的结果见表1。从木糖的利用率和乙醇最终浓度指标来看,在3种氮源配方中的优劣顺序依次为硫酸铵>蛋白胨>尿素;从碳代谢流分析,有利于将木糖代谢导向乙醇而非木糖醇方向的氮源顺序为硫酸铵>蛋白胨>尿素;而就最适于酵母的细胞生长而言,先后顺序为蛋白胨>尿素>硫酸铵。这是由于蛋白胨含有营养丰富的蛋白质多肽、游离氨基酸及丰富的维生素等生长因子,会导致糖代谢流向酵母的细胞生长,反而对乙醇发酵不利。总体分析,基于木糖发酵产乙醇的角度考虑,在所实验的3种氮源配方中,硫酸铵为C.shehatae发酵木糖和葡萄糖混合碳源的最适氮源。
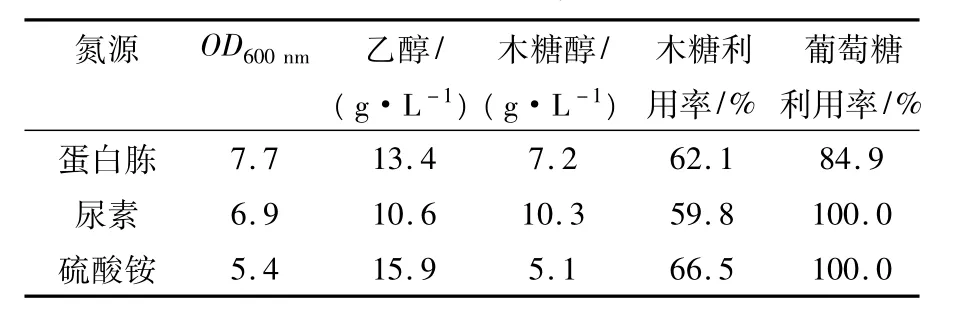
表1 氮源配方对休哈塔假丝酵母发酵性能的影响Table 1 Effects of various nitrogen source on ethanol fermentation by C.shehatae
2.2 单糖发酵的最适初始浓度
在不高于200.0 g/L的初始糖浓度范围内,以细胞浊度OD600nm≥40.0高细胞浓度C.shehatae采用氮源Ⅲ分别发酵不同浓度的木糖和葡萄糖液。在每种糖浓度条件下的发酵实验,均采用离心回收酵母重复发酵3轮的实验方法,在葡萄糖发酵48 h和木糖发酵96 h后取发酵性能稳定的实验数据。2种单糖对比发酵的实验结果见图1。发酵结果表明,C.shehatae对单一葡萄糖和木糖的发酵性能存在着明显的差异,主要表现在葡萄糖发酵的乙醇得率低于木糖。葡萄糖发酵主要生成乙醇,同时生成少量的甘油。在不高于200.0 g/L的初始糖浓度范围内,随着初始葡萄糖浓度的增加,尽管葡萄糖的利用率均可以保持在100%的水平,但是乙醇得率却呈缓慢下降的趋势。当葡萄糖浓度为164.0 g/L时,发酵48 h,乙醇浓度达到最高值61.9 g/L,对应的乙醇得率为75.2%;在此基础上,继续提高葡萄糖的浓度对乙醇生产无促进作用,却导致糖利用率和乙醇得率呈明显衰减的趋势。这表明,高浓度的葡萄糖及乙醇可对C.shehatae形成一定的抑制作用。与之相比,C.shehatae发酵木糖的主要产物为乙醇,并生成极少量的副产物木糖醇。木糖发酵产乙醇的最适初始糖浓度为120.0 g/L,发酵96 h,乙醇浓度达到最高值45.7 g/L,糖利用率和乙醇得率分别为94.8%和87.3%。该实验结果为目前C.shehatae摇瓶振荡发酵木糖产乙醇的较高水平[12-13]。
根据前期对P.stipitis等木糖发酵近缘菌株的微生物学研究可以推断:造成2种单糖发酵性能差异的主要原因与C.shehatae细胞膜上葡萄糖和木糖跨膜转运体系的差异有关[16-17],即由于此类酵母菌细胞膜上负责木糖跨膜转运的蛋白质为低亲和性蛋白,具有转运速率饱和性的限制特征。虽然木糖的跨膜转运为被动运送,受到环境木糖浓度的调控,但是当培养基中木糖浓度超过一定阈值时,其转运速率受载体蛋白的限制却并不能提高,最终导致木糖的利用率下降;同时,与葡萄糖相比,尽管木糖发酵会生成少量的木糖醇,但是C.shehatae胞质内的木糖代谢流大部分仍然被导向乙醇发酵途径,因而最终使木糖的乙醇发酵得率高于葡萄糖。由此可见,基于发酵性能考虑,C.shehatae具备了发酵木糖制备乙醇的生产潜力。
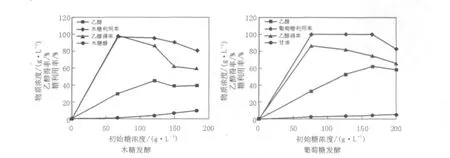
图1 休哈塔假丝酵母对不同初始浓度木糖和葡萄糖的对比发酵结果Fig.1 Effects of the initial concentration of xylose and glucose on ethanol fermentation by Candida shehatae
2.3 添加葡萄糖对木糖发酵性能的影响
C.shehatae对木糖和葡萄糖的发酵性能存在着显著差异,而在实际的木质纤维原料预处理液或酶水解液中均同时含有木糖和葡萄糖成分,只不过二者的比例因工艺而异。因此,研究葡萄糖对C.shehatae对木糖发酵性能的影响具有现实意义。为了缩短发酵实验时间,保持总糖初始浓度为70.0 g/L,分别选取单一木糖、单一葡萄糖和等量混合的木糖(35.0 g/L)加葡萄糖(35.0 g/L)在细胞浊度OD600nm≥40.0的条件下进行C.shehatae摇瓶对比发酵实验,发酵26 h后取样分析的结果见图2。图2表明,在相同的发酵时间内,向木糖中添加等量葡萄糖可显著提高糖利用率,由单一木糖的59.5%提高至混合糖的94.7%;与单一葡萄糖发酵相比,乙醇产量由27.8 g/L提高至28.8 g/L,乙醇得率由77.9%上升至89.6%(其中混合糖发酵的乙醇理论得率以0.485计)。这表明,在木糖中添加适量的葡萄糖可以实现C.shehatae对2种糖发酵性能的优势互补,这种特性有利于C.shehatae用于发酵木质纤维原料水解液。
2.4 乙酸对乙醇发酵的影响
乙酸是木质纤维原料预处理液及酶水解液中一种典型的发酵抑制物。目前,关于乙醇对酵母等微生物细胞生理抑制作用的机制尚未完全清晰,已知乙酸可抑制酵母细胞的生长及其对氧的吸收改变酵母的发酵方式,而休哈塔假丝酵母等木糖发酵菌株的乙醇发酵过程是一个兼性半厌氧过程,需要通过和消耗一定氧气,因此乙酸直接影响休哈塔假丝酵母的木糖发酵。以硫酸铵为氮源,分别在70.0 g/L单一葡萄糖或木糖培养基添加不同初始浓度的乙酸,在细胞浊度OD600nm≥40.0的条件下进行对比发酵。
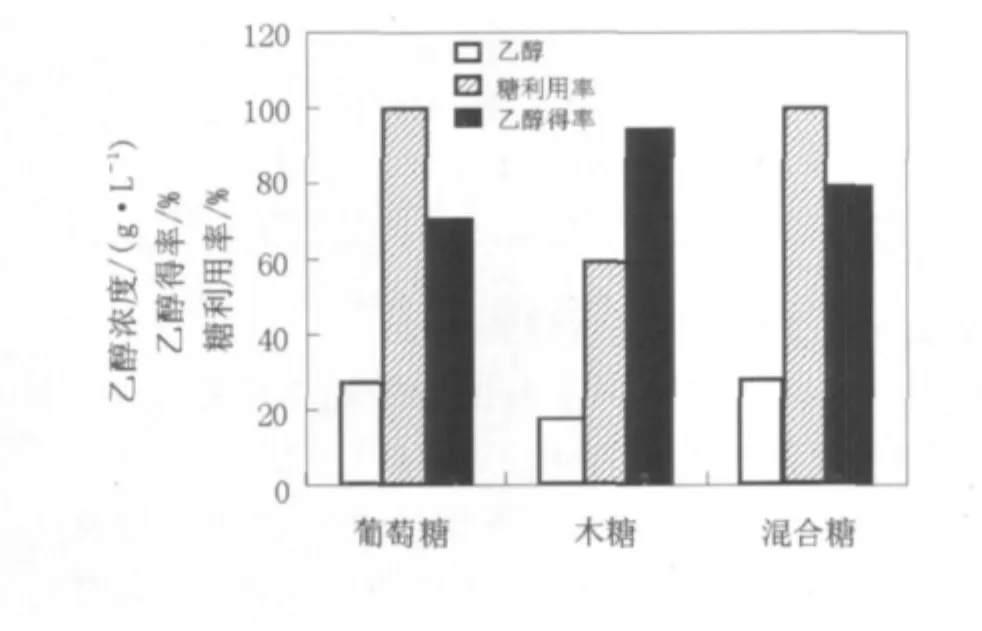
图2 添加葡萄糖对休哈塔假丝酵母木糖发酵性能的影响Fig.2 Effect of glucose loading on xylose fermentation by C.shehatae
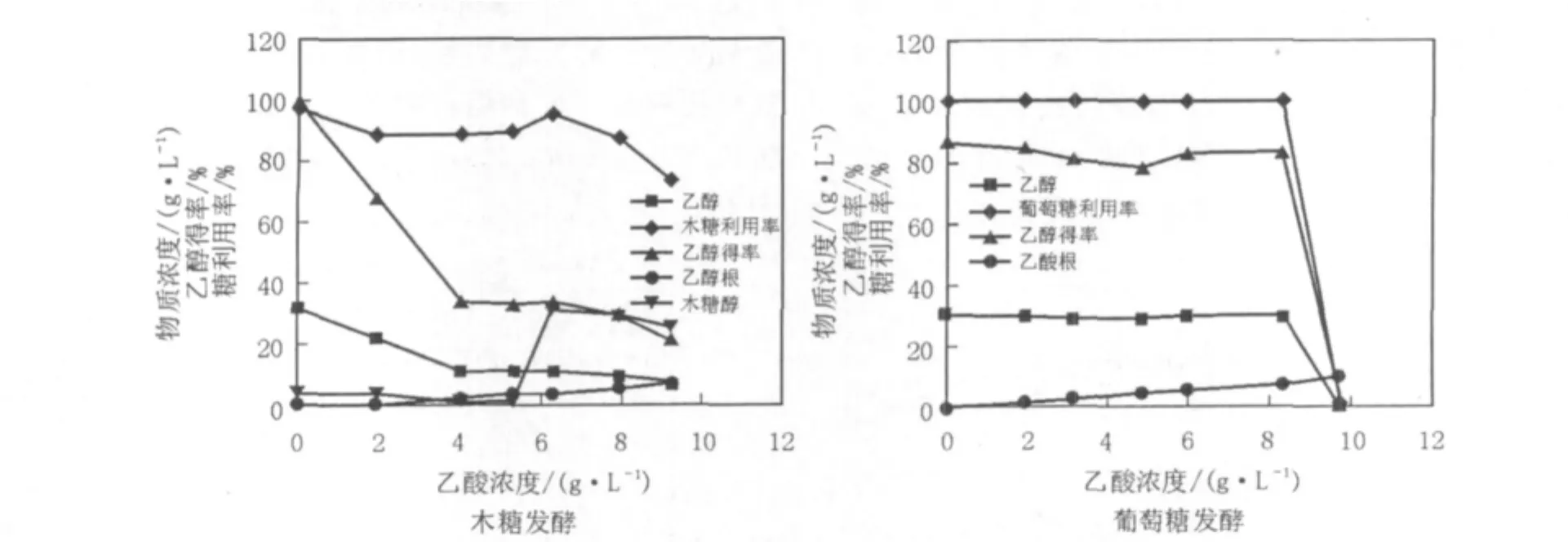
图3 乙酸浓度对休哈塔假丝酵母发酵木糖和葡萄糖的影响Fig.3 Effects of acetate concentration on xylose and glucose fermentation by C.shehatae
结果显示(图3):乙酸对C.shehatae的单一糖发酵抑制作用均存在着浓度阈值效应,即当乙酸增高至一定浓度值时才对该酵母的糖利用率显示出明显的抑制效应。在单一木糖发酵液中,当乙酸浓度达到6.28 g/L时木糖的利用率明显下降;而在葡萄糖中酵母对乙酸的耐受能力更强,直至乙酸浓度提高到8.32 g/L时,糖利用率才开始明显衰减。从糖利用率和乙醇得率指标来看,乙酸对木糖发酵的抑制作用明显强于葡萄糖。另外值得关注的是:一定浓度的乙酸还会对细胞内的木糖代谢流产生急剧的干扰。当乙酸浓度从5.28 g/L到6.28 g/L时,木糖发酵的副产物木糖醇的浓度由0.96 g/L急剧上升至30.6 g/L,而乙醇得率仅略有下降。由此推断,乙酸不仅抑制木糖进入酵母细胞的跨膜转运过程,同时也能够改变胞内的糖代谢流。一定浓度的乙酸可导致木糖醇的大量积累。
2.5 甲酸对乙醇发酵的影响
甲酸是木质纤维原料预处理液及酶水解液中另一种典型的发酵抑制物,添加甲酸的木糖和葡萄糖对比发酵结果见图4。
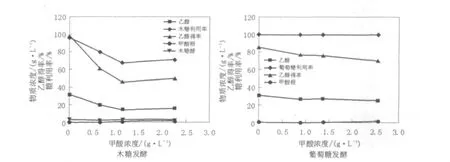
图4 甲酸浓度对休哈塔假丝酵母木糖和葡萄糖发酵的影响Fig.4 Effects of formate concentration on xylose and glucose fermentation by C.shehatae
结果表明:甲酸对C.shehatae的木糖发酵抑制作用明显比乙酸强烈,1.15 g/L甲酸即可严重影响C.shehatae的木糖利用率和乙醇得率,而它对葡萄糖发酵的抑制作用较木糖弱,加入2.55 g/L甲酸对葡萄糖的利用率几乎也没有明显的影响,只是会导致乙醇得率表现出缓慢下降的趋势。同时,与乙酸抑制作用的另一个不同之处在于:低浓度的甲酸不会导致木糖发酵过程中木糖醇的累积。
3 结论
C.shehatae发酵单一葡萄糖的浓度达到164.0 g/L,可生成61.9 g/L和乙醇,糖利用率和乙醇得率分别为99.8%和74.0%;对单一木糖的发酵浓度为120.0 g/L,可生成45.7 g/L乙醇,糖利用率和乙醇得率分别为94.8%和87.0%。C.shehatae具备了发酵木糖制备乙醇的生产潜力。
添加葡萄糖有利于促进C.shehatae的木糖发酵,其木糖发酵产乙醇的最适氮源为硫酸铵。
乙酸和甲酸主要抑制C.shehatae的糖跨膜转化和细胞内糖代谢流,2种抑制物对木糖发酵的抑制作用均明显强于葡萄糖。甲酸对C.shehatae木糖发酵过程的抑制作用明显强于乙酸。C.shehatae葡萄糖发酵时的乙酸和甲酸的耐受浓度分别为8.32 g/L和2.55 g/L,木糖发酵时的乙酸和甲酸的耐受浓度分别为6.28 g/L和1.15 g/L。
[1] Marie J,Bjorn J,Hahn-Hagedal B,et al.Reduces oxidative pentose pathway flux in recombinant xylose-utilizing Saccharomyces cerevisiae strains improves the ethanol yield from xylose[J].Appl Environ Microbiol,2002,68(4):1604-1609.
[2] Jeppson M,Traff K,Johansson B,et al.Effects of enhanced xylose reductase activity on xylose consumption and product distribution in xylose-fermenting recombinant S.cerevisiae[J].FEMS Yeast Res,2003,3(2):167-175.
[3] Jeppsson H.Pentose utilization in yeasts:Physiology and biochemistry[D].Lund Univ Sweden,1996:6-7.
[4] Brigham J S,Adney W S,Himmel M E.Hemicellulose:diversity and applications[J].In Wyman CE(eds)Handbook on bioethanol:production and utilization.Taylor and Francis,Washington,DC,1996:119-142.
[5] Zaldivar J,Nielsen J,Olsson L.Fuel ethanol production from lignocellulose:a challenge for metabolic engineering and process integration[J].Appl Microb Biotech,2001,56(1-2):17-34.
[6]Jeffries T W,Engineering yeasts for xylose metabolism[J].Current Opinion in Biotechnology,2006,17(3):320-326.
[7] Jeffries T W,Grigoriev Igor V,Grimwood J,et al.Genome sequence of the lignocellulose-biocenverting and xylose-fermenting yeast Pichia stipites[J].Nature Biotechnology,2007,25(3):319-326.
[8] Saddler J N.(edn)Bioconversion of forest and agricultural plant residues,Wallingford,UK:CAB Inter,1993.
[9] Dupreez J C and Prior B A.A quantitative screening of some xylose-fermentation yeast isolates[J].Biotechnol Lett,1985,7(4):241-246.
[10] Hahn-Hagerdal B,Jeppsson H,Skoog H.Biochemistry and physilolgy of xylose fermentation by yeast[J].Enzyme Microb Technol,1994,16(11):933-943.
[11] 徐勇.木糖代谢关键酶基因克隆及重组酵母菌株构建[D].南京:南京林业大学,2005.
[12] Sarad P,Yu S Y,Morris W.Adaptation of Candida shehatae and Pichia stipites to wood hydrolysates for increased ethnol production[J].Appl Microbiol Biotechnol,1986,25(3):300-304.
[13] Morris W,Sarad P.Ethanol and sugar tolerance of Candida shehatae[J].Biotechnology Letters,1985,7(12):909-912.
[14] 季更生,勇强,余世袁.不同培养条件对树干毕赤酵母戊糖发酵的影响[J].林产化学与工业,2004,24(2):26-28.
[15] Sluiter A,Hanes B,Ruiz R,et al.Laboratory technical report NREL/TP-510-42618[R/OL](2008-04-25)[2009-11-01].http://www.nrel.gov/biomass/pdfs/42618.pdf..
[16] Buziol S,Becker J,Baumeister A,et al.Determination of in vivo Kinetics of the Starvation-induced Hxt5 Glucose Transports of Saccharomyces cerevisiae[J].FEMS Yeast Res,2002,2(3):283-291.
[17] Meinander N Q,Hahn-Hagerdal B.Influence of Cosubstrate Concentration on xylose Conversion by Recombinant,XYL1-expressing Saccharomyces cerevisiae:A Comparison of Different Sugars and Ethanol as Cosubstrate[J].Appl.Environ.Microbiol,1997,63(5):1959-1964.

