中性纤维素酶外切葡聚糖酶CBHⅡ的异源表达
林国滟,蔡少丽,黄平,郑海英,柯崇榕,杨章萍,蔡水淋,林艺平,黄建忠
(福建师范大学工业微生物教育部工程研究中心生命科学学院福建省现代发酵技术工程研究中心,福建福州350108)
中性纤维素酶在棉织品水洗整理工艺及洗涤剂工业中应用广泛,其较酸性纤维素酶整理效果好,对织物损伤小,防沾色效果优良[1]。中性纤维素酶由内切-β-葡聚糖苷酶(endo-1,4-β-D-glucanases,EC3.2.1.4,EG)、纤维二糖水解酶(1,4-β-D-cellobiohydrolases或exo-1,4-β-D-glucanases,EC3.2.1.91,CBH)、β-葡萄糖苷酶(1,4-β-D-glucosidases,EC3.2.1.21,BG)3个主要成分组成[2],3种酶协同作用将纤维素转化成葡萄糖[3]。其中纤维二糖水解酶能作用于纤维素多糖链的还原性和非还原性末端,释放葡萄糖或纤维二糖;还能作用于微晶纤维素,原因可能是其能从微晶纤维素的结构中驱除纤维素链。有研究表明,纤维素酶系中,CBHⅡ的表达量低于CBHⅠ,但CBHⅡ的酶特异性强,相对酶活比CBHⅠ高2倍左右[4-5],因此CBHⅡ对整个纤维素酶系起着重要的调控作用[6]。甲醇型毕赤酵母具有真核表达系统的优点:如蛋白加工、折叠、翻译后修饰等。这些优点使甲醇型毕赤酵母作为蛋白表达系统的应用越来越广泛[7-9]。本研究利用RT-PCR的方法,从特异腐质霉Humicola insolens中克隆到中性纤维素酶外切葡聚糖酶基因CBH-cDNA,并构建了毕赤酵母表达载体pPIC9K-CBHⅡ,实现其在毕赤酵母GS115中的表达,为进一步研究外切葡聚糖酶的高效表达奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒特异腐质霉(Humicola insolens)、大肠埃希菌(E.coli)DH5α、巴斯德毕赤酵母菌株(P.pastoris)GS115、pPIC9K质粒由本实验室保存,pPMD18T载体购自TaKaRa公司。
1.1.2 酶和试剂Extaq酶、限制性内切酶EcoRⅠ、NotⅠ、StuⅠ、T4DNA连接酶均购自TaKaRa公司;胶回收试剂盒、Agar A均购自上海生工;其余试剂均为进口或国产分析纯。引物由上海生工合成。
1.1.3 培养基LB培养基(%):蛋白胨1,氯化钠0.5,酵母浸出物0.5;YPD培养基(%):酵母提取物1,胰蛋白胨2,葡萄糖2;MGY培养基(%):酵母提取物1,胰蛋白胨2,100%甘油1,pb 6.0 10%;MMY发酵培养基(%):酵母提取物1,胰蛋白胨2,pb 7.0 10%。
1.2 方法
1.2.1 CBHⅡ基因的获得以总RNA为模板,通过RT-PCR扩增得到CBHⅡcDNA。根据NCBI上的报道的T.reesei的CBHⅡ基因序列,设计引物:P1:5'-G GAATTC CAGCAGGCCGGCACCATCACC-3',P2:5'-G GCGGCCGCTTAGACGTTGACGGTCGAGCC-3',在P1前添加EcoRⅠ酶切位点,在P2添加NotⅠ酶切位点,经PCR获得CBHⅡ目的基因。
1.2.2 毕赤酵母重组表达载体的构建与转化CBHⅡcDNA经EcoRⅠ、NotⅠ双酶切后,与经过相同双酶切的pPIC9K过夜连接,得到重组质粒pPIC9K-CBHⅡ。经StuⅠ酶线性化后,电转化至酵母GS115中,涂布含有His+筛选标记的MD平板上,28℃培养2~5 d至转化子出现。
1.2.3 重组毕赤酵母工程菌株的筛选和鉴定重组毕赤酵母菌株的PCR鉴定:用玻璃珠法提取酵母基因组DNA[10],以此为模板,P1P2为引物,进行PCR扩增。
1.2.4 重组毕赤酵母工程菌株的诱导表达挑取阳性重组子于3 mL YPD液体培养基中,28℃,230 r/min振荡培养过夜;取0.08 mL的过夜培养物转接到含有30 mL MGY的250 mL锥形瓶中,过夜培养至次日,使OD600=5~10。转换培养基至MMY中,使初始OD600=1,28℃,230 r/min振荡培养6 d,12 000 r/min离心5 min,收集上清,即为粗酶液。
1.2.5 重组毕赤酵母表达产物的分析①SDSPAGE:取粗酶液30 μL,进行SDS-PAGE分析重组蛋白的表达情况;②刚果红平板定性检测:取10×浓缩的发酵液30 μL加入到定性检测平板上,反应40 min后,再次加入30 μL酶液,观察其水解圈大小;③DNS酶活性的测定:取粗酶液200 μL与1.5%的羧甲基纤维素钠在50℃反应30 min,加入3 mL DNS,混匀,沸水浴10 min后,定容,测OD540。酶活单位(U)定义为1 min消解CMC-Na产生1 μg还原糖(葡萄糖)所需的酶量;④pNPC酶活性的测定:取粗酶液100 μL与50 μL 1 mg/mL的pNPC在50℃反应24 h,测OD405。酶活单位(U)定义为1 min水解pNPC产生1 μg对硝基酚所需的酶量。
2 结果与分析
2.1 特异腐质霉总RNA的提取
利用Trizol提取特异腐质霉的总RNA,在TAE为电泳缓冲液的凝胶电泳中可见明显的28S和18S,mRNA成薄雾状分布于整个泳道,说明提取的RNA完整性很好,提取该RNA的总浓度为2.080 μg/μL。

图1 特异腐质霉总RNAFig.1 Total RNA of Humicola insolens
2.2 CBHⅡcDNA的克隆
经RT-PCR扩增得到的CBHⅡ的cDNA,约为1 290。将CBHⅡcDNA序列在NCBI上进行Blast分析,扩增片段与H.grisea CBHⅡ基因的同源性为100%。
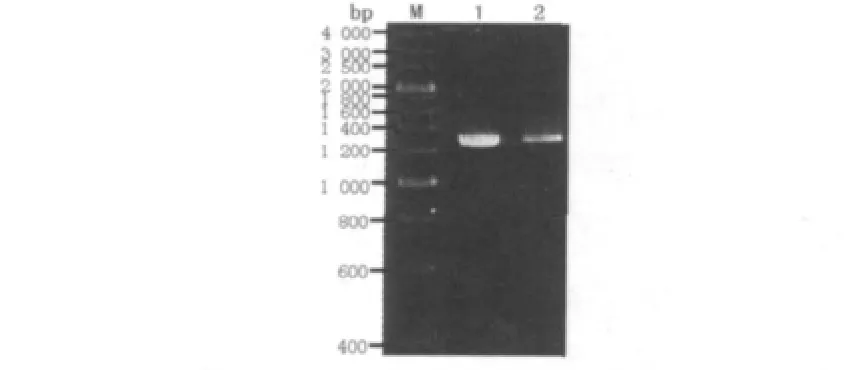
图2 特异腐质霉CBHⅡ基因电泳图Fig.2 Electrophoresis of CBHⅡgene
2.3 表达载体的构建
CBHⅡcDNA经EcoRⅠ、NotⅠ双酶切后,与经过相同双酶切的pPIC9K过夜连接,插入α-因子信号肽序列的下游,得到重组质粒pPIC9KCBHⅡ,双酶切和测序结果表明插入片段在pPIC9K中有正确的阅读框。

图3 pPIC9K-CBHⅡ质粒的双酶切验证Fig.3 Identification of pPIC9K-CBHⅡby double digestion
2.4 重组毕赤酵母菌株的筛选和鉴定
pPIC9K-CBHⅡ经StuⅠ酶线性化后,电转化至酵母GS115中,挑取MD板上的单菌落于3 mL YPD液体培养基中,28℃振荡过夜培养。分别进行菌液PCR鉴定及提取重组菌株基因组DNA进行PCR鉴定,结果表明CBHⅡcDNA序列已插入到毕赤酵母的基因组中。

图4 重组表达质粒pPIC9K-CBHⅡ的线性化Fig.4 Linearization of pPIC9K-CBHⅡ

图5 重组毕赤酵母菌株pPIC9K-CBHⅡ-GS115的PCR鉴定Fig.5 PCR verification of the transformant pPIC9K-CBHⅡ-GS115
2.5 重组毕赤酵母表达产物分析
2.5.1 刚果红平板定性检测在刚果红平板上可以看到pPIC9K-CBHⅡ-GS115产生的清晰的水解圈,与对照pPIC9K-GS115相比,前者水解圈较大,但不是十分透亮,究其原因可能是与发酵液的酶活力较低有关(图6)。
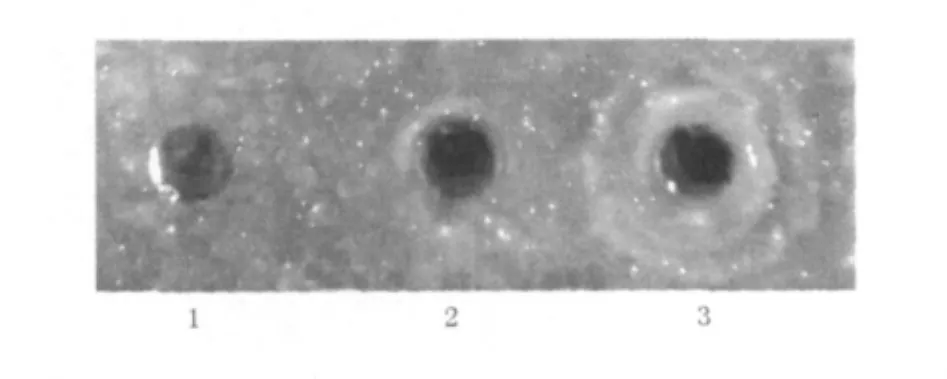
图6 重组外切葡聚糖Ⅱ的刚果红平板定性检测Fig.6 Qualitative detection of recombinant CBHⅡon agar medium
2.5.2 SDS-PAGE 银染结果表明,重组CBHⅡ实现了在毕赤酵母中的分泌表达,gel pro Analyser软件分析其表达蛋白的表观分子量约为62.548 ku(图7),大于预测的分子量55 ku,推测表达产物在翻译后修饰时发生了糖基化。用BandScan软件分析其蛋白表达量为2.3%,即0.738 μg/mL。
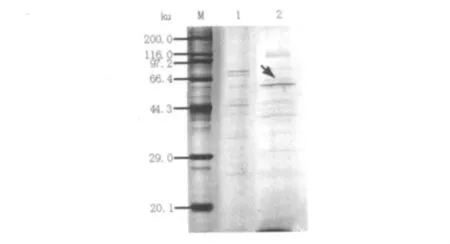
图7 重组CBHⅡ的SDS-PAGE分析Fig.7 The SDS-PAGE analysis of the recombinant CBHⅡ
3 讨论
近年来,国内外有许多关于纤维素酶基因的克隆及表达的报道。其中对中性纤维素内切酶的研究较多,而对于外切酶的研究较少,但事实表明对具有同工酶作用的中性纤维素外切酶的研究也是相当重要的。研究表明,当CBHⅡ基因缺失时,会影响纤维素酶系其他酶的表达,而CBHⅡ过量表达时,则诱导纤维素酶系其他基因(CBHⅠ)的表达[11]。
本研究在巴斯德毕赤酵母系统中表达了特异腐质霉CBHⅡ基因,通过将目的基因构建到pPIC9K上,利用电转将线性化的pPIC9K-CBHⅡ转入毕赤酵母中,整合到毕赤酵母的基因组上,对其表达进行鉴定。初步研究该重组子产酶最高达20 U,甲醇诱导最佳尝试为1.5%,250 mL摇瓶装量30 mL的通气量对表达有促进作用。本实验外切葡聚糖酶基因编码的成熟肽在毕赤酵母中表达分子量为62.548 ku,大于预测分子量(55 ku),推测是糖基化作用提高了表达成熟肽的分子量。
本实验中发酵上清液水解CMC-Na的酶活力为38 U/mL,消解pNPC的酶活力为2.97 U/L。CBHⅡ基因在毕赤酵母中表达时,重组蛋白的酶活不高,可能原因有:①重组蛋白的过糖基化。有文献报道过糖基化可使重组蛋白产量降低,或功能受到影响[12-13]。用NetNGlyc 1.0 Server对CBHⅡ序列进行糖基化位点预测表明,CBHⅡ的452、496位的天冬酰胺残基为潜在的N-糖基化位点。所以,过糖基化很可能对其催化活性产生较大的影响;②密码子偏好性。由于CBHⅡ基因来自与毕赤酵母不同种属的特异腐殖霉,2物种的密码子偏好性很可能有差异。在线分析(http://molbiol.ru/eng/scripts/01_11.html),发现CBHⅡ有8个编码精氨酸(Arg)的密码子,分别为13(AGG)、18(AGG)、67(AGG)、91(AGG)、95(AGG)、295(AGG)、432(AGA)、515(AGA),稀有密码子数量多会减慢翻译过程中核糖体的运动速度,导致蛋白表达水平降低;③纤维素酶的协同作用。纤维素各组分协同作用才能高效地把纤维素降解成为葡萄糖,而本实验构建的毕赤酵母为外切纤维素酶单一组分,其酶活性必然受到影响。
本文通过蛋白质工程手段使特异腐质霉CBHⅡ获得异源表达。研究仅在摇瓶做了初步实验,未对温度、pH值等影响目的基因表达的条件进行优化,也是影响重组蛋白表达和酶活力的原因之一。今后有必要对重组菌株的发酵条件进一步优化,寻找较为合适的表达条件,并对重组酶产酶动力学和酶学性质做详细研究。另外,通过密码子优化、定点突变、同源表达等手段,使蛋白产量得以提高,有关研究将在今后作进一步报道。
[1] 许爱国,阎春娟,徐升运.中性纤维素酶在棉织物整理中的应用[J].印染,2006,32(21):11-12.
[2] Han SJ,Yoo YJ,Kang HS.Characterization of a bifunctional cellulase and its structural gene[J].Journal of Biological Chemistry,1995,270(43):26012-26019.
[3] 吴振芳,陈惠,曾民.内切葡聚糖酶基因在毕赤酵母中高效表达研究[J].农业生物技术学报,2009,17(3):529-535.
[4] Seiboth B,Hakola S,Mach RL,et al.Role of four major cellulases in triggering of cellulase gene expression by cellulose in Trichoderma reesei[J].Journal of bacteriology,1997,179(17):5318-5320.
[5] Mach R L,Seiboth B,Myasnikov A,et al.The bgl1 gene of Trichoderma reesei QM9414 encodes an extracellular,cellulose-inducible-glucosidase involved in cellulase induction by sophorose[J].Mol Microbiol,1995,16(4):687-697.
[6] 刘泽寰,全艳彩,唐根云,等.绿色木霉CBHⅡ基因的克隆及在酿酒酵母中的表达[J].华南理工大学学报,2009,37(6):91-95.
[7] Wang H,Lu F,Sun Y,et al.Heterologous expression of lignin peroxidase of Phanerochaete chrysosporium in Pichia methanolica[J].Biotechnology letters,2004,26(20):1569-1573.
[8] Kjeldsen T,Pettersson AF,Hach M.Secretory expression and characterization of insulin in Pichia pastoris[J].Biotechnology and applied biochemistry,1999,29(1):79-86.
[9] Ludovic O,Eric R,Sonia L.Molecular cloning of the cDNA encoding laccase from Pycnoporus cinnabarinus 1-937 and expression in Pichia pastoris[J].Eur.J.Biochem,2000,267(6):1619-1625.
[10] J萨姆布鲁克,DW拉塞尔,黄培堂等著.分子克隆实验指南(第3版)[M].北京:科学出版社,2002.
[11] 胡耀辉,闫舟,于寒松.高产纤维素酶绿色木霉基因工程菌的构建.[J]安徽农业科学.2010,(25):13617-13619.
[12] 顾园,诸欣平,王少华.毕赤酵母表达蛋白质的糖基化[J].生命的化学,2004,24(004):353-355.
[13] Saito A,Usui M,Song Y,et al.Secretion of glycosylated α-lactalbumin in yeast Pichia pastoris[J].Journal of biochemistry,2002,132(1):77-82.

