曲酸生产菌的60CO-γ射线诱变选育及表征
解西玉,曾柏全,周小芹,许 志,宋 睿
(中南林业科技大学生命科学与技术学院,湖南长沙410004)
曲酸生产菌的60CO-γ射线诱变选育及表征
解西玉,曾柏全*,周小芹,许 志,宋 睿
(中南林业科技大学生命科学与技术学院,湖南长沙410004)
为了获得高产曲酸菌株,采用不同剂量60Co-γ射线对出发菌株米曲霉进行辐射诱变处理。结果表明,当60Coγ射线辐射剂量为800Gy时,对出发菌株的诱变效果最好,使突变菌株C8-128的曲酸产量由出发菌株的15.68g/L增加到61.5g/L,产量提高292.2%,经遗传稳定性实验,得出其有良好的遗传稳定性,产酸能力稳定。将筛选出的高产曲酸菌株C8-128通过菌落形态和摇瓶发酵培养特征与亲株进行比较,得出出发菌株经60Co-γ射线辐射诱变后产生的一些特征性变化。
60Co-γ射线,曲酸,米曲霉,诱变,表征
曲酸(kojic acid),化学名α-羟甲基-5-羟基γ-吡喃酮,是由微生物好氧发酵产生的具有杀菌作用的次级代谢产物[1-4];是由葡萄糖未经碳架断裂[5],直接氧化脱水而成。该化合物作为美白祛斑剂、防腐剂、止痛剂、抗紫外线辐射剂、杀虫剂等被广泛应用于化妆品、食品、医药、农业生产等多个领域[6-8];此外,曲酸还可作为合成生物可降解塑料的原材料[9]、香料合成的中间体等。自20世纪70年代以来,由于曲酸的广泛应用,国内外很多著名学者都对曲酸的发酵生产进行了广泛而深入的研究,并取得了一定进展。60Co-γ射线是电离生物学上应用最广泛的电离射线之一[10],它能引起水和其他物质的离子化,从而产生间接的诱变效应[11],此法具有突变率高、后代性状稳定、育种周期短等优点[12]。本研究通过利用60Co-γ射线对出发菌株进行诱变选育,旨在降低曲酸生产成本,提高生产效率,为曲酸的工业化生产奠定坚实基础。
1 材料与方法
1.1 实验材料
米曲霉(Aspergillums oryzae) 由本生物工程实验室从霉变的冰糖橙皮上筛选获得;曲酸标准样品德国Riedel-de Haen公司,分析纯;斜面保藏培养基 PDA培养基;活化培养基 葡萄糖10%、酵母膏0.5%、KH2PO40.5%、MgSO4·7H2O 0.25%,pH6.0;筛选培养基 活化培养基中加入0.1%FeCl3;摇瓶发酵培养基 葡萄糖10%、酵母膏0.25%、KH2PO40.5%、MgSO4·7H2O 0.25%,pH 6.0。
1.2 实验方法
1.2.1 测定方法
1.2.1.1 曲酸含量测定 采用Fe3+-HCl[13]法。
1.2.1.2 生物量的测定 取 50mL发酵液离心(5000r/min,20min),收集湿菌体,置60℃下恒温干燥至恒重(M),用称重法测定其生物量,生物量(g/L)=M×20
1.2.2 诱变方法
1.2.2.1 孢子悬液的制备 用生理盐水将出发菌株斜面上的孢子洗下,倒入装有玻璃珠的250mL三角瓶中,置于转速180r/min的旋转摇床上旋转30min,待孢子分散成单个孢子后用无菌脱脂棉过滤,得单孢子悬浮液。血球计数板计数,调整孢子浓度为106个/mL。
1.2.2.260Co-γ射线诱变 20mL孢子悬液于50mL无菌三角瓶中,在湖南原子能研究所,分别以400、600、800、1000Gy的γ射线辐射剂量对其进行辐射诱变处理。
1.2.3 摇瓶发酵 挑取一环斜面培养5d的出发菌株孢子于装有50mL发酵培养基的250mL摇瓶中,置于转速为200r/min的旋转式摇床上,恒温30℃发酵培养7d。
2 结果与分析
2.1 γ射线对出发菌株致死率和突变率的影响
一切诱变剂都具有杀菌和诱变双重效应,因此确定射线辐射诱变后菌株的致死率和突变率显得很有必要。γ射线辐射后的菌悬液适当梯度稀释涂布平板后培养3d,以未照射菌悬液作为对照,计算在不同γ射线辐射剂量下辐照后的孢子致死率。分别挑取各不同γ射线辐射剂量诱变后的菌株50株,进行摇瓶发酵产酸实验,测其曲酸产量。规定产酸能力超过出发菌株5%及以上的突变株为正突变株,产酸能力低于出发菌株5%以下的菌株为负突变株,计算各不同γ射线辐射剂量照射下的正突变率和负突变率,结果见图1。
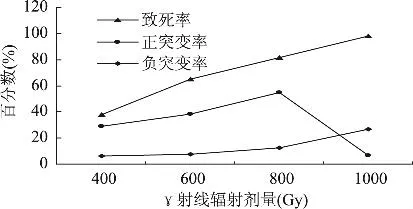
图1 不同γ射线辐射剂量下的致死率和突变率
从图1可以看出,γ射线对此菌株有较好的诱变效应。致死率与射线辐射剂量成正比关系,即辐射剂量越大,菌株致死率越高。在低剂量范围内,孢子存活率较高,突变率随射线辐射剂量的增大而增大,当辐射剂量为800Gy时,杀菌率为81.6%,正突变率达最大值54.7%,但当剂量为1000Gy时,正突变率却迅速降低为6.8%,而负突变率却升为最大,由此确定γ射线对此出发菌株的最佳诱变剂量为800Gy。
2.2 γ射线诱变对曲酸产量的影响
选取800Gy γ射线辐射剂量下R值(变色圈直径与菌落直径的比值)较大,且红色晕圈颜色较深的200株单菌落接种于斜面培养,并进行反复发酵产酸实验,最终将产酸能力较高的突变株列出,见表1。

表1 曲酸产量较高的突变株
由表1可以看出,γ射线的辐射剂量为800Gy时,对出发菌株有非常好的诱变效应,这说明从冰糖橙皮上分离出的野生型菌株对γ射线有较强的敏感性。其中,产酸量最高的菌株C8-128可以产生曲酸61.5g/L,产量提高292.2%。
2.3 遗传稳定性实验
将上述4株突变株传代六次,并对每一代菌株都进行摇瓶发酵产酸实验,结果表明,突变株C8-128有较高的遗传稳定性,每一代菌株的曲酸产量都能维持在稳定范围内。
2.4 突变株与亲株的比较
2.4.1 突变株与亲株的菌落形态比较 由图2、图3可以看出,突变株C8-128的菌落直径小于亲株,且生长速度稍慢;但突变株C8-128在生长早期即能产生大量曲酸(为了既不影响菌落形态的观察又不影响红色晕圈的观察,此平板培养基中只加入0.001%的FeCl3)。此结果符合以往经验,即菌物体生长越旺盛,产物的生成量越少。
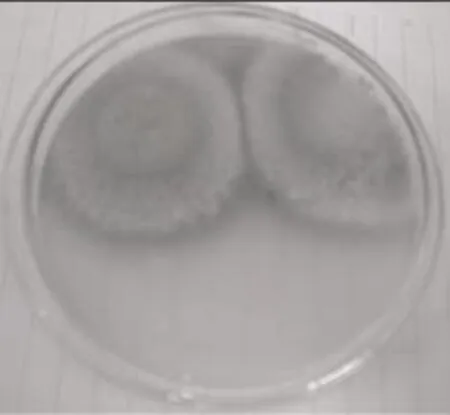
图2 突变株

图3 亲株
2.4.2 突变株与亲株的摇瓶发酵特征比较 由表2可以看出,突变株C8-128摇瓶发酵产酸实验时,其菌丝球比亲株的菌丝球小1倍多,使培养基中营养成分到菌球体内部的物质传递受限度变小;发酵液的粘稠度也比亲株小很多,此优势增加了氧溶解和营养物质的传递速率,同时也能使培养液的后处理变得更加容易;终pH比亲株的更接近空白培养基的pH(在同样条件下,未接入菌体的发酵培养基在旋转摇床上旋转培养相同时间后的培养基为空白培养基,其终pH为5.11),这说明,突变株在摇瓶发酵培养过程中能维持较高pH环境,因为过低的pH环境不利于产物的生成;生物量是亲株的3倍多,与以往记载相吻合,即在一定条件下,生物量越多,菌株产生的目的产物也越多。
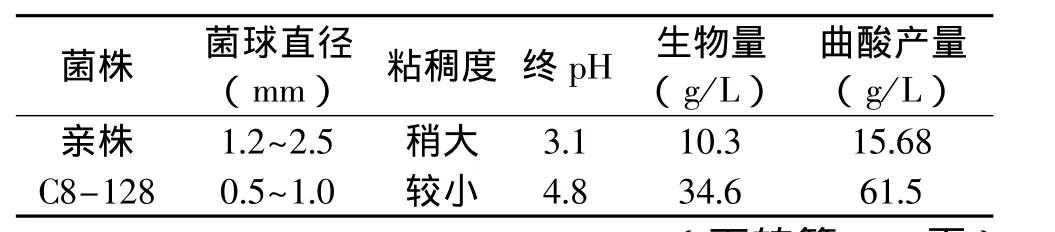
表2 突变株与亲株摇瓶发酵特征
3 结论
实验表明,γ射线诱变米曲霉产生曲酸是有效的,不仅在曲酸得率上有较大提高,而且菌株的培养特征也有所变化,其最佳辐射诱变剂量为800Gy。本实验筛选到的高产曲酸菌株C8-128的曲酸产量比亲株提高了292.2%,最终产量达到了61.5g/L,经6代稳定性遗传实验,确定其产酸能力能维持在一个恒定的水平。通过对突变株C8-128的菌落形态的观察,及摇瓶发酵产酸实验时的一些培养特征,得出突变株的优越性:菌落在平板上长出的菌落大小适中,生长早期即能产生大量曲酸;摇瓶发酵实验时菌丝球较小,发酵液粘稠度小,终pH能维持在有利于曲酸生成的较高pH水平,生物量也比出发菌株多。
[1]Majmudar G,Jacob G,Laboy Y,et al.An in vitro method for screening skin-whitening products[J].Cosmet Sci,1998,49:361-367.
[2]陈永红,邹志飞,王岚,等.曲酸对动物的毒性研究及安全性评价[J].食品科学,2007,28(9):536-537.
[3]M ROSFARIZAN,A B ARIFF,M A HASSAN,et al.Kojic acid production by Aspergillus flavus using gelatinized and hydrolyzed sago starch as carbon sources[J].Folia Microbiol,1998,43(5):459-464.
[4]沈卫荣,沈俭,韩丽萍,等.曲酸生产菌的复合诱变选育[J].微生物学通报,2003,30(4):60-64.
[5]Arnstein H R V,et al.The biosythesis of kojic acid,lproduction from[1-14C]and[2-14C 2]-1,3-dihydroxyacetone[J].Biochem,1953,54:493-50.
[6]H M Wan,C C Chen,R Giridhar,et al.Repeated-batch production of kojic acid in a cell-retention fermenter using Aspergillus oryzae M3B9[J].Ind Microbiol Biotechnol,2005,32:227-233.
[7]陈亮,蒋诗平,万里飚,等.曲酸生产菌的同步辐射软X射线诱变选育和发酵动力学研究[J].辐射研究与辐射工艺学报,2006,24(5):308.
[8]陆正清,王艳.曲酸的发酵法生产及其在食品加工中的应用[J].中国调味品,2008(1):65-67.
[9]Tomita I,Mitsuhashi K,Endo T.Synthesis and radical polymerization of styrene derivative bearing kojic acid moieties[J].Polym Sci A,1996,34:271-276.
[10]王丽.微生物诱变[J].河北化工,2009,32(7):30-31.
[11]杨苏声,周俊初.微生物生物学[M].北京:科学出版社,2004:254.
[12]李兴江,魏兆军,姜绍通,等.高产琥珀酸产生菌的诱变选育[J].核农学报,2009,23(2):224-227.
[13]张理珉,程立忠,陆和生.三氯化铁比色法测定曲酸含量方法的改进[J].生物技术,2000,10(3):47-48.
Study on60Co-γ irradiation mutation breeding of kojic acid production strain and its characterization
XIE Xi-yu,ZENG Bai-quan*,ZHOU Xiao-qin,XU Zhi,SONG Rui
(College of Life Science,Central South University of Forestry and Technology,Changsha 410004,China)
Asperqillus oryzae were irradiated by different doses of60Co-γ rays to obtain high-yielding strains of kojic acid.The results indicated that,when the dose of the60Co-γ rays was 800Gy,it could have the best mutation effect to the start strain.The kojic acid yield of the mutant increased from original 15.68g/L to 61.5g/L,increased by 292.2%.lt had a good genetic stability and stably acid producing.To obtain the characteristics changes of the C8-128 which has a high yielding of kojic acid,it was compared to the starting strain in colony morphology and fermentation characteristics in flask.
60Co-γ ray;kojic acid;Asperqillus oryzae;mutation;characterization
TS201.3
A
1002-0306(2010)12-0212-03
2009-11-23 *通讯联系人
解西玉(1986-),女,在读硕士,从事微生物发酵方面的研究。

