海藻和海藻酸钠中糖醛酸含量的测定
张文婧,李静梅,吴 颖,梁 平,石 波,*
(1.中国农业科学院饲料研究所,北京100081;2.中国农业科学院作物科学研究所,北京100081;3.北京市产品质量监督检验所,北京100026)
海藻和海藻酸钠中糖醛酸含量的测定
张文婧1,李静梅2,吴 颖3,梁 平1,石 波1,*
(1.中国农业科学院饲料研究所,北京100081;2.中国农业科学院作物科学研究所,北京100081;3.北京市产品质量监督检验所,北京100026)
利用阴离子交换树脂对酸水解后的海藻酸钠进行分离,得到D-甘露糖醛酸(M)和L-古洛糖醛酸(G),经过高效液相色谱、电喷质谱及核磁共振确定其纯度和结构。利用自制的M和G作为标准品绘制标准曲线,用外标法计算得到海藻酸钠样品中M含量为63.06%,G含量为11.48%;海藻样品中M含量为21.65%,G含量为4.67%。该实验为海藻胶及海藻寡糖中的D-甘露糖醛酸和L-古洛糖醛酸含量的测定奠定了一定的基础。
D-甘露糖醛酸,L-古洛糖醛酸,高效液相色谱,检测
海藻中的海藻酸是由D-甘露糖醛酸(D-Mannuronic Acid,简称 M)和 L-古洛糖醛酸(L-Guluronic Acid,简称G)组成的一种酸性多糖。其因主链上连接的M和G位置的不同而决定了其结构的不同,理化性质随着M/G比例而改变,相应的M/G比例也决定了在食品、医药和纺织等方面的不同用途。Patrick等曾对已摄入Sr-85的动物饲喂M/G具有不同比值的海藻酸钠进行研究,结果发现当海藻酸钠中G的含量增高时能有效地抑制Sr-85在动物体内的吸收[1]。目前在工业上使用的是海藻酸的钠盐即海藻酸钠。因此,快速、准确地测定出海藻和海藻酸钠中M和G的含量具有极其重要的价值,其结构见图1。由于高纯度的M和G单一组分规模化制备具有一定的难度,因此目前通常采用核磁共振(NMR)的方法测定海藻和海藻酸钠中M和G的含量[2-3],该方法需要核磁共振仪器和专业仪器操作人员,这极大地制约了对于褐藻和海藻酸以及钠盐的研究和应用。本研究首先以海藻酸钠为原料,制备出高纯度的D-甘露糖醛酸和L-古洛糖醛酸单一组分,然后选择高效液相色谱(High Performance Liquid Chromatography,简称HPLC)的方法,将所得到的M和G作为标准品,测定海藻和海藻酸钠中两种糖醛酸M和G的比值和含量,以实现海藻及海藻酸钠中M和G含量的快速、准确测定。
1 材料与方法
1.1 材料与仪器
海藻 山东蓉城2007年产,粉碎机粉碎;海藻酸钠、无水碳酸钙、氢氧化钠 国药集团化学试剂公司,分析纯;硫酸、盐酸、冰醋酸 北京化工厂,分析纯;1×8阴离子交换树脂 美国Dowex,200目;重蒸水,蒸馏水。

图1 D-甘露糖醛酸结构和L-古洛糖醛酸结构
Waters 2695高效液相色谱仪 附配有 Waters 2414示差检测器,美国Waters公司;AR 2140分析天平 感量:0.0001g,美国奥豪斯公司;FD-1D真空冷冻干燥机 北京博医康实验仪器有限公司;RE-3000旋转蒸发仪 上海亚荣生化仪器厂;RVC 2-18旋转真空离心浓缩仪 德国Christ;BSZ-30自动部分收集器 上海沪西分析仪器厂;IKA加热磁力搅拌器德国IKA;APEXII型FT-ICR质谱仪 美国Bruker Daltonic;Bruker ARX-400核磁共振仪 瑞士Bruker;常压玻璃层析柱 Φ45×450mm,中国科学院过程研究所;Silica Gel F254硅胶板 MERCK;烘箱 350± 1℃,上海精宏实验设备有限公司;FW100高速万能粉碎机 24000r/min,天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 色谱条件 色谱柱:ZORBAX SAX 4.6× 250mm 5-Micron Agilent;柱温:40℃;流动相:0.7mol/L乙酸;流速:1.0mL/min;测定波长:示差检测;示差检测器温度:40℃;进样量:10μL[4]。
1.2.2 D-甘露糖醛酸和L-古洛糖醛酸的制备 称取海藻酸钠5g,加入76%的硫酸50mL,常温下搅拌反应2.5h,再加入650mL蒸馏水,沸水浴中水解3h,冷却后加稍过量的无水CaCO3中和,抽滤,并用蒸馏水洗涤滤渣两次,合并滤液,40℃下真空浓缩至体积为5mL,用0.1mol/L NaOH调pH为8.0,并保持0.5h不变。
取上述海藻酸钠水解液上已转为CH3COO-型的Dowex1×8阴离子交换树脂柱,用0.5~2mol/L的乙酸溶液以2mL/min的速度进行梯度洗脱,用自动部分收集器收集,每瓶收集150mL,共收集60瓶。
在每个收集瓶中取20μL液体,按顺序点于硅胶板上,晾干后喷5%硫酸乙醇显色剂,并于110℃烘箱中烘5min。
按照薄层层析检测结果,将相同组分的收集液合并,45℃真空浓缩后冷冻干燥,用HPLC分析其纯度。并对其进行ESI-MS和1H NMR以及13C NMR测定,确定两组分的化学结构。
1.2.3 标准曲线的绘制 称取制得G标准品,用重蒸水溶解,配制成浓度为 1.07、2.14、3.21、5.35、10.7mg/mL的标准溶液。称取制得的M标准品,用重蒸水溶解,配制成浓度为1.2、6.0、12、24、30mg/mL的标准溶液。分别进样10μL进行HPLC测定,以峰面积为纵坐标,相应标准溶液的浓度为横坐标,绘制标准曲线和进行线性回归。
1.2.4 样品处理及检测 准确称取300mg(精确至± 0.0001g)海藻酸钠,加入72%硫酸溶液3.5mL,于研钵中研磨2h,用100mL蒸馏水将其转移至250mL三角瓶中,100℃沸水浴加热2.5h,于自来水中冷却至室温,加入过量BaCO3粉末,充分反应至溶液pH为7左右,3000r/min离心,沉淀用150mL蒸馏水洗涤3次,将上清液和洗涤液合并在一起,45℃真空旋转浓缩后,定容至10mL,进样10μL进行HPLC测定。海藻样品的处理方法同上,浓缩后定容至5mL,进样10μL进行HPLC测定。依据样品测定的峰面积和出峰时间,在相应的标准曲线查出所测组分的量,结合所取样品的质量和定容体积,计算出各组分的含量。
2 结果与讨论
2.1 D-甘露糖醛酸和L-古洛糖醛酸单一组分的分离纯化
硫酸水解海藻酸钠所得产物见图2。由图2可知,海藻酸钠酸水解产物含有2个主要组分A和B,保留时间分别为6.993min和7.934min。

图2 海藻酸钠酸水解产物的HPLC谱图
将海藻酸钠酸水解产物经Dowex1×8阴离子交换树脂层析柱分离,所得每个收集瓶中收集液薄层层析显色,结果(图3)表明,含有糖的洗脱液均有斑点显示,并可以看出共有3组斑点,其中第一组为中性糖[5],第二组为组分A,第三组为组分B。

图3 阴离子交换树脂层析柱分离所得收集液的TLC结果
图4和图5分别为冷冻干燥得到的组分A和组分B的HPLC检测谱图。组分A的保留时间为7.008min,组分B的保留时间为10.557min。

图4 组分A的HPLC谱图
通过与图2中保留时间的比较得知,组分A和B这两种物质在Dowex1×8阴离子交换树脂为分离介质、乙酸水溶液为洗脱液的层析柱中得到了有效地分离,且HPLC的分析纯度(以峰面积百分比计)均达到99%以上。
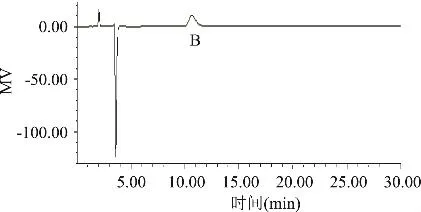
图5 组分B的HPLC谱图
2.2 L-古洛糖醛酸和D-甘露糖醛酸化学结构鉴定
将柱层析分离后所得的组分峰A和B分别收集,冷冻干燥后进行MS和1H NMR以及13C NMR检测,确定其化学结构。
组分峰A:1H-NMR(400MHz,D2O):α体,δ= 4.96(1H,d,J=8.4Hz,H-1),3.99(1H,d,J=3.6Hz,H-2),4.01(1H,d,J=3.6Hz,H-3),4.10(1H,s,H-4),4.58(1H,s,H-5);β体,δ=5.30(1H,d,J= 3.6HzH-1),3.70(1H,dd,J=8.4Hz,H-2),4.17(1H,d,J=4Hz,H-3),4.15(1H,d,J=3.6Hz,H-4),4.27(1H,s,H-5)。13C-NMR,(100MHz,D2O):α体,δ=92.98(C-1),66.91(C-2),70.89(C-3),70.65(C-4),73.56(C-5),175.06(C-6);β体,δ=93.65(C-1),68.60(C-2),71.10(C-3),70.76(C-4),73.56(C-5),174.08(C-6)。
ESIMS m/z 193[M]+(100),C6H10O7。根据以上实验数据,确定组分峰A为L-古洛糖醛酸。
组分峰B:1H NMR,(400MHz,D2O):α体,δ=5. 28(1H,d,J=2Hz,H-1),3.95(1H,d,J=4.4Hz,H-2),3.93(1H,d,J=1.6Hz,H-3),3.82(1H,s,H-4),4.26(1H,dd,J=5.4Hz,H-5);β体,δ=4.98(1H,s,H-1),3.99(1H,d,J=3.2Hz,H-2),3.80(1H,s,H-3),3.73(1H,d,J=2Hz,H-4),3.67(1H,s,H-5)。13C-NMR,(100MHz,D2O):α体,δ=93.85(C-1),68.28(C-2),70.27(C-3),70.07(C-4),72.42(C-5),175.05(C-6);β体,δ=93.99(C-1),68.73(C-2),71.02(C-3),69.61(C-4),72.81(C-5),174.56(C-6)。
ESIMS m/z 193[M]+(100),C6H10O7。根据以上实验数据,确定组分峰B为D-甘露糖醛酸。
2.3 海藻酸钠中L-古洛糖醛酸和D-甘露糖醛酸含量的测定结果
根据图6,以L-古洛糖醛酸峰面积(Y)对应质量浓度(X,mg/mL)作回归分析,得到回归方程为y= 40396x-20326,R2=0.997。
根据图7,以D-甘露糖醛酸峰面积(Y)对应质量浓度(X,mg/mL)作回归分析,得到回归方程为:y=24689x-3244,R2=0.999。
由图6和图7的结果可以得出,在1.07~10.7mg/mL范围内,L-古洛糖醛酸具有良好的线性关系;在1.2~30mg/mL范围内,D-甘露糖醛酸具有良好的线性关系。
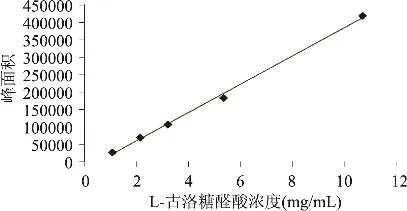
图6 L-古洛糖醛酸标准曲线

图7 D-甘露糖醛酸标准曲线
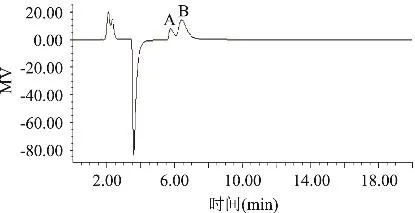
图8 海藻酸钠完全水解产物的HPLC谱图
图8为海藻酸钠完全水解产物的HPLC谱图。按照外标法计算样品中D-甘露糖醛酸和L-古洛糖醛酸的含量分别为63.06%和11.48%,M/G=5.493。用HPLC检测获得的峰面积比值代表样品中M和G的含量比,海藻酸钠中的M/G=3.20,误差较大。选择D-甘露糖醛酸和L-古洛糖醛酸标准品,建立相应的标准曲线才能准确地测定出海藻酸钠样品中两种糖醛酸的含量。
2.4 海藻中G和M含量测定结果
图9为海藻中褐藻完全水解产物的HPLC谱图,按照外标法计算褐藻样品中D-甘露糖醛酸和L-古洛糖醛酸的含量分别为21.65%和4.67%,M/G= 4.636。而用HPLC检测获得的峰面积比值代表样品中M和G的含量比,则褐藻中的M/G=2.819,与实际比值存在较大的误差。
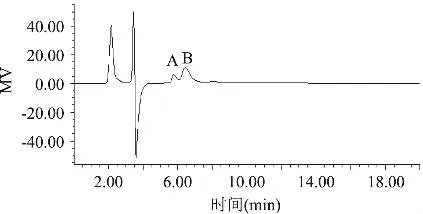
图9 褐藻完全水解产物的HPLC谱图
3 结论
选择Dowex1×8强碱型阴离子交换树脂为制备型常压柱层析的分离介质,乙酸水溶液为洗脱液,进行梯度洗脱,可以成功地从海藻酸钠硫酸水解液中分离纯化出L-古洛糖醛酸和D-甘露糖醛酸,两组分纯度分别达到99%以上。一次性上样由5g海藻酸钠制得的硫酸水解液,可获得的L-古洛糖醛酸纯品0.5839g,D-甘露糖醛酸纯品1.7614g。采用本实验制备的L-古洛糖醛酸和D-甘露糖醛酸作为标准品,HPLC检测,海藻酸钠和褐藻中的L-古洛糖醛酸及D-甘露糖醛酸的含量分别为11.48%和63.06%以及4.67%和21.65%。本实验为测定褐藻和海藻酸钠中L-古洛糖醛酸和D-甘露糖醛酸的含量提供了一个方便、准确的方法。
[1]Patrick G,Carr T E F,Humphreys E R.Inhibition by Alginates of Strontium Absorption Studied in Vivo and in Vitro[J].International Journal of Radiation Biology,1967,12:427-434.
[2]Keiichiro M,Hironori M,Hajime K,et al.Decomposition Reaction of Alginic Acid Using Subcritical and Supercritical Water[J].Eng Chem Res,2005,44(25):9626-9630.
[3]Riki Shiroma,Shuntoku Uechi,Shinkichi Tawata.Isolation and Characterization of Alginate from Hizikia fusiformis and Preparation of its Oligosaccharides[J].Journal of Applied Glycoscience,2007,54(2):85-90.
[4]Voragen A G J,Schols H A,Devries J A,et al.Highperformance liquid chromatography analysis of uronic acid and oligogalacturonic acids[J].Journal of Chromatography,1982,244,327-336.
[5]Haug A,Larsen B.Quantitative Determination of the Uronic Acid Composition of Alginates[J].Acta Chemica Scandinavica,1962,16,1908-1918.
Quantitative determination of uronic acid in seaweeds and sodium alginate
ZHANG Wen-jing1,LI Jing-mei2,WU Ying3,LIANG Ping1,SHI Bo1,*
(1.Feed Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081,China;2.Institute of Crop Science,Chinese Academy of Agricultural Sciences,Beijing 100081,China;3.Beijing Products Quality Supervision and Inspection Institute,Beijing 100026,China)
The column chromatography with anion-exchange resin was used for isolating mannuronic acid(M)and guluronic acid(G)from hydrolyzed alginate sodium,the collected components were analyzed by high performance liquid chromatography(HPLC),ESl-MS and NMR.M and G was used as a standard,external reference method was used for assay of M and G in brown algae and alginate sodium.The concentration of M in brown algae was 21.65%and G was 4.67%,also alginate sodium has 63.06%M and 11.48%G.The experiment built a new method for quantitating D-mannuronic acid and L-guluronic acid in sodium alginate and seaweed oligosaccharides.
D-mannuronic acid;L-guluronic acid;high performance liquid chromatography;detection
TS254.1
A
1002-0306(2010)12-0338-04
2010-04-08 *通讯联系人
张文婧(1984-),女,硕士研究生,主要从事天然产物与糖工程在饲料添加剂方面的研究。
“十一五”国家海洋“863”课题(2007AA091601-2)。

