离子强度和PH对大麦中热稳定蛋白稳定性的影响
陈 霞,姜晓雷,李明达,韩 丹,莫新迎,石维忱,赵长新,*
(1.大连工业大学生物与食品工程学院,辽宁大连116034;2.中国发酵工业协会,北京100833)
离子强度和PH对大麦中热稳定蛋白稳定性的影响
陈 霞1,姜晓雷1,李明达1,韩 丹1,莫新迎1,石维忱2,赵长新1,*
(1.大连工业大学生物与食品工程学院,辽宁大连116034;2.中国发酵工业协会,北京100833)
大麦中的热稳定蛋白对啤酒的非生物稳定性以及啤酒的冷浑浊都有着重要的影响。本实验利用考马斯亮蓝法(Bradford法)和SDS-PAGE电泳技术对pH和离子强度改变后的大麦中的热稳定蛋白的稳定性进行了研究,结果发现,pH及离子强度对热稳定蛋白的稳定性均有较大的影响,碱性环境比酸性环境对蛋白质的稳定性影响大;离子强度与热稳定蛋白稳定性之间成负相关;随着离子价态的升高,蛋白质稳定性随着降低。本研究为热稳定蛋白特性的研究提供可靠的参数,同时为啤酒生产有针对性的改进提供参考。
大麦,热稳定蛋白,离子强度
泡沫的丰富和细腻是啤酒最直接的感官评价,促进啤酒泡沫生成和维持泡沫持久的物质是大麦中的热稳定蛋白[1],这部分蛋白质经过发芽、糖化以及煮沸发酵等过程后仍然得以保存[2-3],它还能够决定啤酒的口感风味及胶体的稳定性,是决定麦芽和啤酒品质的重要因素[3-5]。大麦是啤酒生产的主要原料,使用相同品种的大麦在不同工艺条件下酿造的啤酒,泡沫特性存在很大差异,在制麦和啤酒生产过程中,pH、温度、外源添加物等一部分因素对大麦热稳定蛋白的空间结构、分子内氢键和疏水性都产生了影响,从而使热稳定蛋白结构发生了相应的改变,同时物质的化学性质也发生了巨大变化,导致其稳定性下降,含量及组成均出现减少[6]。以往国内外科研机构和相关研究部门都是对大麦、麦芽和啤酒中的热稳定蛋白含量及生化特性进行研究,基本上没有对热稳定蛋白的稳定特性进行分析[7],而事实上无论在制麦还是啤酒酿造过程中,其环境因素对大麦中热稳定蛋白的稳定性都存在一定的影响,使热稳定蛋白变性失活,导致其含量下降,从而影响啤酒的品质。本文通过改变pH和盐溶液浓度对大麦中热稳定蛋白稳定性进行研究,对大麦热稳定蛋白特性和啤酒品质的关系做了较全面系统的分析,为啤酒生产中提高啤酒泡沫稳定性起到一定的指导作用。
1 材料与方法
1.1 材料与仪器
大麦 Baudin(澳大利亚产),由中粮麦芽(大连)有限公司惠赠;SDS-PAGE低分子量蛋白质标准Takala公司;考马斯亮蓝G250/R250、牛血清白蛋白、丙烯酰胺、甘氨酸 Amresco;DTT Merk;EDTA ·Na2Sigma;其余试剂 均为分析纯。
ZPS-250H智能恒温恒湿培养箱 黑龙江东拓仪器制造有限公司;Unic-7200分光光度计 上海尤尼柯仪器有限公司;JM-250型小型电泳仪 大连捷迈科贸有限公司;GTL-16A离心机 上海浦东物理光学仪器厂;pH计 Mettler-Toledo Delta320;可调万用电炉 山东省龙口市先科仪器公司。
1.2 实验方法
1.2.1 蛋白质的提取 大麦用干磨机磨碎3min,准确称取磨碎的大麦(扣除水分后的绝干重量),按料液比1∶2.5(g/mL)分别加入4℃提取缓冲液[8](Tris-Cl 50mmol·L-1,NaCl 10mmol·L-1,DTT 1mmol·L-1,EDTA·Na21mmol·L-1,pH7.5),摇匀,置4℃提取1h,其间每10min摇振一次。4000r/min离心10min,收集上清液。再次向沉淀中按料液比1∶2.5(g/mL)加入4℃提取缓冲液,摇匀,置4℃提取1h,4000r/min离心10min,合并两次浸提的上清液,得蛋白粗提液。将此粗提液于100℃水浴20min,之后4000r/min离心10min,弃去沉淀,所得上清液为热稳定蛋白提取液。
1.2.2 蛋白质含量测定 采用Bradford法,使用牛血清白蛋白作为标准蛋白[9]。
在试管中分别加入牛血清蛋白浓度为0、0.2、0.3、0.4、0.5、0.6、0.7、0.8mg/mL的蛋白溶液(以下步骤做两组平行实验),从以上蛋白溶液中分别取0.1mL置于8个试管中,再分别加入5mL考马斯亮蓝工作液,摇匀后静置5min后,在595nm处测其吸光值。计算两组平行实验测得的吸光值的平均值作图1。
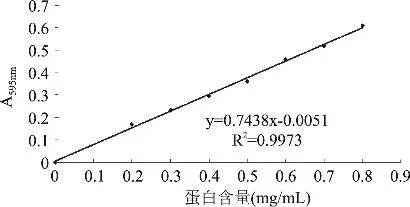
图1 Bradford法测蛋白含量的标准曲线
1.2.3 离子强度和pH对热稳定蛋白的影响实验将1.2.1收集到的热稳定蛋白提取液,按照每份5mL分成20等份装入试管中。
1.2.3.1 离子强度对热稳定蛋白的影响实验 取12支装有热稳定蛋白的试管,向试管中添加NaCl和CaCl2,使试管中两种金属盐浓度分别为1%、3%、5%、7%、9%、11%。将溶液摇匀静置 20min后,4000r/min离心15min,收集清液,按照1.2.2方法确定的方程计算蛋白浓度并测量体积,其余上清液留样待用。
1.2.3.2 pH对热稳定蛋白的影响实验 取9支装有热稳定蛋白的试管,用HCl及NaOH将溶液调成pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0及用pH计测量提取液中pH。将调好pH的溶液摇匀,静置20min后,4000r/min离心15min,收集清液,按照1.2.2方法确定的方程计算蛋白浓度并测量体积,其余上清液留样待用。
1.2.4 SDS-PAGE 使用 LaemmLi不连续系统在4℃进行电泳,12%分离胶(80×80×1mm),5%浓缩胶(80×8×1mm)。凝胶使用考马斯亮蓝R250染色,脱色后经凝胶成像系统拍照。
2 结果与分析
2.1 不同环境下热稳定蛋白含量的变化
2.1.1 不同pH条件下热稳定蛋白含量及其变化趋势 如图2所示,原蛋白提取液pH7.0时蛋白质含量最高(为3.27mg),随着pH条件的改变,蛋白质含量的变化显著。当pH为3.0~7.0时,其蛋白质含量与pH呈正相关,而当pH为7.0~9.0时,蛋白质含量与pH呈负相关。从图中可以看出,pH对热稳定蛋白的影响很大,由于每一种蛋白质都有最适合的pH沉淀点,在这个范围内,蛋白质的静电力最小,蛋白质彼此间交联引力大于分子间的斥力,从而使得保留下来的蛋白质含量变少。

图2 大麦热稳定蛋白含量随pH改变的变化
2.1.2 不同盐溶液浓度条件下热稳定蛋白含量及其变化趋势 如图3所示,盐溶液浓度对大麦中热稳定蛋白含量的影响较大,蛋白质含量的变化与盐溶液浓度呈负相关,即大麦中热稳定蛋白的含量随离子强度的增加反而减少。产生这种现象的原因有可能是盐溶液浓度升高,溶液中离子强度增加,极性增强,使溶液中蛋白质的疏水链彼此间作用力减弱,蛋白质逐渐自聚形成疏水链朝内的结构,从而蛋白质发生“盐析”现象,含量下降。对比图中两种盐溶液对热稳定蛋白的影响,可以发现其钙盐的影响较大,钙离子影响蛋白质的减少量是钠离子影响的1.5~2.0倍左右,当离子强度影响蛋白质结构时,通常的情况下,无机盐都会促进反应向混浊沉淀的方向发展,主要是通过离子强度对蛋白质的疏水作用而促进混浊反应的进行,从而说明其离子价态对蛋白质变性存在一定关系。

图3 大麦热稳定蛋白含量随盐溶液浓度变化的改变
由以上两种环境下热稳定蛋白含量均发生减少的现象推测,热稳定蛋白中某些蛋白质在环境改变时发生了变性,导致热稳定蛋白总含量下降。
2.2 不同pH和盐溶液浓度环境下大麦热稳定蛋白SDS-PAGE图谱分析
热稳定蛋白的稳定性与维持热稳定蛋白的三维空间结构的分子间和分子内的氢键有着密切的联系,同时还与其本身具有较强疏水性有关。当pH及离子强度改变时,蛋白质表面的疏水结构受到影响,空间结构发生相应的改变,同时热稳定蛋白的物理化学特性发生巨大改变,热稳定蛋白变性,稳定性也发生变化。
从图4可以看出,随着pH的改变,大麦中的热稳定蛋白条带的颜色也发生了相应地变化。pH7.0与pH6.7条带最为接近,由pH7.0向两端泳道上的蛋白质条带发生了减少缺失的现象,当pH4.0和pH8.0时,蛋白质稳定性受到的影响最大,蛋白质条带颜色变淡甚至消失,至pH3.0和pH9.0时条带基本全部消失,由此说明pH环境的改变使蛋白质发生了变性沉淀,从而消失。

图4 不同pH条件下热稳定蛋白SDS-PAGE图谱分析

图5 不同钠盐浓度环境下热稳定蛋白SDS-PAGE图谱分析
如图5、图6所示,随着盐溶液浓度的升高,蛋白质条带颜色逐渐变淡且逐渐减少。在钠盐的单一溶液体系,溶液浓度升高,分子量90、44.3kDa左右的蛋白质消失最快,当盐溶液浓度为3%时条带消失最多,9%后蛋白条带基本消失,说明这部分蛋白质受离子强度影响最大。在钙盐的单一溶液体系中,除分子量27kDa和23kDa左右的蛋白条带外,其他条带消失地都很快,与钠盐中受离子强度影响大的蛋白质是相同的,溶液浓度3%时蛋白质条带开始大量减少,7%以后条带基本消失,即蛋白质基本变性失活。综合热稳定蛋白受两种离子强度影响的SDS-PAGE谱图及其含量变化图可知,钙盐溶液对热稳定蛋白的影响较大,其蛋白质含量减少速度高于钠盐,蛋白质条带的消失也要比钠盐早。以上说明盐溶液中离子的价态对蛋白质影响较大,在离子强度和溶解度降低的双重作用下蛋白质之间的交联作用力减弱,斥力增加而解体成单个分子,其结构发生改变从而被“盐析”出来。因此,离子强度越大,发生变性的速度越快。
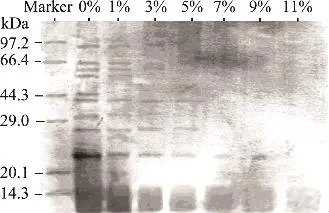
图6 不同钙盐浓度环境下热稳定蛋白SDS-PAGE图谱分析
3 结论
通过考察不同的pH环境及金属离子对大麦中热稳定蛋白的影响,发现pH及离子强度的改变均对热稳定蛋白的稳定性影响较大。其中热稳定蛋白的稳定性随环境的酸性和碱性增强而减弱,碱性环境对蛋白的稳定性影响较大。离子强度对热稳定蛋白稳定性影响一方面随着外部盐溶液浓度的增大,热稳定蛋白的稳定性下降,从SDS-PAGE图谱分析可知,蛋白质种类也逐渐减少甚至消失,尤其当盐溶液浓度为3%时,热稳定蛋白质含量及蛋白组成减少最为明显;另一方面随着离子价态的升高,蛋白质稳定性也随着降低,SDS-PAGE图谱证明蛋白质稳定性与离子价态存在联系。由此pH与盐离子强度影响蛋白质的存在状态,影响蛋白质间的相互作用,进而影响其稳定性。
大麦中的热稳定蛋白涉及啤酒的非生物稳定性以及啤酒的冷浑浊[10],对啤酒的品质和风味影响很大,本文通过改变pH及离子强度分析了大麦热稳定蛋白的稳定性,为啤酒生产有针对性的改进提供参考。
[1]郝俊光,陈坚,李崎,等.啤酒和啤酒泡沫中蛋白质组成的差异性比较[J].酿酒科技,2006(4):38-46.
[2]HEJGAARD J,KAERSGAARD P.Purification and properties of major antigenic beer protein of barley origin[J].Journal of the Institute of Brewing,1983,89(6):402-410.
[3]EVANS D E,ROBINSON L H,SHEEHAN M C,et al. Application of immunological methods to differentiate between foam-positive and haze-active proteins originating from malt[J]. Journal of the American Society of Brewing Chemists,2003,61:55-62.
[4]KAPP G R,BAMFORTH C W.The foaming properties of proteins isolated from barley[J].Journal of the Science of Food and Agriculture,2002,82:1276-1281.
[5]EVANS D E,SHEEHAN M C.Do not be fobbed off:The substance of beer foam-a review[J].Journal of American Society of Brewing Chemistry,2002,60:47-57.
[6]丁燕,杜金华.影响啤酒外观稳定性的因素及其控制[J].食品科学,2002,23(2):160-164.
[7]LUDIBINE ROCHEAU,HELENE ROGNIAUX,et al.Probing heat-stable water-soluble proteins from barley to malt and beer[J].Proteomics,2005,5:2849-2858.
[8]孙俊,张天雪,孙丽华,等.大麦发芽过程中热稳定蛋白质的变化及部分生化特性[J].大连工业大学学报,2008,27(3):223-227.
[9]BRADFORD M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[10]EVANS D E,ROBINSON L H,SHEEHAN M C,et al. Application of immunological methods to differentiate between foam-positive and haze-active proteins originating from malt[J]. J Am Soc Brew Chem,2003,61:55-62.
Effect of ionic strength and pH on stability of heat-stable protein in the barley
CHEN Xia1,JIANG Xiao-lei1,LI Ming-da1,HAN Dan3,MO Xin-ying1,SHI Wei-chen2,ZHAO Chang-xin1,*
(1.School of Bio&Food Technology,Dalian Polytechnic University,Dalian 116034,China;2.Fermentation industry Association of China,Beijing 100833,China)
Heat-stable protein in the barley takes an important role in the non-biological stability and turbidity in the beer.The Bradford method and SDS-PAGE were used to study the stability of heat-stable protein in the barley after changing pH and ionic strength.The results showed that both pH and ionic strength took an important role in the stability of heat-stable protein,the influence of alkaline environment was far bigger than acid environment,ionic strength was inversely correlated with the stability of heat-stable protein.With the ionic valent states increasing,stability of heat-stable protein reduced.The study provided reliable parameters for the study on characteristics of heat-stable protein,and provided references for pertinently improvement in beer production.
barley;heat-stable protein;ionic strength
TS210.1
A
1002-0306(2010)12-0087-04
2009-12-15 *通讯联系人
陈霞(1983-),女,硕士研究生,研究方向:酿造大麦中热稳定蛋白。
国家“十一五”国家科技支撑计划重点项目(2007BAK36B01);辽宁省教育厅发酵工程重点实验室开放课题项目(2004LN-FJ-004)。

