纳米糊精微球对头孢曲松钠的吸附及其释药性能
张 素 敏, 贾 治 勇, 孙 庆 元
( 1.大连工业大学 生物与食品工程学院, 辽宁 大连 116034;2.山西农业大学 食品科学与工程学院, 山西 太谷 030801 )
0 引 言
微球作为一种新型的药物载体,在医药学方面被广泛地应用和研究。纳米级的微球更是由于其粒子小,可以更好地实现靶向输送、局部给药[1],这使得纳米粒子在药物和基因输送方面具有许多优越性[2]。聚合物作为载体与药物利用纳米科技制成纳米药物,作为靶向药物制剂,可以大大地提高药物的生物利用度[3-4]。迄今为止,很多用于药物输送的纳米载体材料是纳米高分子聚合物[5],但这类材料存在的毒性等问题对其发展造成了阻碍。近年来,有良好生物相容性、可生物降解的多糖材料逐渐得到研究者的青睐,已有很多研究是采用淀粉[6-7]和β-环糊精[8-9]制作微球用作药物载体。糊精是一种分子质量较小的天然物质,且糊精分子的糖链较淀粉要短,易于与交联剂反应。因此,本文采用糊精为原料,用反相微乳液法制得纳米糊精微球,并在模拟人体血液环境中对其吸附载药以及释药性能进行了研究。正常人体血浆的pH是7.4[10],所以选择较稳定的pH 7.4的磷酸氢二钠-磷酸二氢钠作为介质。人体血液中淀粉酶量的正常值为40~220 U/L,本研究所加的α-淀粉酶量在相应的介质中的活度为185 U/L。
1 材料和方法
1.1 材 料
糊精、Span60、Tween60,化学纯;正己烷、正戊醇、无水乙醇、磷酸氢二纳、磷酸二氢钠,分析纯;三偏磷酸钠,食品级;注射用头孢曲松钠(C18H18N8O7S3·3.5H2O摩尔质量:661.59 g/mol);α-淀粉酶(3 700 U/g)。
1.2 方 法
1.2.1 纳米糊精微球的制备
以糊精为原材料,选用正己烷为油相,Span60和Tween60为表面活性剂,正戊醇为助表面活性剂,三偏磷酸钠为交联剂,用反相微乳液法制得了纳米糊精微球;并通过正交试验优化制备工艺,优化后制得微球经激光粒度仪测定平均粒径为178.5 nm[11],并用优化条件后制得的微球来进行吸附载药性及释药性试验。
1.2.2 纳米糊精微球的吸附载药性能
1.2.2.1 头孢曲松钠标准曲线的绘制
用pH 7.4的磷酸二氢钠-磷酸氢二钠缓冲液配置头孢曲松钠溶液,质量浓度为0.01 mg/mL,同法配制空白微球的混悬液,用752紫外可见分光光度计进行紫外全波长扫描。最后选择240 nm作为头孢曲松钠以pH 7.4的磷酸二氢钠-磷酸氢二钠缓冲液为介质的测定波长。
用pH 7.4的磷酸二氢钠-磷酸氢二钠缓冲液配置头孢曲松钠溶液,质量浓度为0.1 mg/mL。 分别量取1、2、3、4、5、6 mL标准液于50 mL容量瓶中,用磷酸缓冲液定容及作为参比液。用紫外可见分光光度计在240 nm处测定其吸光度,绘制标准曲线,得到线性方程:
y=0.134 3+53.914 3x,R=0.999 4
1.2.2.2 微球载药量与包封率的测定
将空白微球100 mg,加入到一定浓度的头孢曲松钠-磷酸缓冲液中,在磁力搅拌器上搅拌10 min后静置至1 h,使其吸附,离心。取上清液在240 nm处用磷酸缓冲液作参比液测其吸光度,得到游离的头孢曲松钠的量。微球的载药率和药物的包封率的计算公式为


1.2.2.3 吸附平衡时间的考察
分别用磷酸缓冲液配制头孢曲松钠溶液20 mL,质量浓度为1 mg/mL,各加入空白微球0.1 g,在25 ℃下分别磁力搅拌10 min后静置至0.5、1.0、1.5 h,离心,取上清液测吸光值,计算载药率和包封率。
1.2.2.4 投药量对载药的影响
分别用磷酸缓冲液配制头孢曲松钠溶液20 mL,质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL。各加入空白微球0.1 g,在25 ℃下磁力搅拌10 min后静置至1 h,离心后取上清液测吸光值,计算载药率和包封率。
1.2.2.5 温度对载药的影响
分别用磷酸缓冲液配制头孢曲松钠溶液20 mL,质量浓度为1 mg/mL,各加入空白微球0.1 g,分别在25、37、50 ℃下磁力搅拌10 min后静置1 h,离心取上清液测吸光值,计算载药率和包封率。
1.2.3 载药微球的释药性能
用磷酸缓冲液配制头孢曲松钠溶液160 mL,质量浓度为1 mg/mL,加入空白微球0.8 g,在25 ℃下磁力搅拌10 min至1.5 h后,取10 mL混合液,离心后测吸光值,计算此时的游离药量和载药量。然后在剩下的150 mL混合液中加入α-淀粉酶7.5 mg,在37 ℃下反应(不断摇晃)每隔一定的时间,取适量的混合液离心,测吸光值,计算游离药量和释放度。
释放度=(A1-A0)/B
式中,A0为未加酶时的游离药量,mg;A1为加入淀粉酶降解后的游离药量,mg;B为未加酶时微球的载药量,mg。
2 结果与分析
2.1 纳米糊精微球吸附载药量与吸附时间的关系
由表1可知,糊精微球对头孢曲松钠的吸附载药量在1.0 h之前,随着吸附时间的延长,纳米糊精微球的载药率会上升,但在吸附1.0 h时的载药率和在吸附1.5 h的载药率是一样的,说明整个吸附过程在1.0 h时已经达到了吸附平衡,糊精微球已经最大限度地发挥了吸附能力。
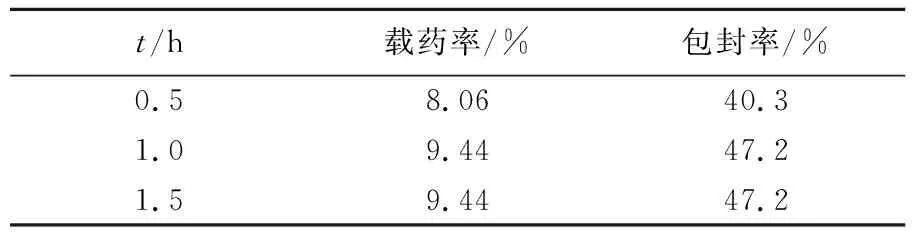
表1 纳米糊精微球载药率与吸附时间的关系Tab.1 Effect of time on adsorption with drug of DNM
2.2 投药量与纳米糊精微球吸附载药量的关系
由图1可知,随着投药量的增加,微球的载药率是逐渐增大的,包封率是逐渐减小的。由于微球表面的孔隙结构,药物是通过细孔进入微球内部的,所以对于吸附载药存在一个饱和点,当吸附达到平衡时,增加投药量,也只能留在介质中而不能被微球吸附,虽然投药量增加,载药量也会增加,但是此时药物和微球的结合并不牢固,很容易被洗脱,所以用吸附法载药时要综合考虑投药量。
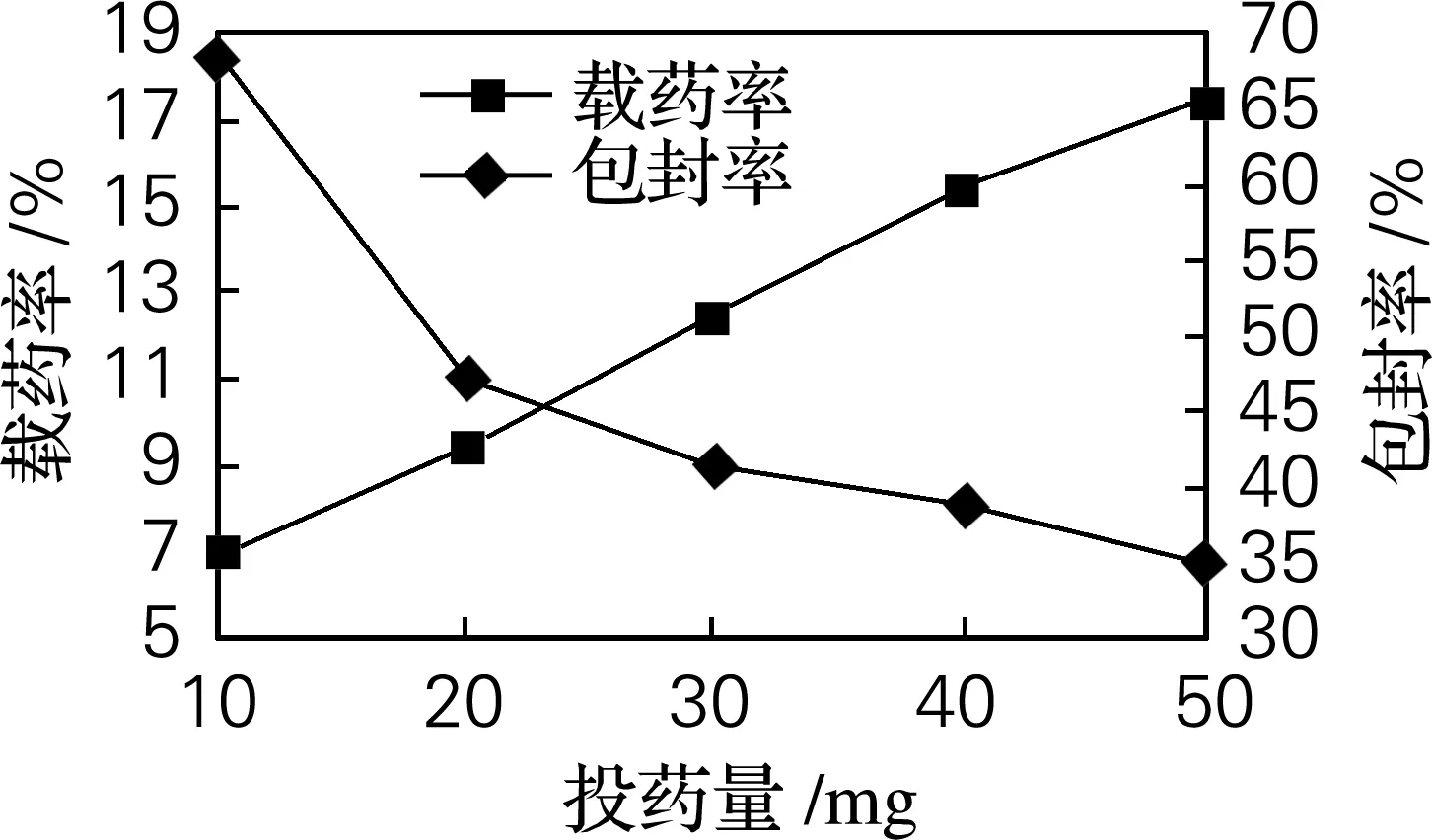
图1 投药量与载药率和包封率的关系Fig.1 The relationships of the dosage with the drug-loading rate and the entrapment rate
2.3 纳米糊精微球吸附载药量与吸附温度的关系
由表2可知,随着温度的提高,微球的载药率是逐渐下降的。这是因为微球载药时是一个物理吸附过程,随着温度的上升,抑制了微球和药物的吸附作用。从表2还可看到,在考察的温度范围内,温度对吸附载药的影响并不显著。
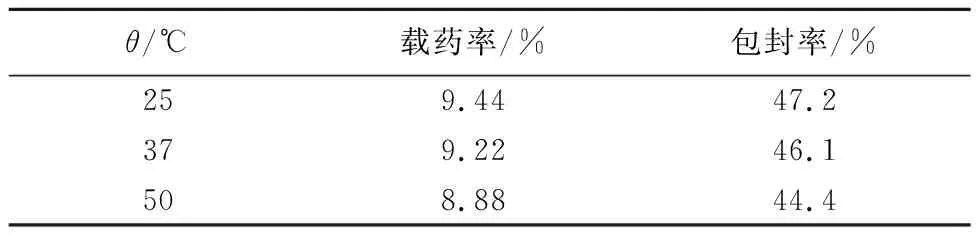
表2 纳米糊精微球载药量与温度的关系Tab.2 Effect of temperature on adsorption with drug of DNM
2.4 吸附载药纳米糊精微球的释药性能分析
随着降解时间的延长,由于α-淀粉酶的作用,微球逐渐被酶解,释放出吸附的药物,介质中的游离药量也在不断的增加。由图2可知,在模拟人体血液环境中,6 h后有23.94%的药物被释放。由于糊精微球表面的孔隙结构,溶胀后药物

图2 载药微球的降解曲线Fig.2 The degradation curve of the microsphere with drug
释放主要是通过糊精被酶降解或微球的骨架结构的溃散释放的。结果表明,在模拟人体血液环境中,载药纳米糊精微球具有很好的生物降解性。
3 结 论
纳米糊精微球在pH 7.4的磷酸氢二钠-磷酸二氢钠缓冲溶液中对注射用头孢曲松钠的吸附率为9.44%;吸附1.0 h后可达到吸附平衡;糊精微球的载药能力随着温度的升高而下降,但是下降幅度较小,说明温度对载药能力的影响不显著;载药能力随着投药量的增加而增加,但是包封率却是下降的,所以要综合考虑最佳的投药量。载药微球在模拟人体血液环境中6 h后有23.94%的药物被释放,说明纳米糊精微球作为药物载体在人体内具有很好的可被降解性。因此纳米糊精微球因其具有无毒及可生物降解性可以被用作药物载体。
[1] 张阳德. 我国纳米生物技术的医学应用及研究进展[J]. 中国医学科学院学报, 2006, 28(4):579-582.
[2] 刘海峰,常津,姚康德. 纳米高分子材料在医用载体方面的应用[J]. 化学通报, 2001, 64(6):332-338.
[3] NAH J W, JEONG Y D, KOH J J. Drug release from nanoparticles of poly(DL-lactide-co-glycolide)[J]. Korean Journal of Chemical Engineering, 2000, 17(2):230-236.
[4] CHAVANPATIL M D, KHDAIR A, PANYAM J. Surfactant-polymer nanoparticles:a novel platform for sustained and enhanced cellular delivery of water-soluble molecules[J]. Pharmaceutical Research, 2007, 24(4):803-810.
[5] 周承倜. 纳米技术的进展和医用纳米生物材料[J]. 大连大学学报, 2001, 22(6):1-6.
[6] 詹国平,黄可龙,张法旺. 载药淀粉微球的合成研究[J]. 化学世界, 2005, 46(12):726-729.
[7] 李静茹,金征宇. 可降解淀粉微球制备工艺的优化[J]. 食品科技, 2005(11):21-23.
[8] 胡晖,刘郁扬,范晓东,等. 温度及pH敏感的β-环糊精聚合物微球的合成及药物控制释放研究[J]. 高分子学报, 2005(3):357-362.
[9] 何凤慈,陈亮,孟德胜. 右旋酮洛芬-β-环糊精的制备和体外释药研究[J]. 第三军医大学学报, 2004, 26(18):1655-1657.
[10] 吴俊生. 血液的pH值与人体机能[J]. 河南大学学报:自然科学版, 1996, 26(3):58.
[11] 张素敏,孙庆元,李倩,等. 纳米糊精微球的制备与优化[J]. 现代化工, 2008(2):228-334.

