动态轴向压缩工业制备色谱分离丹参脂溶性单体化合物
朱 靖 博, 费 雅 君, 王 妍 妍, 郭 秀 洁
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
丹参(SalviamiltiorrhizaBunge)是一种多年生草本植物,为唇形科鼠尾草属,其干燥根及根茎是中医常用的一味历史悠久的活血化瘀药[1]。丹参的主要药效成分为脂溶性二萜类化合物和以丹酚酸为主的水溶性多酚类化合物[2-3]。其中丹参脂溶性单体已被证明具有保护心血管系统[4]、抗炎[5-6]、抗菌[7]等作用,在药理研究及新药开发等方面具有极高的实用价值。
目前,对于丹参脂溶性系列化合物的分离,在实验室水平有所突破,已分离得到40余种单体化合物[2],但大多工艺复杂,且生产周期长,耗费大量人力、物力。本文旨在采用动态轴向工业制备色谱技术建立丹参脂溶性单体的工业色谱分离工艺,实现批量化生产,促进丹参药物的现代化进程。
1 材料与方法
1.1 主要材料、试剂与仪器
材料与试剂:丹参药材(天津天士力丹参基地——陕西商洛);丹酚酸B、丹参素、丹参酮ⅡA及隐丹参酮对照品(实验室自制);柱层析硅胶,H60薄层层析用(青岛海洋);乙腈为色谱纯(美国TEDIA);双蒸去离子水(实验室自制);柱层析用二氯甲烷、石油醚为工业纯,其他试剂均为市售分析纯。
仪器:动态轴向压缩工业色谱系统DAC250系统(φ250 mm×1 000 mm,大连博迈科技发展有限公司),DAC150系统(φ150 mm ×1 000 mm,大连博迈科技发展有限公司)。UltiMate 3000型分析型高效液相色谱仪(美国戴安);UPLC-QTOF-MS (美国Waters公司);SK250H型超声清洗器(上海科导);ZF-1三用紫外分析仪(上海精科)。
1.2 分析方法
1.2.1 样品液的制备
对照品溶液的制备:分别精密称量对照品丹参酮ⅡA4.6 mg、隐丹参酮2.1 mg、丹酚酸B 8.1 mg和丹参素4.4 mg,用甲醇定容至10 mL,配制成质量浓度分别为0.46、0.21、0.81、0.44 mg/mL的混合对照品溶液。
样品溶液制备:各种提取物均配制为相当生药50 mg/mL的甲醇溶液。
1.2.2 丹参提取物的HPLC定量分析
色谱条件:色谱柱(4.6 mm×250 mm,5 μm),Sinochrom ODS-BP;流动相:A为含0.02%磷酸的乙腈,B为含0.02%磷酸的水溶液,进行梯度洗脱,具体方法见表1;体积流量,1 mL/min;检测波长,270 nm;进样量,20 μL。


表1 HPLC分析中流动相梯度洗脱条件Tab.1 Gradient program of mobile phase for HPLC analysis
1.2.3 丹参脂溶性化合物的TLC定性分析
用玻璃点样毛细管将样品液点在薄层硅胶板上,待板上样点干后,将板置于盛有展开剂的层析缸中上行展开,展距80 mm,取出,吹干,紫外灯254 nm下观测,计算斑点Rf值。
1.2.4 丹参酮单体的UPLC-QTOF-MS分析
UPLC分析条件:Waters ACGITYTMUPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈和水为流动相,体积比为60∶40,等度洗脱。
QTOF-MS分析条件:氮气作为喷雾与辅助气态,氩气作为碰撞气。ESI毛细管电压为2.5 kV,离子源和脱溶剂温度分别为120和350 ℃。扫描范围:m/z100~1 000 u。
1.3 分离纯化方法
1.3.1 丹参脂溶性化合物提取溶剂的选择
称取丹参生药粉(40 目)5 g,分别加入一定体积的9 种不同溶剂,40 ℃下超声提取30 min,过滤、浓缩提取液,将各提取物定容,最终配制成相当于生药质量浓度为50 mg/mL的样品液,进HPLC分析;以提取物中某成分的质量浓度折算成原植物的含量,并用下述公式计算并比较提取率。
w(活性成分A)=C标iSiVi/miS标i
式中,w为活性成分A的提取率,mg/g;i为丹参酮ⅡA、隐丹参酮、丹酚酸B以及丹参素;C标i为成分i的对照品质量浓度,mg/mL;Si为样品中成分i的色谱峰面积,mAU·min;mi为原料质量,mg;S标i为成分i对照品峰面积,mAU·min;Vi为提取物定容体积,mL。
1.3.2 柱层析流动相的选择
根据色谱分离溶剂选择的“三角形法则”和某些溶剂的分离特性,选用丙酮、苯、乙酸乙酯、二氯甲烷与环己烷适当配比,对样品液进行单向展开。以点数、分离度、拖尾现象作为柱色谱分离能力的判断指标,对分离溶剂系统进行评价、筛选。
1.3.3 丹参脂溶性单体的分离
采用动态轴向压缩工业色谱柱,以硅胶为填料分离制备丹参脂溶性单体。将一定量的硅胶干法装入动态轴向压缩工业色谱柱中,用石油醚平衡后,以15.68 GPa的压力轴向压缩柱床。用适宜的方法将丹参的脂溶性组分上样,用合适的流动相以300 mL/min的体积流量进行梯度洗脱,每3 L收集一次,TLC跟踪检测合并色谱带相同组分。当 TLC检测不到样品或含量极微时,更换洗脱液比例。
2 结果与讨论
2.1 提取溶剂的选择
丹参中有两类主要活性物质,分别是水溶性的丹酚酸类和脂溶性的丹参酮类化合物。选择适宜的溶剂,尽可能降低提取丹参酮类化合物时酚酸类化合物的渗出,对于后期丹参酮类化合物的分离十分有利。HPLC分析结果见表2。
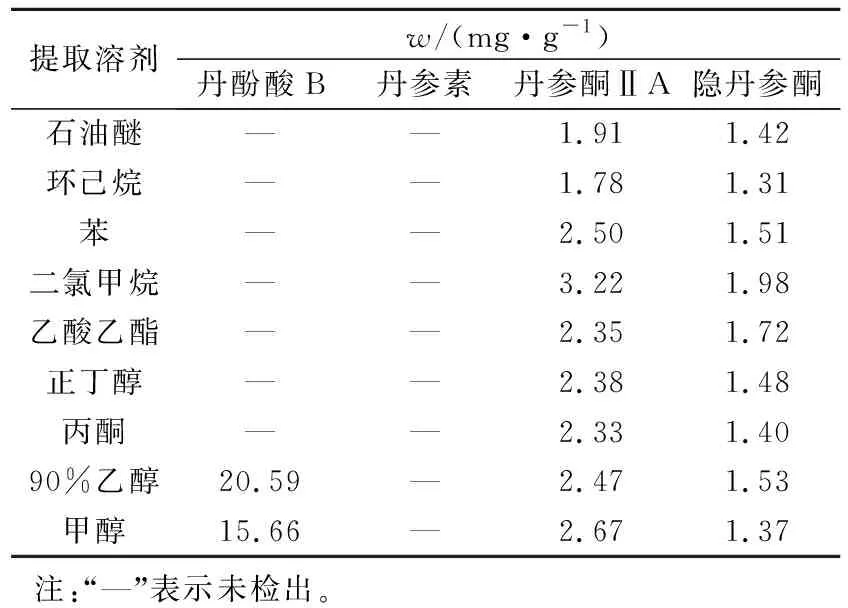
表2 不同提取溶剂提取物主要成分分析Tab.2 Content of different solvens extract
由表2可知,所选溶剂对丹参酮ⅡA、隐丹参酮均表现出一定的提取效果,其中以二氯甲烷溶剂单位提取量最高,且其对丹酚酸B和丹参素的提取量未检出,因此选择二氯甲烷作为提取溶剂。
2.2 薄层色谱及柱色谱流动相的选择
选择薄层色谱展开系统时,应使样品在TLC板上全程展开,目标化合物的Rf值在0.2~0.8[9]。表3给出了4种溶剂系统不同比例下的展开效果。结果表明,各系统对丹参脂溶性成分均有分离作用。其中在石油醚-乙酸乙酯体系中,薄层展开后可见6个斑点,较优于其他体系,但该体系有明显拖尾现象,这可能与石油醚-乙酸乙酯系统对丹参脂溶性化合物的溶解性差有关。综上,最终选择分离度好、不脱尾的石油醚-二氯甲烷系统作为柱层析的流动相。柱色谱分离的流动相极性应比TLC检测条件极性小,目标化合物Rf值在0.1~0.3[10]。根据所建立的薄层色谱检测条件,调整石油醚-二氯甲烷体系的比例,降低Rf值,最终选择V(石油醚)∶V(二氯甲烷)=10∶1作为柱色谱分离时初始流动相的比例。

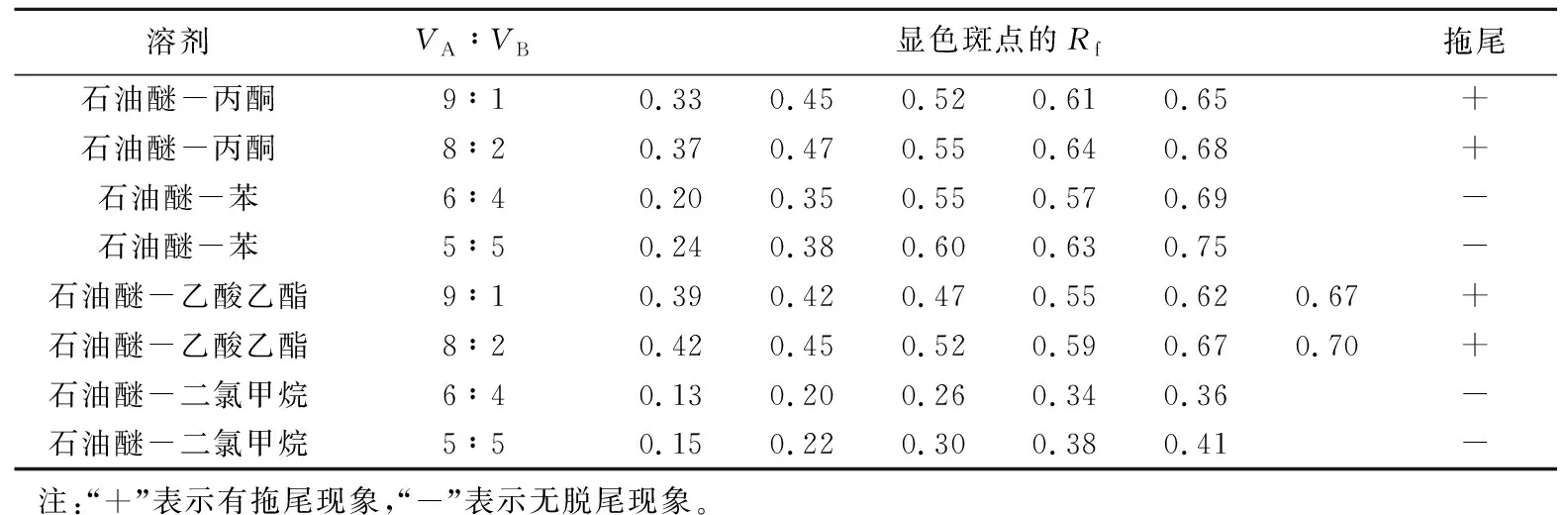
表3 不同展开剂的TLC分离结果Tab.3 The TLC results with various mobile phase
2.3 单体化合物分离
粉碎的丹参100 kg,充分干燥后,以4倍量二氯甲烷加热提取3次,浓缩提取液至一定体积,拌入1.5倍的硅胶,装入色谱预柱后串联于φ250 mm×1 000 mm动态轴向压缩工业色谱柱,分别以石油醚-二氯甲烷[V(石油醚) ∶V(二氯甲烷)=10∶1、8∶1、6∶1、3∶1、1∶1]和纯石油醚,以体积流量300 mL/min梯度洗脱,TLC检测共合并得到谱带相同的组分A、B、C、D 4段流分(HPLC结果见图1)。其中A段物质主要为丹参酮ⅡA前端的前杂物质,不作分离处理;B、C 2段物质则以丹参酮ⅡA为主,在精分中作合并处理,D段物质主要为隐丹参酮。
B-C段分离:将395 g B-C段用二氯甲烷溶解上样于φ150 mm×1 000 mm柱,以石油醚-二氯甲烷[V(石油醚)∶V(二氯甲烷)=10∶1、8∶1、6∶1]和纯二氯甲烷梯度洗脱,经8.8倍柱床体积溶剂洗脱,TLC跟踪合并得到BC-1、BC-2、BC-3、BC-4 4个组分,其中BC-2、BC-3、BC-4 TLC检测为单点。
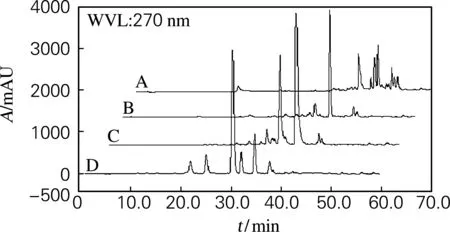
图1 一级柱层析A、B、C、D 4段流分的HPLC谱图Fig.1 HPLC chromatogram of A, B, C, D fraction from primary column chromatograph
D段分离:分离装置同B-C段。将315 g样品用二氯甲烷溶解上柱,以V(石油醚)∶V(二氯甲烷)=5∶1、4∶1、3∶1和纯二氯甲烷梯度洗脱,3 L为一份进行收集。经过6.2个柱床体积的洗脱,TLC跟踪合并得到D-1、D-2、D-3 3个组分,其中D-2 TLC检测为单点。
2.4 结 晶
将BC-2、BC-3、BC-4、D-2 4部分溶液分别在低于45 ℃下减压浓缩至干,加少量二氯甲烷溶液结晶,得到晶体BC-2(141.5 g)、BC-3(8.2 g)、BC-4(12.5 g)和D-2(73.2 g)。
2.5 化合物鉴定
BC-2,鲜红色针状结晶(二氯甲烷),UVλmax(MeOH)=223.4、253.4、268.8 nm。HPLC鉴定表明其保留时间、紫外吸收与丹参酮ⅡA一致。与文献[11]比较,可确定该化合物为丹参酮ⅡA,HPLC测定相对纯度为98.5%。
BC-3,黑紫色细柱状结晶(二氯甲烷),UVλmax(MeOH)=226.1、291.1 nm,UPLC-QTOF-MS 分析正离子[M+H]+=279,说明其相对分子质量为278,将其光谱数据与文献[12]对照,与1,2-二氢丹参醌相似,尚需进行13C NMR、1H NMR进一步确定。HPLC测定其相对纯度为95.4%。
BC-4,棕红色针状结晶(二氯甲烷),UVλmax(MeOH)=245.7、267.1、323.7 nm,UPLC-QTOF-MS 正离子[M+H]+=277,将其质谱数据与文献[11,13-14]对照,确定BC-4为丹参酮Ⅰ,HPLC测定相对纯度为96.2%。
D-2,橙红色针状结晶(二氯甲烷),UVλmax(MeOH)=219.2、264.2、292.2 nm,HPLC鉴定表明其保留时间、紫外吸收与隐丹参酮一致,并与文献[11]对照,确定该化合物为隐丹参酮,HPLC测定相对纯度为97.8%。
3 结 论
高纯度单体化合物的制备已成为药物制备、生物活性及ADME(药物吸收、分布、代谢和排泄)系统评价优化等研究内容中最基础的工作。工业制备色谱正是适应科技与生产需要发展起来的一种高效的分离手段。本文通过HPLC优选提取溶剂,并结合TLC实验筛选得到合适的展开剂以及柱色谱分离条件,将结果直接放大到动态轴向压缩工业色谱柱制备分离中,建立了应用动态轴向压缩工业色谱柱分离高纯度丹参脂溶性单体化合物的分离工艺。结果表明,应用动态轴向压缩工业色谱柱分离丹参脂溶性单体化合物,分离操作工艺简单、易实施,分离周期短、效率高,对于天然活性成分单体的制备具有重要意义。
[1] 国家药典委员会. 中国药典[M]. 北京:化学工业出版社, 2005:52-53.
[2] 孔德云. 丹参的化学成分[J]. 中国医药工业杂志, 1989, 20(6):279-285.
[3] ZHOU Limin, ZUO Zhong, CHOW Moses. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics, and clinical use [J]. The Journal of Clinical Pharmacology, 2005,45:1345-1359.
[4] MAKI T, KAWAHARA Y, TANONAKA K. et al. Effects of tanshinone Ⅵ on the hypertrophy of cardiac myocytes and fibrosis of cardiac fibroblasts of neonatal rats [J]. Planta Medica, 2002, 68(12):1103-1107.
[5] YAGI A, TAKEO S. Anti-inflammatory constituents, aloesin and aloemannan in Aloe species and effects of tanshinon VI in salvia miltiorrhiza on heart [J]. Yakugaku Zasshi, 2003, 123(7):517-532.
[6] KIM S, MOON T, CHANG H, et al. Effects of lanshinone I isolated fromSalviamiltiorrhizaBunge on arachidonic acid metabolism and in vivo inflammatory responses[J]. Phytotherapy Research, 2002, 16(7):616-620.
[7] 朱嘉蓉,罗厚蔚. 丹参酮ⅡA的抑菌活性研究[J]. 中国医科大学学报, 2004, 35(4):368-370.
[8] RICHARD J. CANNEL P. Natural Products Isolation [M]. New Jersey:Humanna Press, 1998.
[9] LU Dayan, KANG Qiangsheng. Therory and practice from TLC to industrial prepartive chromatography(IPC) in the separation of natural product[J]. 天然产物研究与开发, 2004, 16(2):153-156.
[10] 胡俊杰. 丹参有效成分的提取、分离与结构鉴定及乳源康制剂的药理与临床应用研究[D]. 兰州:甘肃农业大学, 2004.
[11] 冯宝树,李淑容. 丹参化学成分的研究—— 一对新异构化合物的发现[J]. 药学学报, 1980, 15(8):489-494.
[12] 房其年,张佩玲,徐宗沛. 丹参抗菌有效成分的研究 [J]. 化学学报, 1976, 34(3):197-209.
[13] 于文佳,何坚,沈金灿,等. 高分辨率电喷雾飞行时间质谱测定丹参脂溶性组分[J]. 高等学校化学学报, 2003, 24(4):621-623.

