一种嗜碱菌微生物发酵法生产乳酸的条件优化
杨 大 伟, 田 晶, 苑 广 志, 徐 龙 权
( 大连工业大学 现代教育技术部, 辽宁 大连 116034 )
0 引 言
乳酸是重要的生物化工产品,广泛用于医药、食品、饮料、日用化工、石油化工、皮革、卷烟工业等领域[1]。特别是近年来开发出的L-乳酸的聚合物,可生产生物降解的农用地膜及其他塑料制品代替无法降解的常用塑料,能解决全球的“白色”污染问题[1],因而乳酸有广阔的国内外市场。
目前乳酸的生产方法主要有化学合成法[2]、酶法[3]和发酵法[4]。化学合成法所用的原料是乙醛和剧毒物质氢氰酸,生产成本也较高,因而该法生产乳酸受到极大地限制。酶法生产乳酸虽然可以专一性得到旋光乳酸,但工艺比较复杂,应用于工业还有待于进一步研究。微生物发酵法可通过菌种和培养条件的选择而得到具有专一性的D-乳酸、L-乳酸或是DL-乳酸[5-6],且乳酸菌具有发酵温度高、产酸率相对较高、对糖利用率高、发酵时不需通氧气等优点,因此发酵法具有非常广阔的前景[7-9]。
作者从14株嗜碱菌中筛选出一株性能优良的产乳酸菌,并对该菌发酵生产乳酸的培养基和发酵条件做了初步研究,以期为极端微生物的进一步开发利用提供一些有价值的参考。
1 材料和方法
1.1 材料和菌种
14种嗜碱菌F1-2、F1-5、F27-4、288、289、CG、Tc10、SH1、SH2、XH2、LP3-1、LP3-2、LP3-3、LP3-4,中科院微生物研究所极端环境微生物组菌种保藏中心提供;P/ACE MDQ 毛细管电泳仪(Beckman公司,美国);TJL-16G台式离心机,上海安亭科学仪器厂;THZ-82(A) 数显水浴恒温振荡器,江苏省金坛市荣华仪器制作有限公司;LRH-150生化培养箱,上海一恒科技; UV2450紫外分光光度计,日本岛津公司;所用试剂均为分析纯。
1.2 乳酸产生菌的筛选
将14株嗜碱菌接种到平板筛选培养基进行初筛。初筛得到的几株菌经种子培养基活化两代后,按10%接种量将各株菌接种到装液量为30 mL的100 mL三角瓶中,采用筛选培养基,35 ℃,200 r/min,通气恒温振荡培养36~72 h,并定期取发酵液检测其产生乳酸的量及OD值,筛选出一株性能优良的乳酸菌。将筛选到的乳酸菌接种于20 mL种子培养基,于35 ℃、200 r/min恒温振荡培养24 h;取出5 mL培养液转接到50 mL培养基中,于35 ℃培养16 h后转接入250 mL种子培养基中。在35 ℃条件下,每隔2 h取样,用0.85%的氯化钠溶液稀释20倍,并以各瓶离心去除菌体后稀释相同倍数种子液作为空白对照,测定OD600值。
1.3 发酵培养基的优化
对培养基中碳源、氮源及碳氮比进行了选择及优化。在基础培养基(葡萄糖20.0 g,胰蛋白胨2.0 g,酵母膏10.0 g,牛肉膏3.0 g,无水乙酸钠2.0 g, 柠檬酸三铵 2.0 g,K2HPO4·H2O 2.0 g,MgSO4·7H2O 0.2 g,MnCl2·4H2O 0.06 g,NaCl 40 g,吐温80 1 mL,酚红5%,pH=9.0,去离子水1 L)的基础上,分别以葡萄糖、麦芽糖、淀粉、乳糖、木糖、果糖作为碳源,用量为2%;以酵母膏、蛋白胨、牛肉膏、尿素、硝酸铵、硫酸铵作为氮源,用量为0.5%。斜面菌种经种子培养基活化16 h后,按5%接种量转接入50 mL培养基中,于35 ℃、200 r/min,恒温振荡培养48 h,定期取样品测定OD600值及乳酸的产量。对所选氮源调整用量分别为0.5%、1%、1.5%,确定最佳用量;对所选碳源、氮源的比值分别采用1∶1、2∶1、3∶1、4∶1、5∶1、6∶1,确定最佳碳氮比。
1.4 发酵条件的优化
分别考察接种量、初始pH值、温度、装液量等条件对乳酸产量的影响,并进行优化。接种量分别为1%、3%、5%、8%、10%,初始pH分别为6.0、7.0、8.0、9.0、10.0、11.0,采用35 ℃、200 r/min恒温振荡培养48 h,定期取样品测定OD600值及乳酸的产量;考察了培养温度为20、25、30、35、40 ℃时菌株的发酵情况;调整250 mL三角瓶装液量,分别为30、50、80、125 mL进行培养,同时对125 mL装液量的菌体在培养时采用12 h好氧和整个培养期间全封闭式培养。
将菌种经种子培养基活化16 h后,转接入优化后的培养基,采用优化的条件发酵48 h,期间每隔2 h取样检测发酵液的OD600值、pH值和乳酸产生量,绘制菌株的生长曲线及产物生成曲线。
1.5 发酵液乳酸的毛细管电泳检测
1.5.1 毛细管电泳的操作条件
P/ACE MDQ 毛细管电泳仪,熔融石英毛细柱(37 cm×50 μm I.D)。分离电压,负电压,8 kV;进样压力,3.4 kPa,时间6 s;柱温,25 ℃;紫外检测波长,200 nm;进样量,100 μL。
1.5.2 毛细管电泳检测方法
配制0.2~4.0 mg/mL系列乳酸标准溶液,在“1.5.1”所述电泳条件下依次进行分析,得到乳酸的标准曲线。在相同的电泳条件下测定发酵液中乳酸的含量。
将实际发酵液在8 000 r/min转速下离心20 min,上清液经0.22 μm针筒式水膜过滤器过滤,稀释一定倍数后取样100 μL进行检测。每个样品重复测定3次。
2 结果与讨论
2.1 乳酸产生菌的筛选结果
出发菌株的初筛结果列于表1中。从表1可以看出,在14株菌中,289、SH1和LP3-3生长和产酸情况明显好于其他菌株;其中SH1生长情况最好,LP3-3产酸最多。因此选择289、SH1和LP3-3进行复筛。


表1 各株菌在筛选平板上的生长及产酸情况Tab.1 Growth and yield of acids at preliminary screening
289、SH1和LP3-3复筛结果见图1。289、SH1和LP3-3 3菌株发酵24 h时乳酸产量相差不大;34 h时289、SH1两株菌的乳酸产量基本没有增长,而LP3-3的乳酸产量明显高于其他两株菌,说明LP3-3进入衰老期较晚,更易提高产酸量。因此选择LP3-3作为出发菌株。
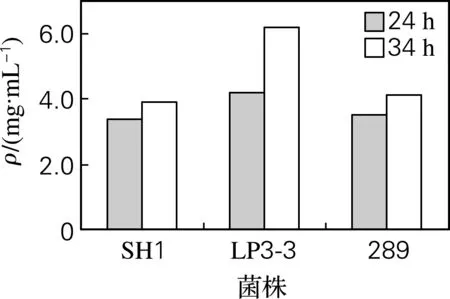
图1 289、SH1和LP3-3三株菌复筛结果Fig.1 Yield of acids at screening of 289, SH1 and LP3-3
2.2 发酵培养基的优化结果
通过考察培养基中碳源、氮源种类、浓度以及碳氮比对发酵过程乳酸产量的影响,确定葡萄糖为最佳碳源,酵母膏为氮源,添加质量分数为0.2%的蛋白胨做辅助氮源,氮源质量分数为1%,碳氮比为5∶1(见图2~5)。最佳发酵培养基组成(g/L):葡萄糖50.0,胰蛋白胨2.0,酵母膏10.0,蛋白胨 2.0,无水乙酸钠2.0,柠檬酸三铵2.0,K2HPO4·H2O 2.0,MgSO4·7H2O 0.2,MnCl2·4H2O 0.05,NaCl 40,吐温80 1 mL。用10%的NaHCO3调节pH,初始pH为9.0。
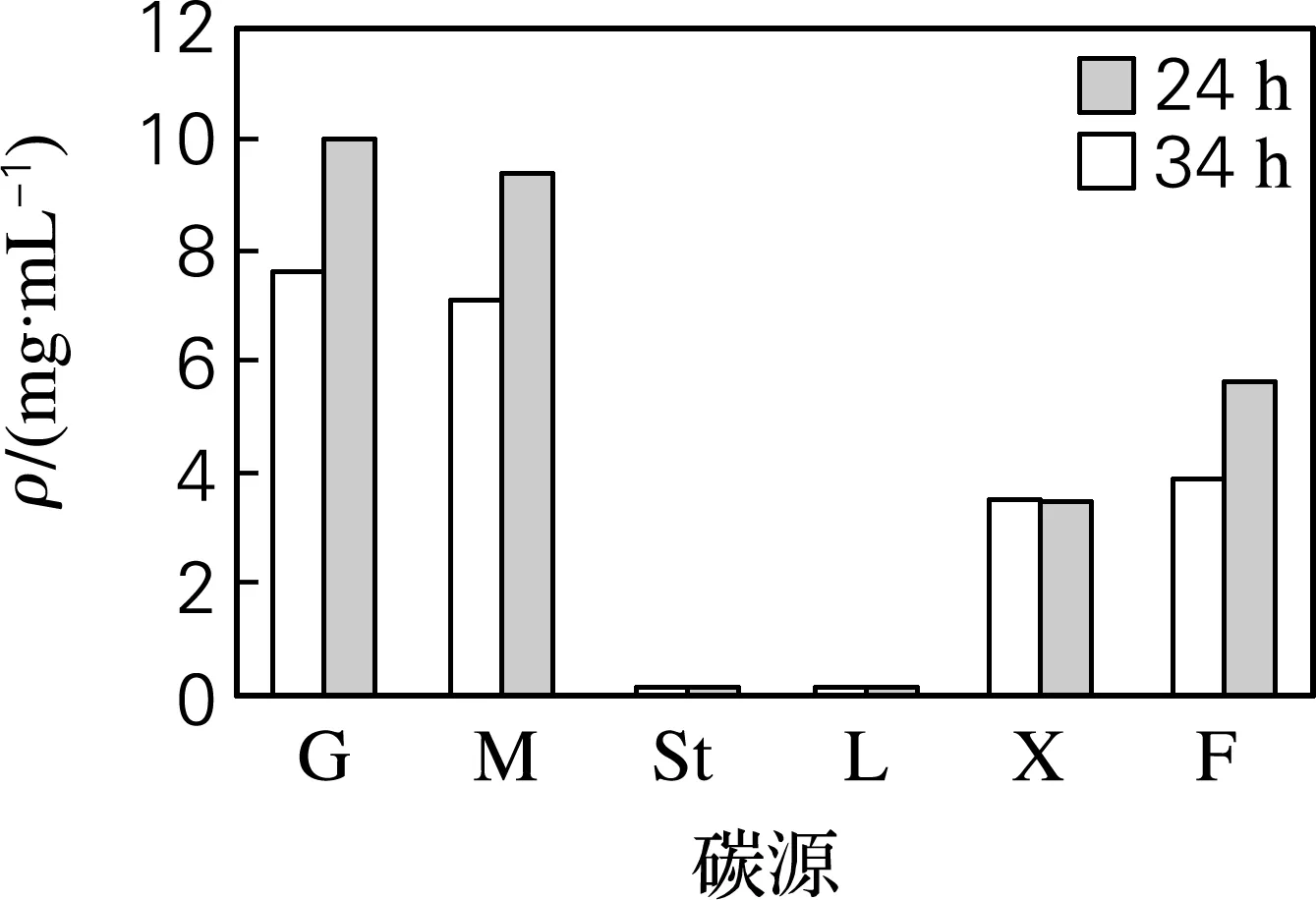
G,葡萄糖; M,麦芽糖;St,淀粉;L,乳糖;X,木糖;F,果糖
2.3 发酵条件的优化结果
接种量小于5%时,随着接种量的增加,产生的乳酸量也相应增加,但当接种量超过5%后,乳酸量反而下降,因此采用接种量为5%。随着初始pH值的增加,菌体的生长速率逐渐变快,而初始pH 6~8时,菌体只有少量生长,且乳酸产量也较少;初始pH为9、10、11的发酵液中的乳酸量相对较多,其中pH=9时乳酸产量最高,因此选择初始pH值为9。通过考察不同温度时的发酵情况,确定35 ℃作为发酵温度,种子培养温度为30 ℃,发酵时用密封发酵较好,且宜采用125 mL装液量250 mL摇瓶发酵。
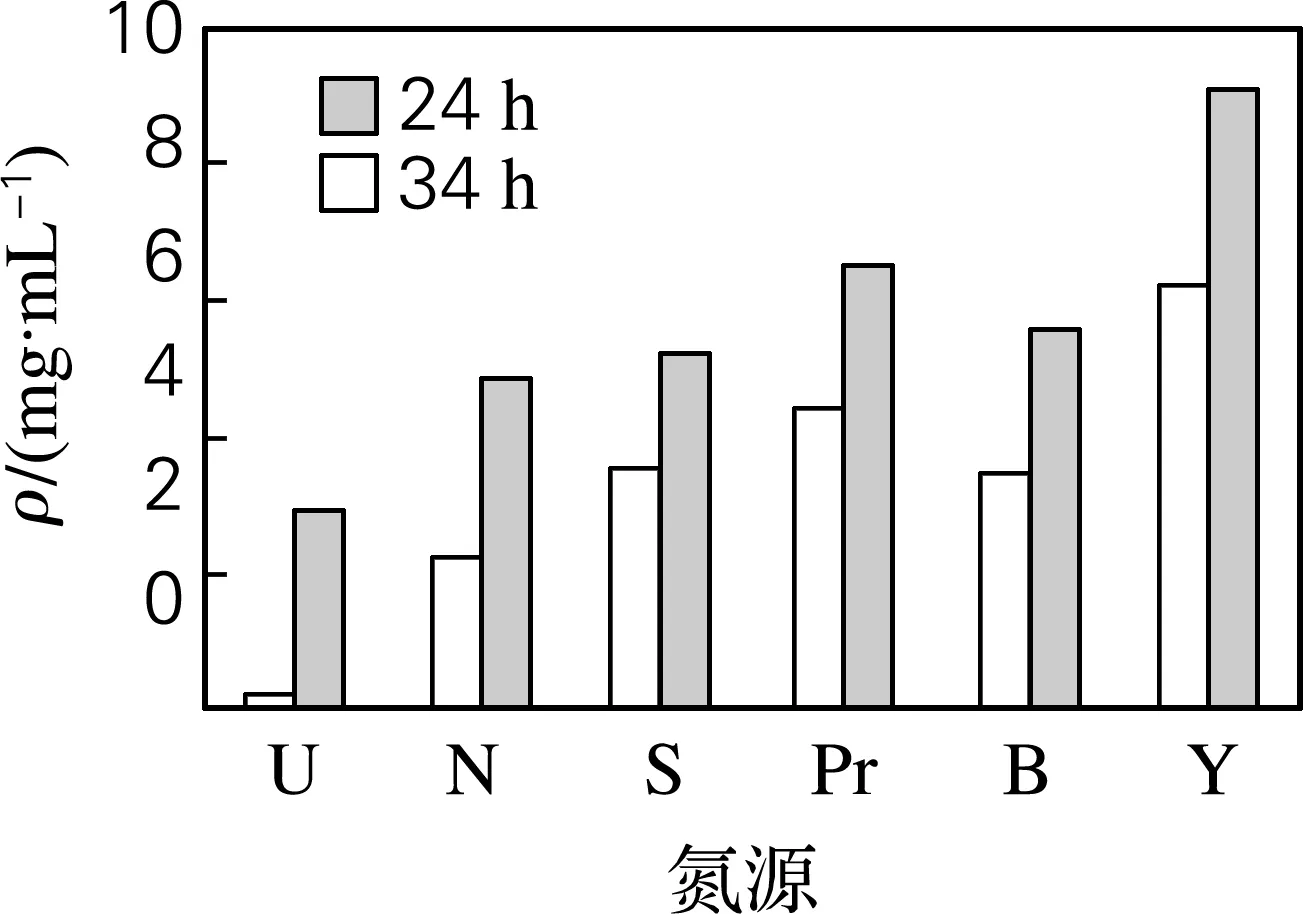
U,尿素;N,硝酸铵;S,硫酸铵;Pr,蛋白胨;B,牛肉膏;Y,酵母膏
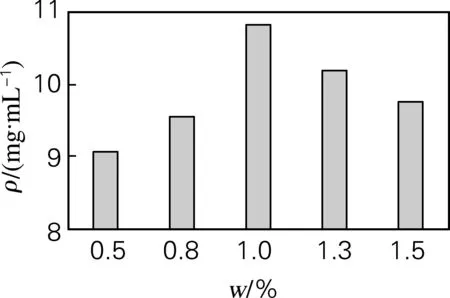
图4 氮源质量分数对乳酸产量的影响Fig.4 Effect of concentration of nitrogen sources on lactic acid production
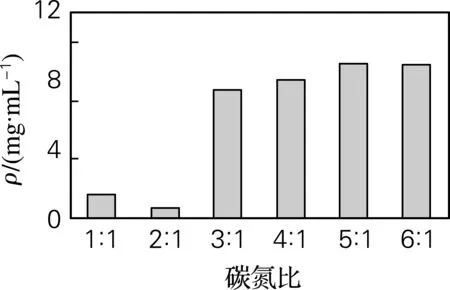
图5 碳氮比对乳酸产量的影响Fig.5 Effect of proportion of carbon and nitrogen on lactic acid production
利用最佳发酵条件和优化培养基发酵42 h得到菌株生长曲线及产物生成曲线。从图6看,0~4 h为延滞期,4~20 h为菌体的对数生长期,其后为稳定期,直至42 h开始衰亡。菌体生长过程中伴随乳酸的产生,在菌体数量达到稳定,即20 h左右,乳酸仍然在缓慢增加,直至38 h左右达到峰值,说明菌体在先完成自身生长之后才开始大量积累乳酸,这与前面的结论是一致的。从图7看,在0~24 h,pH值变化较大,随着乳酸的增加pH值逐渐降低,但变化较缓,主要是由培养基中NaHCO3的缓冲作用引起的。从菌体生长情况也可看出该菌的生长pH值范围较宽,但最适仍为9.0。

图6 LP3-3菌株生长曲线Fig.6 Growth curve of LP3-3

图7 产物生成及pH变化曲线Fig.7 Curve of pH and lactic acid production
2.4 毛细管电泳检测结果
乳酸的线性范围为0.2~4.0 mg/mL,峰面积(A)与质量浓度(C)之间的线性关系为A=25 649C+1 147.2,线性相关系数为0.999 4,检出限为0.1 mg/mL,迁移时间相对标准偏差为0.24%,峰面积相对标准偏差为2.11%,样品加标回收率为102.3%(n=4),LP3-3菌株发酵产乳酸的测定结果如表2所示。
2.5 菌株的初步鉴定
对筛选到的菌株进行了初步鉴定,LP3-3经16S rRNA序列测定初步鉴定为Exiguobacteriumaurantiacum。

表2 LP3-3菌株发酵产乳酸的测定结果Tab.2 Concentration of lactic acid produced by fermentation of LP3-3
3 结 论
从14株耐碱菌中筛选到一株LP3-3产乳酸能力较强,对该菌株进行乳酸发酵优化后,确定了最佳发酵培养基组成及摇瓶发酵最佳条件。采用毛细管电泳检测发酵液中乳酸的含量, 出发菌株乳酸产量为10.02 g/L,在最佳发酵条件下乳酸产量为16.27 g/L,比原来提高62.4%,达到了较好的效果。本研究可为极端微生物在微生物发酵法生产乳酸等生物基产品的开发利用提供参考。
[1] 刘伟雄. 乳酸和聚乳酸的最新进展[J]. 食品与发酵工业, 2001, 27(3):61-65.
[2] DATTA R, TSAI S P, BONSIGNORE P, et al. Technological and economic potential of poly(lactic acid) and lactic acid derivatives[J]. FEMS Microbiology Reviews, 1995, 16: 221-231.
[3] 曹本昌,徐建林. L-乳酸研究综述[J]. 食品与发酵工业, 1993, 11(3):56-61.
[4] KARIN H, BARBEL H. Factors affecting the fermentative lactic acid production from renewable resources[J]. Enzyme and Microbial Technology, 2000, 26: 87-107.
[5] 金其荣,张继民,徐勤. 有机酸发酵工艺学[M]. 北京:中国轻工业出版社,1989:339.
[6] KULOZIK U, WILDE J. Rapid lactic acid production at high cell concentrations in whey ultrafitrate by Lactobacillus helveticus[J]. Enzyme and Microbial Technology, 1999, 24(5/6):297-302.
[7] 钱志良,胡军,雷肇祖. 乳酸的工业化生产、应用和市场[J]. 工业微生物, 2001, 31(2):49-53.
[8] STILES M E, HOLZAPFEL W H. Lactic acid bacteria of foods and their current taxonomy[J]. International Journal of Food and Microbiology, 1997, 36:1-29.
[9] SREENATH H K,MOLDES A B, KOEGEL R G, et al. Lactic acid production from agriculture residues[J]. Biotechnology Letters, 2001, 23:179-184.

