真菌诱导子对北虫草深层培养的影响
李 勇,高 倩,曹英杰,李 娜,贾景明
(沈阳药科大学,辽宁 沈阳 110016)
北虫草 Cordyceps militaris(L.)Link又名蛹虫草,是我国名贵中药材之一[1],主要分布于吉林、辽宁、陕西、河北等地[2]。虫草素(3'-脱氧腺苷,3'-deoxyadenosine)亦称虫草菌素(cordycepin),是一种核苷类抗生素[3],最初虫草素是从蛹虫草培养物中分离得到[4-5],具有免疫调节、抗肿瘤、抗炎等多种药理活性[6-8]。其在蛹虫草中的含量明显高于冬虫夏草[9],是北虫草中一种重要的化学成分。本试验探讨了添加不同种类、不同浓度的真菌诱导子对蛹虫草液体培养中虫草素产量的影响,并以北虫草的菌丝体干重和虫草素为指标筛选出对北虫草生长和虫草素有促进作用的真菌诱导子,为利用北虫草深层发酵虫草素提供合理配方,以满足工业化生产的需要,同时也为功能性保健食品的进一步开发提供科学依据。报道如下。
1 材料与方法
1.1 材料
岛津高效液相色谱仪(日本岛津);HU3120B型超声处理器(北京来亨科学仪器有限公司);FA2104型电子分析天平(上海民桥精密科学仪器有限公司);JT-150型超级净化工作台(沈阳利港净化设备有限公司);HN101型数显鼓风干燥箱(南通沪南科学仪器有限公司)。虫草素(中国药品生物制品检定所,批号为 858-200202);盐酸噻胺(北京奥博星生物技术有限责任公司);核黄素(北京奥博星生物技术有限责任公司);甲醇、乙腈(康科德,色谱纯),水(娃哈哈纯净水),其他试剂(分析纯)。菌种为北虫草 Cordyceps militaris(L.)Link,本实验室保藏;真菌诱导子有青霉菌(Penicillium italicum Wehmer)、番茄灰霉(Botrytis cinerea Pers.)、黄瓜炭疽病菌(Gloeosporium orbiculare Ars)、酵母菌(Saccharomyces cerevisiae)由沈阳药科大学微生物教研室张怡轩老师提供。斜面培养基(%)为马铃薯 20 g,蔗糖 2.0 g,琼脂 2.0 g;改良培养基(%)为马铃薯20 g,蔗糖2.0 g,蛋白胨0.2 g;发酵基础培养基(%)为马铃薯4 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,盐酸噻胺 0.001 g,核黄素0.001 g,蔗糖 1 g。
1.2 方法
北虫草菌种斜面培养:用无菌环从保存的斜面菌种中挂取0.5 cm2菌种,转接到新鲜斜面培养基中,放置培养箱中,培养温度(25 ± 1)℃,光照强度 58.4 μmol/(m2·s),光照时间 24 h/d,培养时间7 d。
北虫草菌种液体培养:在无菌条件下,用接种环在斜面培养基上刮去2 cm2的菌种,转移至200 mL的发酵基础培养基中培养,培养温度(25 ±1)℃,光照强度 58.4 μmol/(m2·s),光照时间 24 h/d,摇床转速120 r/min。
真菌系复壮:从保存的斜面菌种中刮取0.5 cm2母种,转到新鲜的斜面培养基上,培养3代,继代时间为5 d,培养温度(25±1)℃。
真菌菌丝体培养:将复壮的真菌2 cm2转入200 mL改良培养基中进行培养,培养温度(25±1)℃,摇床转速120 r/min,培养时间为7 d。
真菌诱导子制备:待真菌菌丝体充分生长后,将培养物在40℃烘至恒重,研磨后过80目筛,收集粉末加蒸馏水配成悬浊液,121℃,0.1 MPa灭菌 20 min,待用。
培养方法:在无菌条件下,将培养好的种子液按5%的接种量转接到含有250 mL的发酵培养基中,培养温度(25±1)℃,光照强度 58.4 μmol/(m2·s),光照时间 24 h/d,培养时间 7 d。考察各真菌诱导子对生长量和虫草素产量的影响。
含量测定方法:采用反相高效液相色谱法测定虫草素的含量。流动相为乙腈-水-甲醇(5∶90∶5,V∶V∶V),检测波长为260 nm,流速为 0.8 mL/min,柱温 40 ℃。
菌丝体中虫草素测定:精密称取虫草素菌丝体0.1 g,溶于5 mL 50%甲醇溶液中,超声提取30 min,补足减失质量,培养物先经滤纸初滤,再经0.45 μm微孔滤膜过滤,用微量进样器精密吸取10 μL 滤液,进样。
培养液中虫草素测定:培养液10 mL在60℃蒸干至恒重,溶于5 mL 50%甲醇溶液中经0.45 μm微孔滤膜过滤,取10 μL进样。
菌丝体干重测定:取北虫草液体培养物,在3 000 r/min条件下离心15 min,菌丝体在60℃烘至恒重,称重。
2 结果与分析
2.1 菌丝体干重、培养液和菌丝体虫草素含量的变化情况
菌种接入到液体培养基后,菌体处于一种崭新的生长环境中,此时菌体并不是立刻生长,1~2 d菌丝体生长缓慢,此时期为延迟期。之后,随着时间的增加,菌丝体明显增加,此为对数生长期。4~6 d菌丝体生长速度下降,为稳定期,其中第5天菌丝体干重达到最大值为14.95 g/L。6~10 d菌丝体明显减少,培养液变浑浊,由于营养物质消耗殆尽,细胞发生自溶,这一阶段为衰亡期。图2显示出北虫草菌种在特定培养基中的生长规律,这为接种菌龄的选择提供了依据。为了获得菌丝体的最大值,应该在第5天进行测量。起初1~2 d虫草素产量在一个很低水平,2~5 d伴随菌丝体的生长而不断增加(图3)。起初营养物质主要用于菌丝体的生长;稳定期营养物质主要用于虫草素的合成;哀亡期细胞内的虫草素进入到培养液中,培养液中虫草素的含量略微增加。
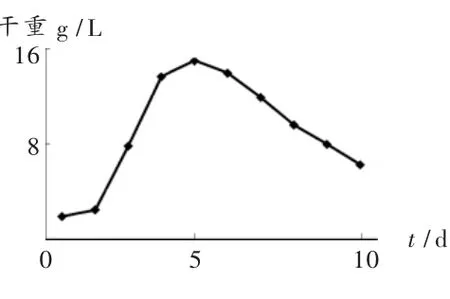
图2 菌丝体随时间变化趋势图

图3 虫草素含量随时间变化趋势图
2.2 不同种类、浓度的真菌诱导子对菌丝体干重的影响
比较不同种类和不同浓度的真菌诱导子对北虫草发酵培养物菌丝体干重、虫草素产量变化的影响,将未添加真菌诱导子的北虫草发酵物中菌丝体干重作为空白对照。结果见表1。可见,青霉菌、黄瓜炭疽和酵母菌对北虫草生长有抑制作用;酵母菌对菌丝体干重产量无明显作用;只有番茄灰霉能促进北虫草菌丝体的生长,对菌丝体干重的增幅在1.06~1.16倍,其中以0.02%番茄灰霉效果较好。对于菌丝体,加入番茄灰霉均能提高虫草素的产量,其中以0.02%番茄灰霉最显著;培养液中虫草素的含量,0.02%番茄灰霉是对照组的5.02倍,0.01%和0.05%番茄灰霉分别是对照组的3.73倍和3.11倍。酵母菌对虫草素的产量无明显作用。其他两种真菌诱导子均不同程度地抑制虫草素的产生。

表1 不同种类浓度的真菌诱导子对菌丝体干重和虫草素产量的影响
2.3 0.02%番茄灰霉对北虫草发酵培养的影响
由图4和图5可见,添加0.02%番茄灰霉诱导子的北虫草菌丝体的干重和虫草素含量较对照组都有明显的增加,菌丝体干重在第7天达到最大值17.45 g/L,菌丝体中虫草素含量在第7天达最大值0.798 mg/L,培养液中虫草素的含量为198.59 mg/L。诱导子的加入,延长了北虫草菌种的对数生长期,增加了生物量的积累的时间,使得菌丝体的干重和虫草素含量显著提高。
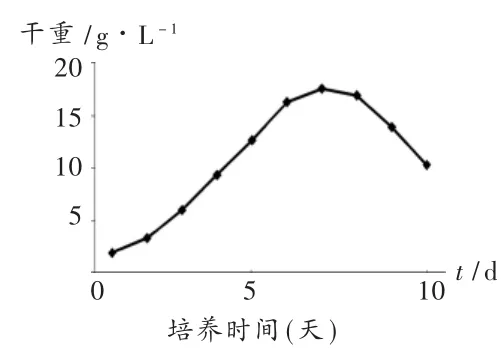
图4 0.02%番茄灰霉对北虫草菌丝体干重的影响
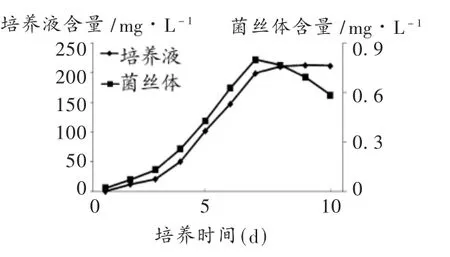
图5 0.02%番茄灰霉对虫草素含量的影响
3 讨论
将真菌诱导子应用于北虫草菌的发酵培养,以提高次生代谢产物的产量,具有一定的理论依据和现实意义。植物细胞与真菌细胞具有一定的同源性,二者在长期的进化中都具备了较完善的防御体系,都可通过调整自身代谢途径及强度对抗外界的各种不良刺激。本研究选择的4种真菌均为常见菌,其中黄瓜炭疽和番茄灰霉是为常见的植物致病菌,而青霉菌和酵母菌是自然界存在最广泛的真菌品种。四者都存在于北虫草的自然生存环境中,都有在自然条件下与北虫草接触并使北虫草发生防御反应的可能。因此,北虫草长期与这些真菌的接触,可能产生特定的防御反应而改变其代谢途径,产生大量具有活性的次生代谢产物,如虫草素等。本研究证实,不同浓度的番茄灰霉确实能促进北虫草对虫草素的合成,尤其是0.02%的番茄灰霉对培养物中虫草素产量的积累具有很好的促进作用。
本研究还对同种真菌诱导子的加入量作了初步考察。一般来说,真菌诱导子既含有活性成分,又含有拮抗成分。两者相互制约,当加入量小时,拮抗作用小,但诱导作用也小,诱导效果不是最好;当加入量多时,诱导作用增大,但拮抗作用也随着增大,效果也不好;只有加入量达到一个最适点,才能产生最好的诱导效果。这就要求对诱导子的加入量有一定的要求。本研究考察了4种真菌诱导子在0.01%,0.02%,0.05%浓度时对北虫草的发酵物中菌丝体干重和虫草素产量的影响,筛选出了一种起着正向诱导作用的诱导子,即番茄灰霉诱导子,但其作用机制还有待进一步探讨。
[1]中国医学科学药物研究所.新华本草纲要[M].上海:上海科学技术出版社,1990:731.
[2]施 英,吴娱明,廖森泰,等.蛹虫草药理作用研究进展[J].广东蚕业,2006,40(3):43 -45.
[3]抗菌素生物理化特性编写组.抗菌素生物理化特性(第1分册)[M].北京:人民出版社,1977:983.
[4]委会平,肖 波,胡开始.蛹虫草药用价值考[J].中药材,2004,27(3):215-217.
[5]Cunningham KG,Hutchinson SA,Manson W,et al.Cordycepin,a metabolic product from cultures of Cordyceps militaris(Linn.)Link[J].Nature,1950,166(4 231):949.
[6]Ahn YJ,Park SJ,Lee SG,et al.Cordycepin:selective growth inhibitor derived from liquid culture of Cordyceps militaris against Clostridium spp[J].Agric Food Chem ,2000,48:2 744 -2 748.
[7]Kodama EN,McCaffrey RP,Yusa K,et al.Antileukemic activity and mechanism of action of cordycepin against terminal deoxynu-cleotidyl transferase - positive(TdT+)leukemic cells[J].Biochem Pharmacol,2000,59:273-281.
[8]Muller WE,Weiler BE,Charubala R,et al.Cordycepin analogues of 2',5'-oligoadenylate inhibit human immunode?ciency virus infection via inhibition of reverse transcriptase[J].Biochemistry ,1991,30:2 027 -2 033.
[9]刘静明,刘 岱,杨立新,等.蛹虫草菌丝体与冬虫夏草中核成分的含量测定[J].中国中药杂志,1994,19(10):615 -615.