Bmi-1在黑色素瘤中的表达及其与p16相关性分析
尹利华 刘纯青 曾亮 孟秀香
1.湖南怀化医学高等专科学校医学检验系,湖南 怀化 418000;2.大连医科大学检验医学院,辽宁 大连 116044;3.湖南省肿瘤医院病理科,湖南 长沙 410013
黑色素瘤(malignant melanoma, MM)是来源于黑色素细胞的一种侵袭力强、转移性高、进展迅速且预后极差的高度恶性肿瘤。其发病率在近二十年中成倍增长[1]。多梳基因家族的Bmi-1被认为是一种原癌基因,参与细胞转化和肿瘤形成。现有众多实验数据显示Bmi-l在多种肿瘤中均有高表达[2-3]。但有关Bmi-l与黑色素瘤的研究较少。p16基因是近年发现的直接参与细胞生长增殖负调控的抑癌基因[4]。本研究旨在检测黑色素瘤组织中Bmi-1及p16蛋白的表达水平,及其与黑色素瘤临床病理特征的关系,并研究二者在黑色素瘤中表达的相关性。
1 资料和方法
1.1 临床资料 收集2003年—2007年期间湖南省肿瘤医院病理科保存的黑色素瘤石蜡标本35例,另选14例皮内痣样本作为良性对照。所有组织HE切片经两位病理医生读片(双盲法)以及HMB45、S-100蛋白免疫组织化学检测确诊。在35例黑色素瘤患者中,男性14例,女性21例;年龄18~83岁,平均51.1岁;有淋巴结转移12例,死亡7例;根据病理(Clark标准)分级:Ⅰ级7例,Ⅱ级7例,Ⅲ级4例,Ⅳ~Ⅴ级17例。皮内痣组男性4例,女性10例;年龄14岁~53岁,平均38.1岁。所有标本均经4%的甲醇溶液固定,常规石蜡包埋,4 μm厚做连续切片,室温保存。
1.2 试剂及方法 二甲苯脱蜡,梯度乙醇水化处理,3%H2O2溶液消除内源性过氧化物酶,PBS缓冲液(pH7.4)洗片,柠檬酸缓冲液(pH6.0)抗原修复液常规修复:微波炉中750 W 12 min,冷却3 min,750 W 12 min加热以充分暴露抗原位点。待自然冷却后,加封闭液室温封闭30 min,分别滴加鼠抗人Bmi-1多克隆抗体(l∶100稀释液,Abcam USA)及鼠抗人P16单克隆抗体工作液(l∶150稀释液, Santa Cruz USA),4 ℃温育过夜。PBS缓冲液冲洗,分别加二抗(羊抗鼠,北京中杉公司SP试剂盒)37 ℃温育60 min,PBS缓冲液冲洗,滴加S-A/HRP液(北京中杉公司SP试剂盒),室温温育30 min,PBS缓冲液冲洗,用新鲜配置的DAB溶液显色。镜下控制反应时间,自来水终止显色,用苏木素复染细胞核,梯度乙醇脱水,中性树胶封片,显微镜下观察。实验分别用已知阳性组织切片作为阳性对照,用PBS代替2种一抗为阴性对照。
1.3 结果评定标准 免疫组织化学法染色阳性反应为显微镜下可见细胞质和(或)细胞膜、细胞核呈棕黄色。每张切片随机观察10个高倍镜视野,根据染色阳性细胞所占细胞的百分比及染色强弱程度,将结果分为:<5%为(-),6%~30%为(+),31% ~60%为(++),>60%为(+++),将(++~+++)定为中高表达,将(-~+)定为低表达。如果阳性细胞数达到标准,但染色强度较弱者,相应降低一级。以上结果至少由两位病理科医生在双盲情况下独立观片后统一所得。
1.4 统计处理 采用SPSS 16.0统计软件对数据进行处理,黑色素瘤与皮内痣组的组间差异采用卡方统计分析;Bmi-1与p16间的相关性采用Spearman相关性分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Bmi-1和p16蛋白在黑色素瘤组织中的表达 免疫组织化学检测结果显示,Bmi-1和p16均主要表达在细胞核,表现为细胞核内呈现棕黄色或棕褐色颗粒,也有少量表达在细胞质。本组35例黑色素瘤中Bmi-1阳性表达率为63%(22/35),中高阳性表达率为51%(18/35),14例皮内痣中Bmi-1阳性表达率为71%(10/14),中高阳性表达率为14%(2/14)。可见Bmi-1蛋白在黑色素瘤组织中的中高阳性表达率明显高于皮内痣组(χ2=5.711,P<0.05),而两组间的阳性表达率差异无统计学意义(χ2=0.056,P>0.05)。p16在35例黑色素瘤中阳性表达为17%(6/35),中高阳性表达为6%(2/35);14例皮内痣中p16阳性表达率为93%(13/14),其中中高阳性达71%(10/14)。可见p16蛋白在黑色素瘤中阳性及中高阳性表达率均明显低于皮内痣组(阳性率:χ2=24.15,P<0.01;中高阳性率:χ2=19.93,P<0.01)。
2.2 Bmi-1和P16蛋白表达与黑色素瘤临床病理征的关系 为观察临床各因素对Bmi-1及p16表达的影响,本研究分析了患者的性别、年龄、肿瘤体积大小、发病部位、淋巴结转移及病理分级与Bmi-1、p16的相关性。结果显示,p16与6个临床因素都无相关性,而Bmi-1的表达与病理分级关系密切,即Ⅲ、Ⅳ级黑色素瘤Bmi-1的阳性表达率(67%)明显高于Ⅰ、Ⅱ级黑色素瘤(29%)(P<0.05),但与其他5个因素则不存在明显的相关性(表1)。
2.3 黑色素瘤中Bmi-1蛋白表达与p16蛋白表达的相关性 Spearman相关分析结果显示,黑色素瘤组织中Bmi-1与p16表达无相关性(r=0.239,P>0.05,表2)。
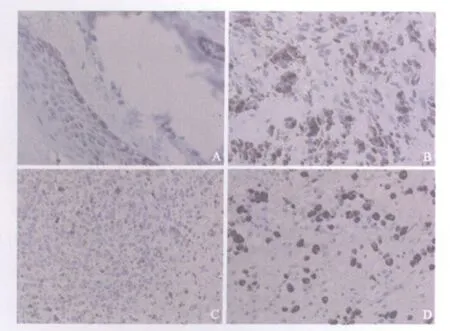
图1 黑色素瘤组织中Bmi-1、p16蛋白的表达Fig.1 Expression of Bmi-1 and p16 proteins in malignant melanoma tissues(SP×400)
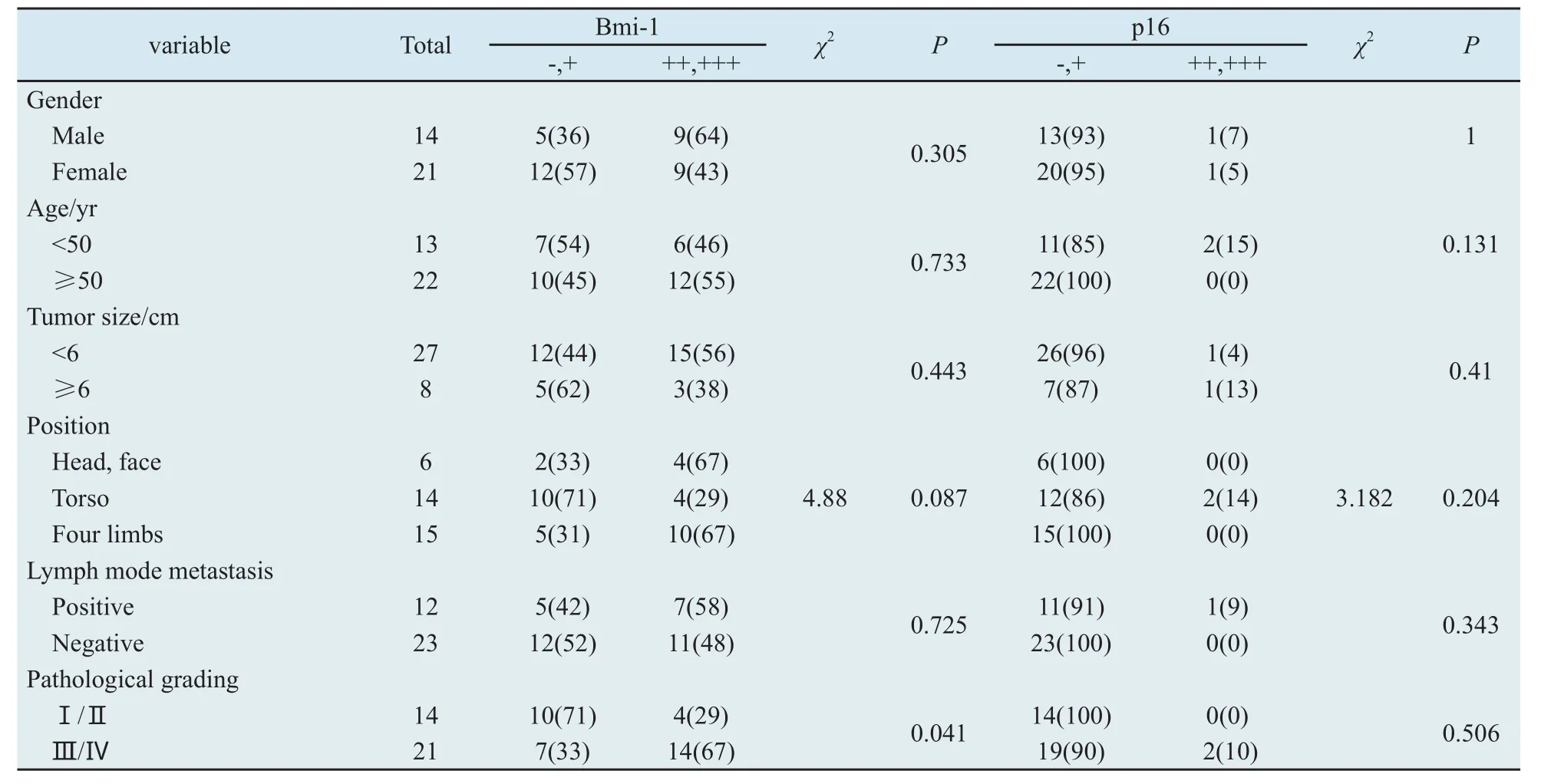
表1 黑色素瘤组织中Bmi-1、p16蛋白的表达与临床病理特征的关系Tab.1 Correlation between the clinical pathologic features and the expression of Bmi-1 and p16 protein in malignant melanoma n(%)
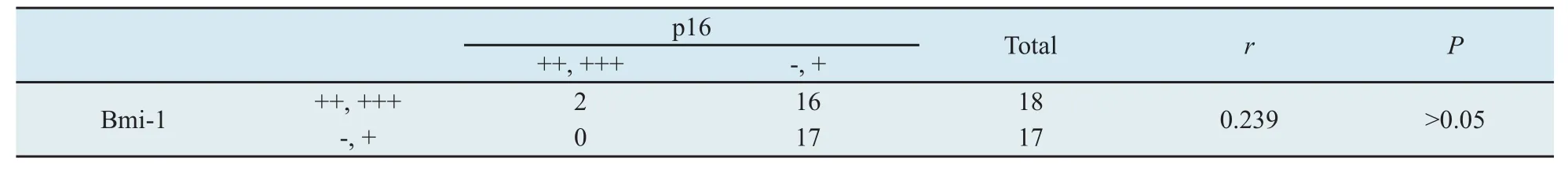
表2 黑色素瘤组织中Bmi-1蛋白与p16蛋白的相关性Tab.2 Correlation of the expression of the Bmi-1 to p16 protein in malignant melanoma tissues
3 讨 论
Bmi-1是新近发现对细胞周期有负调节作用的癌基因,属于转录抑制因子polycomb家族。现已确定人类Bmi-1基因位于第10号染色体短臂1区3带(10p13),含10个内含子和10个外显子。编码含326个氨基酸的蛋白质,其蛋白质氨基酸序列与鼠的一致性达98%。现认为Bmi-1在细胞周期的负调控作用主要是通过调控其下游p16ink4a/Arf位点而进行的,该位点通过不同的启动子分别编码p16ink4a和p19Arf蛋白。Bmi-l即通过调节该位点编码的肿瘤抑制因子p16ink4a和p19Arf的表达来控制细胞的增殖和衰老。
本研究发现Bmi-1在黑色素瘤组织中的中高阳性表达较皮内痣组明显增强(51% vs 14%,P<0.05),但中高阳性略低于Kim等[3]的研究结果,提示Bmi-1高表达与肿瘤的发生与进展关系密切。本研究结果采用卡方检验显示,Bmi-1 蛋白高表达率与患者性别、年龄、肿瘤大小、分布部位及是否淋巴转移无关(P>0.05),而与病理分级相关,病理分级中的Ⅲ/Ⅳ期的患者Bmi-1蛋白表达高于Ⅰ/Ⅱ期患者(P<0.05)。显示Bmi-1基因可能在黑色素瘤的发展、浸润转移过程中起到重要作用。提示有可能作为临床监测病情的一个重要指标。但本研究样本例数较少,临床资料不太完善亦可能对统计结果有影响,这需要本课题组在以后的研究中进一步完善。
有关Bmi-1在黑色素瘤中的表达目前存在不一致的证据。Mihic-Probst等[5]研究表明,与原发性黑色素瘤相比,转移性黑色素瘤Bmi-1表达显著增高(P=0.001);而Bachmann等[6]研究显示,黑色素瘤中Bmi-1表达较良性组织下降,且Bmi-1缺失表达与肿瘤的侵袭性有关。本研究结果倾向于支持Mihic-Probst等[5]的结论,即Bmi-1在黑色素瘤中表达增高。本研究认为Bmi-1基因介入了黑色素瘤的发病机制,其高表达很可能起着促进肿瘤增殖的作用。
Mouriaux等[7]在脉胳膜黑色素瘤中发现60%的病例p16呈阴性表达,本研究显示黑色素瘤组p16阳性表达率及中高阳性表达率较皮内痣组明显降低(阳性率:17% vs 93%,P<0.01;中高阳性率:6% vs 71%,P<0.01)。p16蛋白高表达率与患者性别、年龄、肿瘤大小、分布部位、病理分级及是否淋巴转移无关(P>0.05),提示黑色素瘤的发生可能与p16表达下降有关。近年有研究者将外源性p16基因转染p16基因缺失的肿瘤细胞,发现恢复p16的表达可抑制肿瘤细胞的生长[8],这是p16抑制肿瘤生长的直接证据,也是证明p16缺失可诱发癌症的间接证据。因此,黑色素瘤中p16表达的降低,可减弱其对CDK4的抑制作用,进而促进肿瘤的生长。本研究对Bmi-1与p16在黑色素瘤中的表达作了相关性分析,结果发现两者并不存在相关性。
综上所述,由于p16的变异或不稳定表达可存在Bmi-1与p16不相关的情况,一方面提示p16的降低并不是由Bmi-1的高表达引起的,另一方面也说明Bmi-1可通过其他机制作用于肿瘤细胞。
[1] Gray-Schopfer V, Wellbrock C, Marais R. Melanoma biology and new targeted therapy [J]. Nature, 2007, 445(7130):851-857.
[2] Breuer RH, Snijders PJ, Sutedja GT, et al. Expression of the p16(INK4a) gene product, methylation of the p16(INK4a)promoter region and expression of the polycomb-group gene BMI-1 in squamous cell lung carcinoma and premalignant endobronchial lesions [J]. Lung Cancer, 2005, 48 (3): 299-306.
[3] Kim JH, Yoon SY, Kim CN, et al. The Bmi-1 oncoprotein is over expressed in human colorectal cancer and correlates with the reduced P16INK4a/p14ARF proteins [J]. Cancer Lett,2004, 203(2): 217-224.
[4] Lukas J, Angaard L, Strauss M, et al. Oncogenic aberrations of P16 and Cyclin D1 cooperate to deregulate G1control [J].Cancer Res, 1995, 55(21): 4818-4823.
[5] Mihic-Probst D, Kuster A, Kilgus S, et al. Consistent expression of the stem cell renewal factor BMI-1 in primary and metastatic melanoma [J]. Int J Cancer, 2007, 121(8):1764-1770.
[6] Bachmann IM, Puntervoll HE, Otte AP, et al. Loss of BMI-1 expression is associated with clinical progress of malignant melanoma [J]. Mod Pathol, 2008, 21(5): 583-590.
[7] Mouriaux F, Maurage CA, Labalette P, et al. Cyclindependent kinase inhibitory protein expression in human choroidal melanoma tumors [J].Invest Ophthalmol Vis Sci,2000, 41(10): 2837-2843.
[8] Aguiar RC, Sill H, Gnldman JM, et al. The commonly deleted region at 9p21-22 in lymphoblastic leukemias spans at least 400 kb and includes p16 but not p15 or the IFN gene cluster[J]. Leukemia, 1997, 11(2): 233-238.

