表达增强型绿色荧光蛋白的小鼠骨肉瘤体外和体内荷瘤模型的建立
杨晓 胡豇
四川省医学科学院,四川省人民医院骨科,四川 成都 610072
小鼠骨肉瘤细胞株S180是国内外使用较多的一种肿瘤细胞株,可在清洁级小鼠或裸鼠的皮下和腹水成瘤,而在体外培养均为半贴壁细胞[1]。本研究采用电穿孔转染法,将增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)导入S180细胞,同时在体内外对标记的S180(EGFP-S180)细胞的生物学行为进行初步研究。
1 材料和方法
1.1 主要材料 质粒表达载体(pEGFP-N1)购自Clontech公司,宿主菌(DH5а)由本实验室保种,质粒提取纯化试剂盒购自天为时代试剂公司。RPMI1640培养液干粉以及胎牛血清(FBS)为美国Gibco BRL公司产品。G418和牛血清白蛋白(BSA)均购自美国Sigma公司,鼠抗鼠单克隆抗体(一抗),荧光(Cy3)标记羊抗小鼠IgG(二抗)和Sp900免疫组织化学试剂盒均购自北京中山生物技术公司。健康成年清洁级NIH小鼠,6~8周龄,25~30 g,雌雄不限,购自四川省医学科学院动物中心。
1.2 质粒扩增及纯化 取菌种大肠埃希菌DH5а 30 mL转接种于3 mL LB培养液中培养过夜,采用CaCl2(0.1 mmol/L)制备感受态菌,转化质粒,12~16 h后则可见菌落产生,挑取转化平皿上的单菌落接种于含2 mL 200 mg/mL的卡那霉素的LB培养液中,37 ℃培养过夜(摇床速度200 r/min),抽提细菌质粒并保存备用。取2 mL用紫外分光光度计测其浓度及纯度,1.5%琼脂糖电泳检测质粒构型是否与原质粒一致。
1.3 细胞培养、脂质体转染及FCM测定转染率 S180细胞系用含10% FBS、105U/L的青霉素、100 mg/L链霉素、10 mmol/L HEPES及2 mmol/L L-谷氨酰胺的RPMI1640完全培养液培养,常规传代,将1×108个细胞制备成1 mL的细胞悬液,加入质粒载体(2 mg)充分混匀后室温置放15 min,然后转入电转瓶,用细胞电融合仪(Electro Square Porator ECM 830,BTX)电转染(电压750 V,脉宽200 ms),之后补充适量新鲜培养液置入细胞培养箱进行培养,48 h后观察转染阳性率,并洗涤、离心(800×g)和换液,同时取细胞制备成1×106个/mL的细胞悬液,用流式细胞仪(FACSCALIBAR Becton Dickin Son Cormpony,488 nm激发光波长,510发射光波长)测定转染率。
1.4 筛选稳定高表达的细胞株及细胞形态观察低速离心(800 r/min×3 min)收获上述被转染EGFP阳性细胞,加入G418(800 mg/mL)的选择性培养液进行选择培养2周,得到EGFPS180阳性细胞克隆,倒置荧光显微镜下挑取发强荧光的细胞克隆后于96孔板进行克隆,用含G418(200 mg/mL)的选择性培养液维持培养4周,得到接近100%的EGFP-S180的细胞株,持续进行培养、传代。
1.5 EGFP-S180和S180细胞中c-Myc的表达 采用离心涂片(1 000 ×g离心3 min)的方法分别将EGFP-S180和S180细胞制备成细胞涂片,95%乙醇固定细胞,按SP-900操作方法加入c-Myc(1∶100),4 ℃反应过夜,加入Cy3荧光标记的二抗(用1% BSA 1∶60稀释),室温温育1 h,在激光共聚焦显微镜下及时观察,在不同的视野中选取100个肿瘤细胞,利用激光共聚焦显微镜自带软件进行荧光强度的分析。
1.6 EGFP-S180和S180皮下和腹腔移植荷瘤时间与生存时间的观察 将EGFP-S180和S180细胞用0.9%氯化钠溶液充分洗涤后制备成1×108/mL的细胞悬液,分别取0.1 mL接种至KM小鼠右前腋皮下和腹腔,观察皮下荷瘤时间及腹腔成瘤时间和小鼠的生存时间,随后将癌性腹水涂片及瘤组织切片后进行荧光观察。
1.7 统计处理 对计量资料行方差分析,对计数资料行χ2检验,用SPSS 12.0统计软件包完成。以P<0.05为差异有显著性。
2 结 果
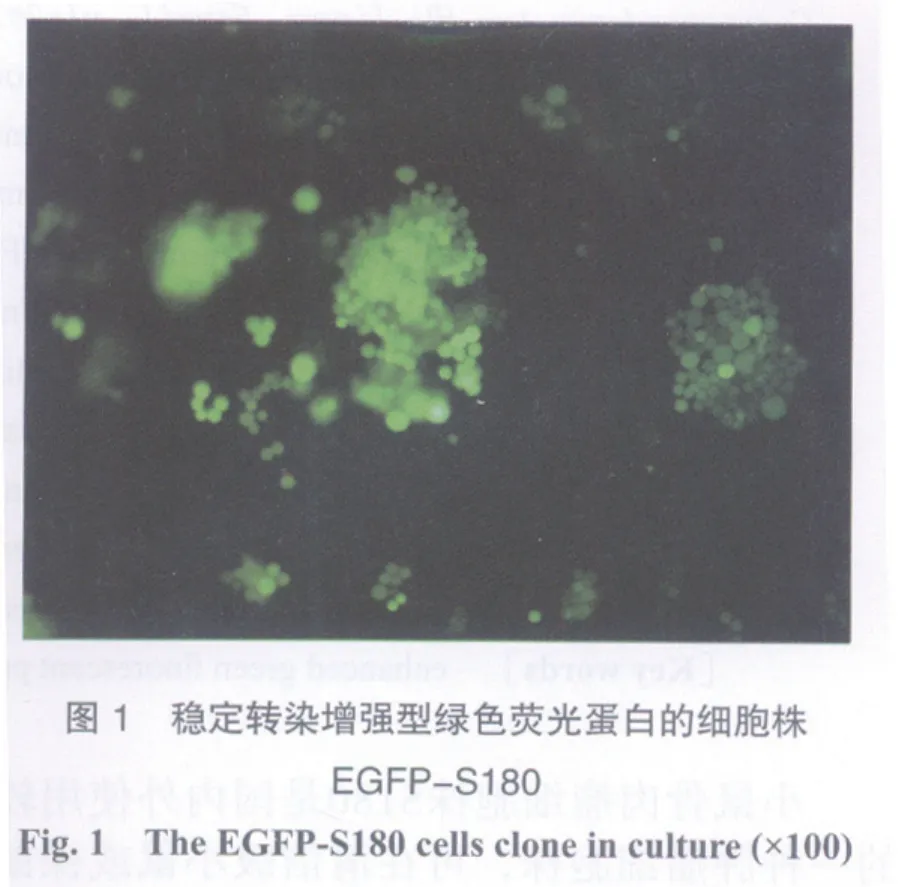
2.1 稳定高表达肿瘤细胞株的克隆 携带有neomycin抗性基因的质粒载体经扩增和纯化后可以有效地转染小鼠S180细胞株,采用细胞流式法(flow cytometry,FCM)测定48 h时的转染率为57.3%,用G418筛选获得稳定表达EGFP的EGFP-S180细胞,发出亮绿色的GFP荧光(图1)。
2.2 EGFP-S180和S180细胞中c-Myc的表达 在激光共聚焦显微镜下观察EGFP-S180和S180细胞中c-Myc的表达(呈红色荧光),其荧光强度分别为55.04±0.21和52.17±0.23,其表达无显著性差异(P>0.05),EGFP-S180细胞自发绿色荧光与c-Myc红色荧光表达合成如图2所示。
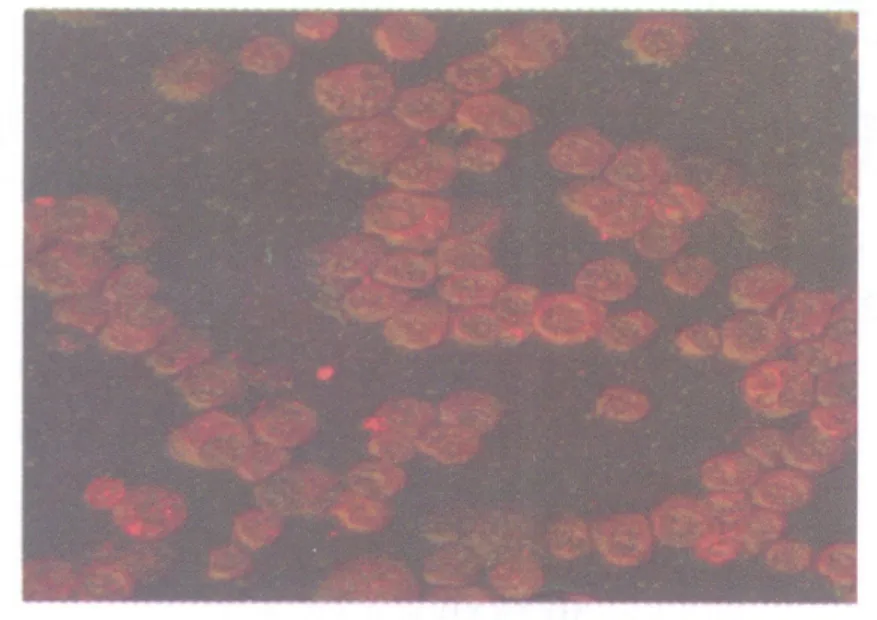
图2 EGFP-S180细胞体外自发绿色荧光与c-Myc红色荧光表达合成图Fig.2 The combination of the EGFP-S180 cells and c-Myc with Cy3 staining in vitro
2.3 EGFP-S180和S180皮下和腹腔移植荷瘤时间与生存时间的观察 EGFP-S180细胞能在小鼠皮下和腹腔中形成肿瘤,并且EGFP-S180细胞和S180细胞在皮下的成瘤时间和在腹腔中成瘤的时间相比,差异无统计学意义(P>0.05);与S180细胞组小鼠比较,EGFP-S180细胞组腹腔荷瘤小鼠的的生存时间没有明显改变(P>0.05,表1、2)。实体瘤组织切片与癌性腹水涂片的检测结果均显示有亮绿色荧光表达(图3、4)。
表1 EGFP-S180和S180皮下荷瘤时间Tab.1 Time of cancer-bearing subcutaneous model of EGFP-S180 and S180 cells(n=25, )

表1 EGFP-S180和S180皮下荷瘤时间Tab.1 Time of cancer-bearing subcutaneous model of EGFP-S180 and S180 cells(n=25, )
表2 EGFP-S180和S180腹腔荷瘤时间及其生存时间Tab.2 Time of cancer-bearing and survival time abdominal cavity model of EGFP-S180 and S180 cells(n=25, )
表2 EGFP-S180和S180腹腔荷瘤时间及其生存时间Tab.2 Time of cancer-bearing and survival time abdominal cavity model of EGFP-S180 and S180 cells(n=25, )
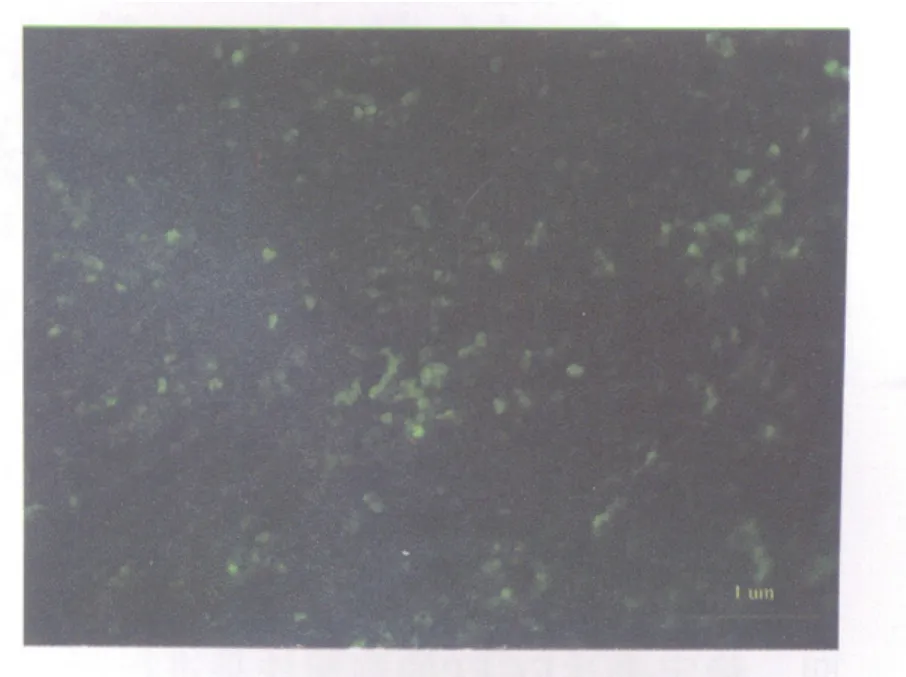
图3 EGFP-S180皮下瘤组织冰冻切片Fig.3 Subcutaneous tumor of EGFP-S180 cells(×200)
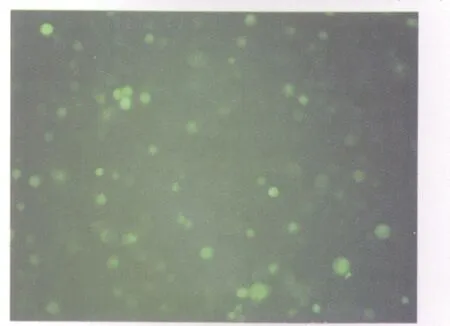
图4 EGFP-S180腹水瘤涂片Fig.4 Carcinomatous ascites of EGFP-S180 cells(×100)
3 讨 论
小鼠骨肉瘤S180是国内外使用较多的肿瘤细胞株,可在清洁级小鼠或裸鼠的皮下和腹腔接种成瘤,在体外培养为半贴壁培养细胞。c-Myc基因是Myc基因家族的重要成员之一,c-Myc基因既是一种可易位基因,又是一种多种物质调节的可调节基因,同时也是一种可使细胞无限增殖,获永生化功能,促进细胞分裂的基因,与多种肿瘤发生发展有关。c-Myc在S180 细胞的表达常常被认为是鉴定其肿瘤特征及细胞株稳定性的指标之一[2]。本实验通过激光共聚焦显微镜检测了转染前后S180 细胞中的细胞质内c-Myc的表达,发现转染前后其表达量无显著变化,表明了S180 细胞的增殖生物学行为及c-Myc基因表达没有因为EGFP导入细胞而改变,在细胞和分子水平上证实了转染后的细胞无明显的生物学行为改变。
EGFP作为一种生物源性的荧光标记,在GFP的基础上进行了改良,具有高效、稳定、无毒、易于检测等特性,已广泛应用于各种细胞、蛋白质、细胞器的标记和特定基因表达的研究,尤其是EGFP也不影响活细胞正常功能,可以直接在活细胞状态下进行分析[3]。目前,由于荧光成像技术的发展,将这种标记用于活体实验的研究,尤其在肿瘤侵袭、转移及血管生成方面开始逐渐增多[4]。建立长期、稳定表达EGFP的细胞株是进行荧光标记细胞研究的基本前提。普通荧光显微镜就可观察到EGFP荧光;同时,荧光成像技术发展极为迅速,活体荧光成像系统(whole body GFP imaging system)也开始应用,它采用数字化超高灵敏度的CCD与软件进行定量分析,能够在动物活体上方便地实现对发光组织的特异性、敏感度的实时性观测[5]。
本实验利用电转染法,将编码EGFP的真核表达质粒直接转入哺乳动物肿瘤细胞小鼠骨肉瘤S180中,建立稳定表达EGFP的细胞株系,通过直观的小鼠成瘤时间及腹腔荷瘤鼠的生存时间与蛋白水平检测c-Myc的表达,表明EGFP-S180细胞的细胞生物学行为并无改变,体内的皮下和腹腔成瘤能力均未发生改变。因此,期望利用新近的荧光成像技术和高灵敏度的CCD对EGFP标记的S180肿瘤细胞的生长、侵袭提供体内、外的一种简单、方便的实验手段。但是,在将成功转染的EGFP-S180细胞进行小鼠腹腔传代后需定期进行该细胞株的生物学行为检测,如生长曲线,癌基因表达等,以保证肿瘤细胞的生物行为与原始细胞株接近,能更好地反映细胞的生物学行为及用于相应的研究。
[1] Yu S, Song AQ, Lu YD, et al. Effects of low-dose radiation on tumor growth, erythrocyte immune function and SOD activity in tumor-bearing mice[J]. Chin Med J (Engl), 2004, 117(7):1036-1039.
[2] Manna S, Banerjee S, Mukherjee S, et al. Epigallocatechin gallate induced apoptosis in sarcoma 180 cells in vivo:mediated by p53 pathway and inhibition in U1B, U4-U6 UsnRNAs expression[J]. Apoptosis, 2006, 11(12): 2267-2276.
[3] Nguyen HS, Khosrotehrani K, Oster M, et al. Early phase of maternal skin carcinogenesis recruits long-term engrafted fetal cells[J]. Int J Cancer, 2008, 123(11): 2512-2517.
[4] Wessels JT, Busse AC, Mahrt J, et al. In vivo imaging in experimental preclinical tumor research—A review[J].Cytometry, 2007, 71(8): 542-549.
[5] Hoffman RM. The multiple uses of fluorescent proteins to visualize cancer in vivo[J]. Nat Rev Cancer, 2005, 5(10):796-806.

