甲状腺球蛋白基因多态性对甲状腺非髓样癌易感性的影响
李建国 柳晓义 王宇 胡建霞 曹明智
青岛大学医学院附属医院乳腺外科,山东 青岛,266003
甲状腺非髓样癌(non-medullary thyroid cancer,NMTC)起源于甲状腺上皮细胞,约占所有甲状腺癌的90%。主要包括乳头状癌和滤泡状癌,未分化癌和Hurthle细胞癌较少见。20%~25%的甲状腺髓样癌病例是家族性的,而NMTC家族遗传因素很少。
甲状腺球蛋白(thyroglobulin,Tg) 和促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR)基因在非恶性甲状腺疾病中的作用已有报道,研究发现Tg基因的改变与甲状腺肿相关[1-4],甲状腺肿在NMTC家系中出现频率较高,且是NMTC的已知危险因素[5]。Tg基因中A7589G序列改变是Q2511R多态性的基础[6]。TSHR是一种G蛋白偶联受体,结合促甲状腺激素后发挥促进滤泡细胞生长和分泌激素的作用。已有研究发现TSHR基因多态性改变与甲状腺增生和甲状腺肿瘤有关[7-8]。本研究通过对中国北方汉族人群Tg或TSHR基因多态性进行检测,来探讨甲状腺非髓样癌的易感基因。
1 资料和方法
1.1 资料 2004年6月—2008年6月期间,本院共收集NMTC住院患者176例(设为NMTC组),其中男性82例,女性94例,平均年龄(50.7±5.64)岁,所有患者均经病理诊断证实为NMTC。具体分为乳头状、滤泡状、Hurtle细胞或混合乳头状和滤泡状细胞癌。同时设置对照组184例,其中男性84例,女性100例,平均年龄(49.5±4.65)岁,均为在本院健康查体中心体检并经筛选的健康人群。
1.2 方法
1.2.1 外周血采集 NMTC组患者均抽取空腹外周血5 mL(术前、未化疗),对照组同样抽取空腹外周血5 mL,置于预先加入1 mL ACD抗凝剂的圆底离心管中,颠倒混匀,编号记录后放入-80 ℃低温冰箱中保存,3个月内提取DNA。
1.2.2 TSHR C253A多态性检测 ⑴基因提取:赛百盛基因组DNA提取试剂盒提取外周血DNA,溶解于pH 8.0的TE缓冲液中,-80 ℃低温冰箱中保存。⑵PCR扩增:根据GenBank中的基因序列用DNAstar软件设计上下游引物,上游引物5’-GCGATTTCGGAGGATGGAGAAATAGC-3’,下游引物5’-CCGGGTACTCACAGAGTCTGCGACCTG-3’[9],引物由上海生工生物工程技术服务有限公司合成,PCR产物长度为227 bp。反应体系25 μL:去离子水13 μL,DNA模板(150~200 ng)2 μL,10×Buffer 2.5 μL,10×dNTP 2 μL,25 mmol/L MgCl21.5 μL,上、下游引物(10 μmol/L)各1.5 μL,Taq酶 1 U。循环参数:95 ℃预变性5 min;95 ℃变性60 s,57 ℃退火60 s,72 ℃延伸60 s,共35个循环;之后72 ℃终止延伸5 min。⑶酶切鉴定反应体系:去离子水9 μL,10×Buffer 2 μL,PCR产物7 μL,Tth111Ⅰ 2 μL;37 ℃水浴中酶切过夜。⑷酶切结果的分析:限制性酶切产物经2%琼脂糖凝胶电泳(50 v,40 min)分离后观察结果。结果分析:TSHR C253A多态性检测,若为纯合变异,PCR扩增片断经Tth111Ⅰ酶切后(CCC/ACC),可产生201和16 bp 2个片断;当此位点为杂合变异型时,酶切后得到227、201和16 bp 3个片断。
1.2.3 Tg A7589G 多态性检测 ⑴基因提取:赛百盛基因组DNA提取试剂盒提取外周血DNA,溶解于pH 8.0的TE缓冲液中,-80 ℃低温冰箱中保存。⑵PCR扩增:根据GenBank中的基因序列用DNAstar软件设计上下游引物,上游引物5’-AACTCAGACAGTCTGGCTTCC-3’,下游引物 5’-CGACGCGGGCATCTGAGTCCT-3’,引物由上海生工生物工程技术服务有限公司合成。PCR产物长度为240 bp。反应体系25 μL:去离子水13 μL,DNA模板(150~200 ng)2 μL,10×Buffer 2.5 μL,10×dNTP 2 μL,25 mmol/L MgCl21.5 μL,上下游引物(10 μmol/L)各1.5 μL,Taq酶 1 U。循环参数:95 ℃预变性5 min,95 ℃变性60 s、58 ℃退火60 s、72 ℃延伸60 s,共35个循环,之后72 ℃终延伸5 min。⑶酶切鉴定反应体系:去离子水9 μL,10×Buffer 2 μL,PCR产物7 μL,TaqⅠ 2 μL。37 ℃水浴中酶切过夜。⑷酶切结果的分析:限制性酶切产物经2%琼脂糖凝胶电泳(60 v,30 min)分离后观察结果。结果分析:Tg A7589G多态性,若是纯合变异,PCR扩增片断经TaqⅠ酶切后,可产生186和54 bp 2个片断;当此位点为杂合变异型时,酶切后得到240、186和54 bp 3个片断。
1.3 统计处理 运用Hardy-Weinberg平衡法则检测样本的群体代表性,采用SPSS 11.0统计处理软件将实验数据进行χ2检验,并计算相对危险度和95%可信区间。以P<0.05作为差异有统计学意义。
2 结 果
2.1 TSHR C253A基因型与等位基因的频率分布 由于C/A多态性的纯合基因变异数量非常少,在数据统计时,本研究将杂合变异和纯合变异相结合。NMTC组CC基因型的频率为89.8%(158/176),CA+AA基因型的频率为10.2%(18/176), 对照组CC基因型的频率为87.5%(161/184),CA+AA基因型的频率为12.5%(23/184)。NMTC组CA+AA基因型频率与对照组没有明显差异(χ2=0.46,P=0.497)。NMTC组A等位基因频率与对照组相比,差异无统计学意义(χ2=0.941,P=0.332)。TSHR C253A PCR产物及限制性酶切产物电泳结果见图1。
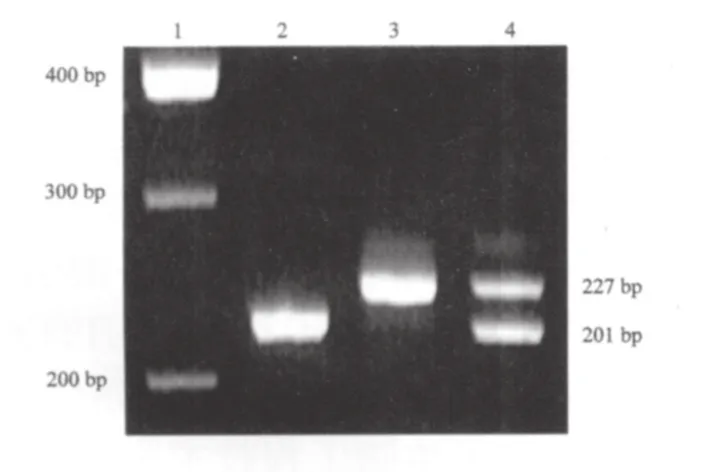
图1 TSHR C253A PCR产物及酶切产物电泳图Fig.1 Result of electrophoresis of the products of TSHR C253A in an agarose gel
2.2 Tg A7589G基因型与等位基因的频率分布 NMTC组AA基因型频率为17%(30/176),AG基因型频率为53.4%(94/176),GG基因型的频率为29.6%(52/176)。对照组AA基因型频率为26.1%(48/184),AG基因型频率为54.9%(101/184),GG基因型的频率为19%(35/184)。NMTC组AG+GG基因型与对照组相比,差异具有统计学意义(χ2=4.333,P=0.037)。NMTC组A等位基因频率为43.75%(154/352),G等位基因频率为56.25%(198/352)。对照组A等位基因频率为53.5%(197/368),G等位基因频率为46.5%(171/368)。NMTC组G等位基因频率明显高于对照组(χ2=6.891,P=0.009)。2组复合数据的分析:与纯合性相关的ORs为1.55(95%CI: 1.1~2.3)。Tg A7589G PCR产物及限制性酶切产物电泳结果见图2。
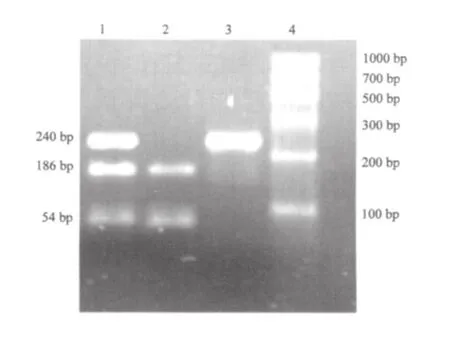
图2 Tg A7589G PCR产物及酶切产物电泳图Fig.2 Result of electrophoresis of the products of Tg A7589G in an agarose gel
3 讨 论
TSHR是一种G蛋白偶联受体,与促甲状腺激素(thyroid stimulating hormone,TSH)结合发挥作用,是滤泡细胞生长和发挥功能的主要刺激因子。已经在家系研究中发现,TSHR的基因突变与甲状腺功能亢进和甲状腺增生症存在相关性[10]。TSHR C253A多态性导致了编码的氨基酸P52T的改变,此段氨基酸位于TSHR的胞外区。变异的蛋白质在52位置上缺少一个β旋转,这可能改变受体的三维结构,导致TSH作用的异常。
研究发现TSHR基因的变异与一些良性甲状腺疾病的高风险性相关。良性甲状腺疾病例如非毒性结节性甲状腺肿(multinodular goiter,MNG)是甲状腺非髓样癌的强烈危险因子,TSHR的突变可能直接与肿瘤形成有关[11]。这些突变通常引起受体信号的激活,可导致细胞的无限制生长。因此笔者认为该基因多态性可能与NMTC的高风险性相关。本研究中TSHR C253A的A等位基因在NMTC组和对照组中的分布没有明显差异(P<0.05),也可能与样本量小及抽样误差有关。
Tg是甲状腺中表达量最多的蛋白质,功能是甲状腺激素合成的支架及甲状腺激素和碘的储存蛋白。甲状腺肿在NMTC家系中较常见,且是人群中NMTC的危险因素[12]。
已有报道称循环中Tg的水平是NMTC发生的预兆,这表明两者之间可能存在一种因果关系[13]。本研究中Tg A7589G的G等位基因频率在NMTC患者中分布较多,NMTC组和对照组的等位基因频率差异有统计学意义。Tg A7589G可能通过一种功能性变异的线性失衡来调整发病危险度,多态性导致谷氨酸-精氨酸的转变,这个变异定位于甲状腺球蛋白的乙酰胆碱酯酶同源区。这个区的功能还不清楚,有证据表明这个区的突变与胎儿甲状腺肿有关[14]。而且,小鼠模型上这个区的突变导致了明显结构异常的Tg分子在内质网的蓄积,最终导致了先天性甲状腺肿和甲状腺机能亢进[15-16]。
研究数据表明Tg的遗传变异可能对NMTC危险度有直接作用或通过调整甲状腺肿的易感性来调整危险度。尽管NMTC危险度与G等位基因的相关性很微弱,但普通人群中R等位基因的高频率意味着其很有可能对NMTC肿瘤的发生率有着重要的影响。高加索人群中该等位基因的频率是50%,杂合性和纯合性变异存在于近1/3的患者。本研究中甲状腺球蛋白基因A7589G在NMTC组和对照组存在多态性,G等位基因可能为中国北方甲状腺非髓样癌发病的易感基因。
[1] Caputo M, Rivolta CM, Esperante SA, et al.Congenital hypothyroidism with goitre caused by new mutations in the thyroglobulin gene[J].Clin Endocrinol, 2007, 67(3): 351-357.
[2] Mariela C, Carina MR, Viviana JG, et al.Recurrence of the p.R277X/p.R1511X compound heterozygous mutation in the thyroglobulin gene in unrelated families with congenital goiter and hypothyroidism: haplotype analysis using intragenic thyroglobulin polymorphisms[J].J Endocrinol, 2007,195(1): 167-177.
[3] Ali SA, Essa YB, Zou MJ, et al.Clinical case seminar:metastatic follicular thyroid carcinoma arising from congenital goiter as a result of a novel splice donor site mutation in the thyroglobulin gene[J].J Clin Endocrinol Metab, 2006,91(3): 740-746.
[4] Hishinuma A, Takamatsu J, Ohyama Y, et al.Two novel
cysteine substitutions (C1263R and C1995S) of thyroglobulin cause a defect in intracellular transport of thyroglobulin in patients with congenital goiter and the variant type of adenomatous goiter[J].J Clin Endocrinol Metab, 1999,84(4): 1438-1444.
[5] Franceschi S, Preston-Martin S, Dal Maso L, et al.A pooled analysis of case-control studies of thyroid cancer.Ⅳ.benign thyroid diseases[J].Cancer Causes Control, 1999,10(6):583-595.
[6] Li HS, Carayanniotis G.Iodination of tyrosyls in thyroglobulin generates noantigenic determinants that cause thyroiditis[J].J Immunol, 2006, 176: 4479-4483.
[7] Smith JA, Fan CY, Zou CL, et al.Methylation status of genes in papillary thyroid carcinoma[J].Arch Otolaryngol Head Neck Surg, 2007, 133(10): 1006-1011.
[8] Gozu HI, Bircan R, Krohn K, et al.Similar prevalence of somatic TSH receptor and Gsalpha mutations in toxic thyroid nodules in geographical regions with different iodine supply in Turkey[J].Eur J Endocrinol, 2006, 155(4): 535-545.
[9] Peeters RP, Toor HV, Klootwijk W, et al.Polymorphisms in thyroid hormone pathway genes are associated with plasma TSH and iodothyronine levels in healthy subjects[J].J Clin Endocrinol Metab, 2003,88(6): 2880-2888.
[10] Liu Z, Sun Y, Dong Q, et al.A novel TSHR gene mutation(lle691Phe) in a Chinese family causing autosomal dominant non-autoimmune hyperthyroidism[J].J Hum Genet, 2008,53(5): 475-478.
[11] Bakhsh A, Kirov G, Gregory JW, et al.A new form of familial multi-nodular goitre with progression to differentiated thyroid cancer[J].Endocr Relat Cancer, 2006, 13(2): 475-483.
[12] Hemminki K, Eng C, Chen B.Familial risks for nonmedullary thyroid cancer[J].J Clin Endocrinol Metab, 2005, 90(10):5747-5753.
[13] Yeung MJ, Serpell JW.Management of the solitary thyroid nodule[J].Oncologist, 2008, 13(2): 105-112.
[14] Caron P, Moya CM, Malet D, et al.Compound heterozygous mutations in the thyroglobulin gene (1143delC and 6725GA[R2223H]) resulting in fetal goitrous hypothyroidism[J].J Clin Endocrinol Metab, 2003, 88: 3546-3553.
[15] Johnson KR, Marden CC, Ward-Bailey P, et al.Congenital hypothyroidism, dwarfism, and hearing impairment caused by a missense mutation in the mouse dual oxidase 2 gene, duox2[J].Mol Endocrinol, 2007, 21(7): 1593-1602.
[16] Ng HP, Banga JP, Kung AWC.Development of a murine model of autoimmune thyroiditis induced with homologous mouse thyroid peroxidase[J].Endocrinology, 2004, 145(2):809.

