高频小探头内镜超声在胃癌术前T分期中的应用价值
张召珍 贺益萍 沈俊 许玲辉 盛伟琪 师英强
复旦大学附属肿瘤医院内镜科,*放射科,△病理科,▲腹部外科;复旦大学上海医学院肿瘤学系,上海 200032
随着近几年医学诊断技术的发展,越来越多的胃癌被发现。早期胃癌行内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)已广泛地被临床医生与患者所接受,早期胃癌的诊断准确率迫切需要提高。内镜超声(endoscopic ultrasound,EU)及多层螺旋CT(multislice spiral CT,MSCT)是目前被临床上广泛接受的胃癌术前分期的检查方法,高频率(20 MHz,12 MHz)小探头内镜超声(endoscopic ultrasound mini probe,UMP)能更清晰地显示胃癌局部浸润的深度与范围,特别是对胃壁黏膜层,黏膜下层的显示尤为清晰。本研究旨在讨论UMP在胃癌,尤其是早期胃癌术前T分期中的价值。
1 资料和方法
1.1 临床资料 收集2008年10月—2009年4月期间在复旦大学附属肿瘤医院经UMP及MSCT等诊断为胃癌的患者共63例,其中男性46例,女性17例,年龄33~77岁,平均年龄60.19岁。所有患者于手术前2周内进行高频UMP检查及MSCT检查,评估病灶部位浸润深度和范围,并对检查结果进行评定。经检查发现病灶已经广泛转移或因其他原因不能手术的患者不计入统计。
1.2 方法
1.2.1 仪器 采用日本Olympus公司GF-UM200内镜超声诊断仪及高频小探头(型号:UMDP20-25R、UM-DP12-25R)行内镜超声检查,采用Siemens公司的64层螺旋CT机进行MSCT检查。
1.2.2 手术方法 61例患者均接受胃癌根治术,2例不能行胃癌根治术的患者行肿瘤姑息性切除术。
1.2.3 UMP检查 患者检查前空腹10 h,术前15~30 min注射镇静药安定(valium),检查前常规利多卡因(lidocaine)进行口咽部麻醉,患者选择好适当体位后,插入具有2.8 mm以上的活检孔道的直视内镜于胃内,寻找到病灶,吸尽胃内空气,在活检孔道上连接附属的T形管注入脱气水,当病变部位完全浸在水中时,再插入探头超声,通过内镜确定超声探头的位置,尽量使探头发出的声束与病变界面垂直,此时才能清晰显示病变的结构和精确测量其大小。小探头超声12 MHz的焦点距离为25 mm,20 MHz的焦点距离为22 mm。
1.2.4 MSCT检查 患者保持空腹约10 h,扫描前先饮水800~1 000 mL并于扫描前10 min肌注654-Ⅱ。采用仰卧位,由头至足先扫描一幅定相位(topogram),然后根据病变情况确定扫描范围(从剑突下2 cm至脐下2 cm)。扫描参数:电压120 kV,电流350 As,层厚0.6~0.75 mm,多平面重建间隔最薄0.5 mm。应用高压注射器注射造影剂安射力100 mL,注射速率3 mL/s。三期增强分别于注射后20~25 s(动脉期),60~65 s(门脉期)及3 min(延迟期)进行扫描。增强扫描完成后将多平面重建(multiplanar reconstruction,MPR)。然后对64层CT三期增强图像、MPR图像进行详细分析,内容包括病变部位、范围及胃壁增厚程度,肿块在腔内的位置、大小及溃疡是否存在,邻近器官受侵润情况,胃周脂肪间隙状况等。
1.2.5 诊断标准 UMP胃癌分期采用TNM分期标准(UICC第4版)。正常胃壁在UMP图像上呈5层结构,肿瘤则表现为破坏的低回声肿块与正常5层结构的增厚,UMP则根据破坏的层次来判断胃癌的浸润深度。在MSCT图像上正常胃壁可呈1~3层结构[1-3],胃癌表现为胃壁增厚和(或)胃壁异常增强。患者术后标本行常规石蜡切片HE染色,光学显微镜下进行病理T分期诊断。
1.2.6 统计处理 以手术后组织病理作为金标准,统计使用Fisher精确检验和Kruskal-Wallis检验进行分析,采用SPSS 11.0 统计软件计算,以P<0.05为差异有统计学意义。
2 结 果
2.1 术后诊断结果 63例病例均行外科手术,1例患者术前UMP诊断胃癌T1期,MSCT检查胃部无阳性发现,术后病理为黏膜内癌而未计入统计(图1)。计入统计的62例胃癌患者中,胃窦癌18例,胃体癌7例,胃底贲门癌9例,胃角癌4例,胃窦体癌12例,胃底体癌11例,全胃癌1例。术后病理大体分型早期胃癌共9例,Ⅱa型2例,6例为Ⅱa+Ⅱc型,1例为Ⅱb型。进展期胃癌53例,其中肿块型15例,溃疡型9例,溃疡浸润型28例,浸润型1例。术后病理结果中分化腺癌12例,低分化腺癌43例,印戒细胞癌5例,黏液腺癌2例。
2.2 UMP对胃癌术前T分期诊断与病理诊断结果比较 62例胃癌患者病理T分期T1~T4期分别为9、24、27和2例。UMP对T分期判断准确率为82.26%(51/62),其中T1~T4期的准确率分别为100.00%(9/9)、70.83%(17/24)、88.89%(24/27)和50.00%(1/2)。早期胃癌的诊断准确率为100.00%,进展期胃癌的诊断准确率79.25%(表1,图2~5)。
2.3 MSCT对胃癌术前T分期诊断与病理诊断结果比较 MSCT对T分期判断总准确率为88.71%(55/62),其中T1期、T2期、T3期和T4期的准确率分别为88.89%(8/9)、83.33%(20/24)、92.59%(25/27)和100.00%(2/2)。早期胃癌的诊断准确率为88.89%,进展期胃癌的诊断准确率为88.68%(表2,图2~5)。
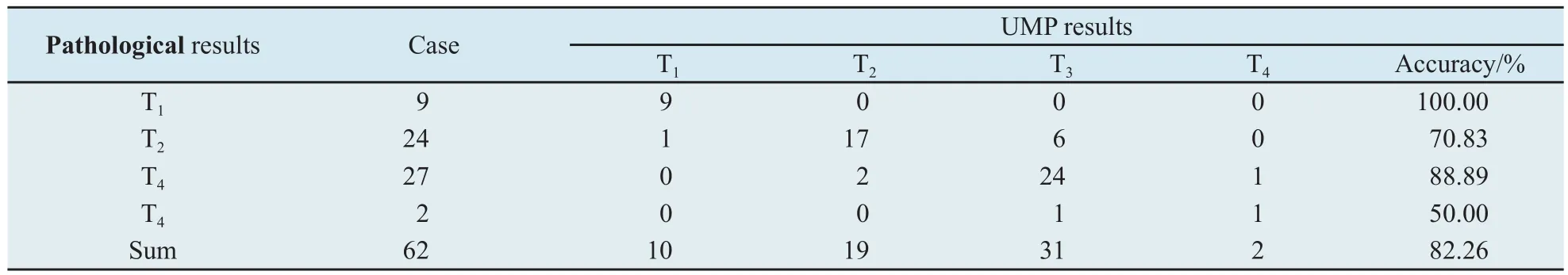
表1 UMP和病理对胃癌T分期的结果对照Tab.1 The UMP and pathological results for T-staging of gastric cancers(n)
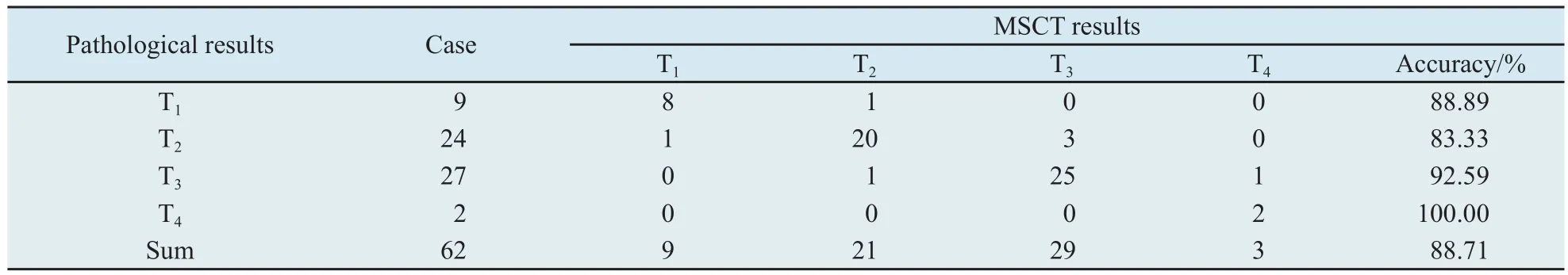
表2 MSCT和病理对胃癌T分期的结果对照Tab.2 The MSCT and pathological results for T-staging of gastric cancers(n)
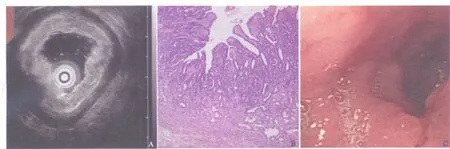
图1 不同诊断方式对Tis期胃癌诊断结果Fig.1 The diagnosis results of Tis-staging by different diagnostic method
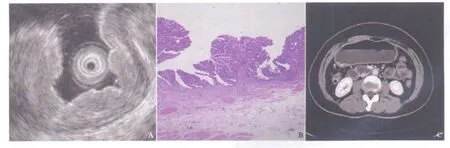
图2 不同诊断方式对T1期胃癌诊断结果Fig.2 The diagnosis results of T1-staging by different diagnostic method
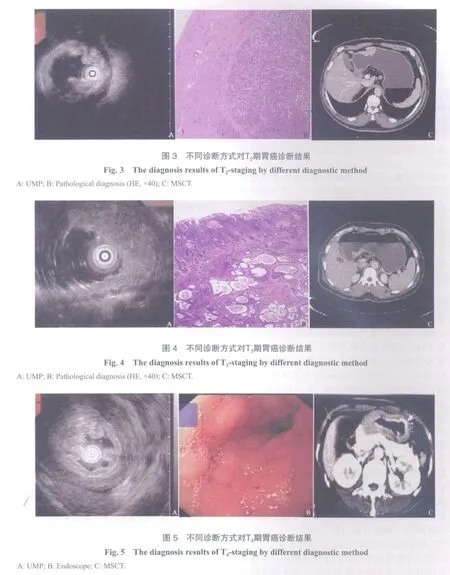
2.4 UMP及MSCT对胃癌术前T分期结果的比较 UMP与病理分期一致的有51例,MSCT与病理分期一致有55例,UMP在T2、T3期有7例存在分期过度,占11.29%(7/62),MSCT在T1、T2和T3出现5例分期过度,占8.06%(5/62),UMP在T2、T3和T4有4例存在分期不足,占6.45%(4/62),MSCT在T2、T3有2例存在分期不足,占3.23%(2/62)。UMP与MSCT这2种检查在分期准确率方面差异无统计学意义(P>0.05)。
3 讨 论
目前外科手术治疗仍是根治胃癌最有效的方法,但对于早期胃癌、肿瘤仅限于黏膜层时,局部可以施行EMR。特别是近几年来ESD的迅速发展,扩大了内镜下手术的适应证,对分化良好的黏膜下微浸润癌,如肿瘤直径不超过3 cm,无淋巴结转移,则均可实施内镜下手术。由于其手术创伤小,并发症少,操作相对简单的特点,大大推动了临床上的普及与应用[4]。同时对于ⅢB/Ⅳ期进展期胃癌单纯手术往往难以根治,需考虑先行新辅助化疗,待肿瘤体积或转移灶得以适当控制后再考虑手术,以增加手术切除率[5-6]。无论何期的胃癌,正确的术前分期对估计病情、选择合理的手术方案、评价预后具有重要的指导意义,特别是随着经内镜、腹腔镜治疗及术前辅助化疗等新技术的开展,正确的术前分期显得尤为重要。
本文研究选用UMP就是利用小探头超声能更清晰的显示胃壁5层结构,在评估胃癌特别是早期胃癌在胃壁侵犯程度上有独特的优势。在晚期胃癌伴有贲门或幽门的梗阻时,也只有小探头超声进入狭窄腔内进行探查。本组研究高频率小探头超声对胃癌的总准确率为82.25%,与Puli等[7]的meta分析结果相仿。但各分期准确率T1为100.00%,T2为70.83%,T3为88.89%,T4为50.00%与文献资料等有一定差异,区别在于T1的准确率非常高,原因是高频小探头超声的频率高(20 MHz,12 MHz),对显示胃壁的黏膜层,黏膜肌层,黏膜下层效果最佳。但有一例未计入统计的黏膜内癌,内镜超声见黏膜层不均匀低回声,黏膜下层局部变窄因而诊断为T1,而术后病理却为黏膜内癌。原因可能是癌灶是一个Ⅱa+Ⅱc的病灶,由于病灶周围有炎性水肿,中央凹陷,导致黏膜下层回声降低,肿瘤与固有肌层接近[8]。本研究中T4期胃癌的准确率明显低于文献报道[9],分析原因可能是由于UMP的穿透性较差,特别是胃壁明显增厚或病变隆起过大,对于周围器官显示较为困难。本研究中UMP确诊并且病理证实的1例T4期胃癌,该例患者极度消瘦(皮革胃病例),胃腔缩小,周边有腹水,胃窦部病灶与胰腺病灶融合。同时,UMP对T分期同样存在有分期过度和分期不足的现象 ,其原因可能是:内镜医生操作不熟练,各项参数未到位,表现为超声小探头位置不当,其超声波不能与病灶部位垂直而有倾斜、偏向扫描,导致壁层或浆膜层模糊或增厚或胃腔充盈不良,影像显示不佳;深层次的微小浸润不能被发现,肿瘤周边的炎性反应,纤维组织增生,肿瘤边缘的疤痕组织,浆膜与腹膜腔网膜的黏连从而使病灶的界限不清,导致分期不准确。UMP对于T2、T3的病例存在分期不足和分期过度的情况,除了上述原因外:还有浆膜层及浆膜下层在UMP上表现为同一高回声,而浆膜下层浸润属于T2;某些胃的特殊区域(如胃小弯急胃底后壁)缺乏浆膜覆盖,即使肿瘤已经浸润全层或透壁性生长,病理学上仍诊断为T2期。
本研究中UMP与MSCT对T分期的总准确率分别为82.26%和88.71%,均存在分期不足和分期过度的现象,但两者差异无统计学意义,与Habermann等[9]的研究结果一致。UMP对早期胃癌诊断率为100%,进展期胃癌诊断的准确率79.25%;MSCT的早期胃癌的准确率为88.89%,进展期为88.68%,两者差异无统计学意义[11-12]。根据UMP对早期胃癌诊断准确率高的特点,对于内镜下浅表病灶的检查应首选UMP。
本研究中UMP对T4期的胃癌判断准确率较低,原因在于UMP受到探头主体扫描范围的限制,无法明确胃周脏器的具体浸润情况,对严重狭窄病例探头甚至无法通过导致分期困难,奚维东等[13]建议对T1和T2期的胃癌使用高频探头(20 MHz),对T3和T4期的胃癌应结合使用低频探头(7.5 MHz),以期达到最佳成像效果,提高诊断的准确率。而MSCT对T4期的胃癌的诊断有独特的优势[14],特别是在胃腔的整体显示及胃壁与周围组织关系的显示方面,MSCT检查要优于UMP检查。因此,与UMP相比,MSCT可更清晰显示与肿瘤相邻的胃周脂肪、周围器官及主要血管,而UMP对T4期肿瘤以及有严重肿瘤狭窄病例有一定局限性,故MSCT存在较大优势,但UMP对早期胃癌浸润深度的判断准确率非常高,对行内镜下治疗等微创手术病例的选择有较大的临床应用价值,为临床上开展EMR和ESD手术提供依据;MSCT则是胃癌术前分期的首选。本课题组利用内镜与内镜下超声对局部病灶的大小,范围及局部浸润程度的判断,结合MSCT对淋巴结的转移及周边脏器的浸润情况的诊断,可以大大提高对胃癌术前分期的准确性,这2种方法取长补短,对于治疗方案的选择,手术方式的确定极有参考价值[15]。胃癌的术前分期是指导临床治疗的重要手段,目前的技术虽不能达到完全准确,但随着仪器设备的改进、临床内镜医生的技术提高,必将会提高准确评估胃癌分期的正确性,这也是我们共同努力追求的初衷及方向。
[1] D’Ella F, Zingarelli A, Palli D, et al.Hydro-dynamic CT preoperative staging of gastric cancer: correlation with pathological findings.A prospective study of 107 cases[J].Eur Radio, 2000, 10(12): 1877-1885.
[2] Rossil M, Broglial L, Maccionil F.Hydro-CT in patients with gastric cancer: preoperative radiologic staging[J].Eur Radio, 1997, 7(5): 659-664.
[3] Lee DH, Seo TS, Ko YT.Spiral CT of the gastric carcinoma:staging and enhancement pattern[J].Clin Imaging, 2001,25(1): 32-37.
[4] Hizawa K, Iwai K, Esaki M, et al.Is endoscopic ultrasonography indispensable in assessing the appropriateness of endoscopic resection for gastric cancer [J].Endoscopy,2002, 34(12): 973-978.
[5] 朱正纲.选择合适的手术方式提高早期胃癌的生活质量[J].中华胃肠外科杂志, 2001, 4(2): 729-734.
[6] 尹浩然, 朱正纲, 林言箴.进展期胃癌外科综合治疗的方法与步骤[J].外科理论与实践, 2000, 5(3): 134-135.
[7] Puli SR, Reddy JB, Bechtold ML, et al.Staging accuracy of esophageal cancer by endoscopic ultrasound: a meta-analysis and systematic review[J].World J Gastroenterol, 2008,14(10): 1479-1490.
[8] 齐信王, 汤贞彦.胃癌术前超声检查的临床价值[J].中国医学影像学杂志, 2004, 12(5): 385-387.
[9] Habermann CR, Weiss F, Riecken R, et al.Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US[J].Radiology, 2004, 230(2): 465-471.
[10] 李辉, 钱俊波.超声微探头对胃癌术前分期的诊断价值[J].中国内镜杂志2006, 12(5): 529-533.
[11] Dux M, Richter GM, Hansmann J, et al.Helical hydro-CT for diagnosis and staging of gastric carcinoma[J].J Comput Assis Tomogr, 1999, 23(5): 913-922.
[12] Blackshaw G, Stephens M, Lewis WG, et al.Progressive CT system technology and experience improve the perceived preoperative stage of gastric cancer[J].Gastric Cancer,2005, 8(1): 29-34.
[13] 奚维东, 赵聪.术前内镜超声对胃癌浸润深度及手术可切除性评估的研究[J].中华消化内镜杂志, 2003, 20(1):45-46.
[14] 陈军, 严超.内镜超声检查和多层螺旋CT对胃癌术前T、N分期的比较研究[J].中国实用外科杂志, 2005, 25(5):278-281.
[15] 朱正纲, 严超.内镜超声检查与多层螺旋CT对胃癌术前分期的对比研究[J].中华胃肠外科杂志, 2002, 5(2): 99-103.

