尿激酶联合黄芪对环孢素 A大鼠慢性肾纤维化组织中核因子 -κB表达的影响及意义
罗正茂,何 凤,王 寅,张建林,张 虹,罗 仁,童俊容
肾小管间质纤维化是肾间质区各种纤维细胞激活和炎症反应的最终结果,而纤维细胞激活和炎症反应密切相关[1]。多种炎性递质如:炎性细胞因子、趋化因子和黏附分子等参与了肾间质区炎症反应的病理生理过程。核因子 -κB(NF-κB)是一种与炎性递质的产生、细胞增殖、细胞外基质交联和细胞凋亡等有关的转录因子,参与了多种炎症反应的信号转导过程[2]。既往的体内研究发现,尿激酶(urokinase-type plasminogen activator,uPA)可减轻肾间质的炎症反应,改善间质纤维蛋白的沉积[3],其是否通过影响NF-κB的活化负性调控肾间质区炎症反应来发挥抗肾脏纤维化的作用。本研究利用环孢素 A(cyclosporin A,CsA)慢性肾病大鼠模型,探讨 uPA联合黄芪 (astragalus mongholicus,AM)对 CsA肾病大鼠肾组织 NF-κB活性的影响及意义。
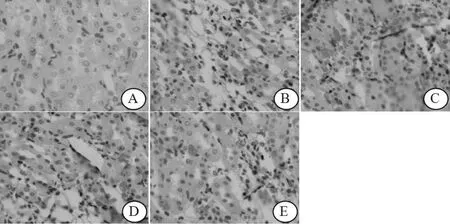
图 1 各组大鼠肾组织的病理结构变化 (HE染色 ×400)Figure 1 Pathological structural changes of the renal tissue in five groups
1 材料与方法
1.1 药物和试剂 黄芪注射液 2 g/ml,购自成都地奥九泓制药厂;尿激酶注射液5万 U/支,购自广东天普公司;环孢菌素 A,购自瑞士诺华公司;橄榄油,意大利原装进口;羟脯氨酸试剂盒,购自南京建成生物工程研究所;兔抗人 NF-κB p65多克隆抗体、小鼠抗人 p-p65单克隆抗体、小鼠抗人 IκBα单克隆抗体、兔抗小鼠 IκBβ多克隆抗体均购自美国 cell signal公司;小鼠抗人 β-actin单克隆抗体、小鼠抗人 α-tubulin单克隆抗体均购自美国 Santa cruz公司。
1.2 实验动物 SPF级雄性 SD大鼠,6~8周龄,体质量 200~250 g,由南方医科大学动物实验中心提供。
1.3 方法
1.3.1 动物模型的建立和分组 SD大鼠饲养于光控及温控动物室,实验前动物先在动物室饲养 1周,以适应环境。大鼠给予低盐饮食 (钠含量 0.05%),随机分为5组:(1)对照组 (n=5):口服灌胃橄榄油 (1 ml·kg-1·d-1);(2)模型组(n=5):口服灌胃 CsA(25 mg· kg-1·d-1);(3)uPA治疗组 (n=7):口服灌胃 CsA(25 mg·kg-1·d-1),同时给予uPA皮下注射治疗 (2 000 U·kg-1·d-1);(4)AM治疗组 (n=7):口服灌胃 CsA(25 mg·kg-1·d-1),同时给予AM腹腔注射治疗 (10 g·kg-1·d-1);(5)联合组 (n=7):口服灌胃 CsA(25 mg·kg-1·d-1),同时给予 uPA皮下注射 (2 000 U·kg-1·d-1)、AM腹腔注射治疗 (10 g·kg-1·d-1)。每组大鼠均给药 4周,各组于 4周末取双侧肾组织,去除肾周脂肪组织和肾包膜,冠状面切开组织,部分组织用 4%甲醛固定,其余组织于液氮保存。
1.3.2 肾组织病理学分析 肾组织标本经 4%甲醛固定,石蜡包埋,切成 4μm厚的切片,60℃烤片 1 h后,分别经二甲苯脱蜡,分级乙醇脱蜡至水,按 HE染色步骤进行染色。每张切片随机选取观察15个互不重叠的高倍视野,计算肾皮质中发生损害 (肾小管扩张、萎缩、管型、坏死或小管炎)的肾小管数目和总肾小管数,以损害的肾小管数目占总肾小管数的百分比表示肾小管损害的程度。
1.3.3 羟脯氨酸测定 取液氮保存的肾组织 100 mg,严格按羟脯氨酸测试盒(南京建成公司)说明书操作。羟脯氨酸标准品配成标准液,蒸馏水为空白对照,做标准曲线,通过标准曲线求出样本中羟脯氨酸含量。
1.3.4 间接免疫荧光染色 新鲜肾组织行 5μm厚冷冻切片,室温干燥,4℃丙酮固定 10 min。磷酸盐缓冲液 (PBS)洗涤,5 min×3次,胎牛血清 (BSA)封闭30 min,小鼠抗人 p-p65单克隆抗体 (1∶100)4℃过夜,PBS洗涤 5 min×3次,滴加山羊抗鼠 IgG-TRITC,室温孵育 60 min,PBS洗涤 5 min×3次,DAPI染核5min,PBS洗涤 5 min×3次,90%缓冲甘油封片,荧光显微镜观察,肾组织细胞内有红色颗粒为阳性。每次染色均同时以PBS缓冲液替代一抗作为阴性对照。每张切片 200倍下随机选取 15个不重叠视野,拍片,计算阳性表达部位染色面积与视野内肾小管间质总面积比值,并取平均值。1.3.5 Western 印迹法检测 p-p65、p65、IκBα和 IκBβ蛋白的表达 取液氮保存的肾组织 100 mg,加适量组织蛋白裂解液后,用电动匀浆器匀浆,冰中静置30 min,离心,取上清,用 Micro BCA Protein Kit(美国 Piercr公司)测定蛋白质浓度。加蛋白上样缓冲液,煮沸 5 min,瞬时高速离心,分别取不同组织的总蛋白50μg经 10%SDS-PAGE凝胶电泳后,转移至聚偏氟乙酰 (PVDF)膜上,用5%脱脂奶粉溶液室温封闭 1 h,加入一抗p-p65、p65、IκBα、 IκBβ、β-actin和α-tubulin,均 1∶1 000稀释,4℃过夜。洗膜后,再加辣根过氧化物酶 (HRP)标记的二抗,室温孵育 1 h,洗膜后进行显色,曝光于 X线胶片上,图像分析系统进行灰度扫描,用 Image J分析软件将图片上每个特异条带灰度值数字化。以 β-actin或 α-tubulin为内参,用目的蛋白条带灰度值与内参灰度值的比值代表目的蛋白的相对表达量。
1.4 统计学方法 所有数据以 (x±s)表示,多个样本均数比较用 One-way ANOVA,多组间的两两比较采用 LSD检验,所有数据由 SPSS 13.0统计软件处理,以 P<0.05为差异有统计学意义。
2 结果
2.1 肾组织病理改变 与对照组相比,模型组出现炎症细胞浸润及细胞增殖,肾小管变性、萎缩,部分肾小管消失,集合管、远曲小管扩张呈囊状,皮质部变薄,肾小管损伤程度明显较对照组重 (P<0.05)。与模型组相比,uPA组和 AM组肾小管损伤程度明显减轻 (P<0.05),且联合组治疗效果更佳,除对照组外,其肾小管损伤程度最轻 (见图 1、表 1)。
2.2 羟脯氨酸含量 羟脯氨酸是胶原蛋白中必含氨基酸,胶原成分中羟脯氨酸的含量约占 14.4%,所以肾间质胶原可通过测定肾组织羟脯氨酸的含量来定量评价。对照组羟脯氨酸的含量呈基础表达量,模型组羟脯氨酸的含量较对照组增加,差异有统计学意义 (P<0.05)。与模型组比较,uPA组和 AM组肾组织羟脯氨酸的含量减低,差异有统计学意义 (P<0.05),uPA组与 AM组比较差异无统计学意义 (P>0.05)。联合组羟脯氨酸的含量仅高于对照组,均较其他 3组减低,差异有统计学意义 (P均 <0.05,见表1)。
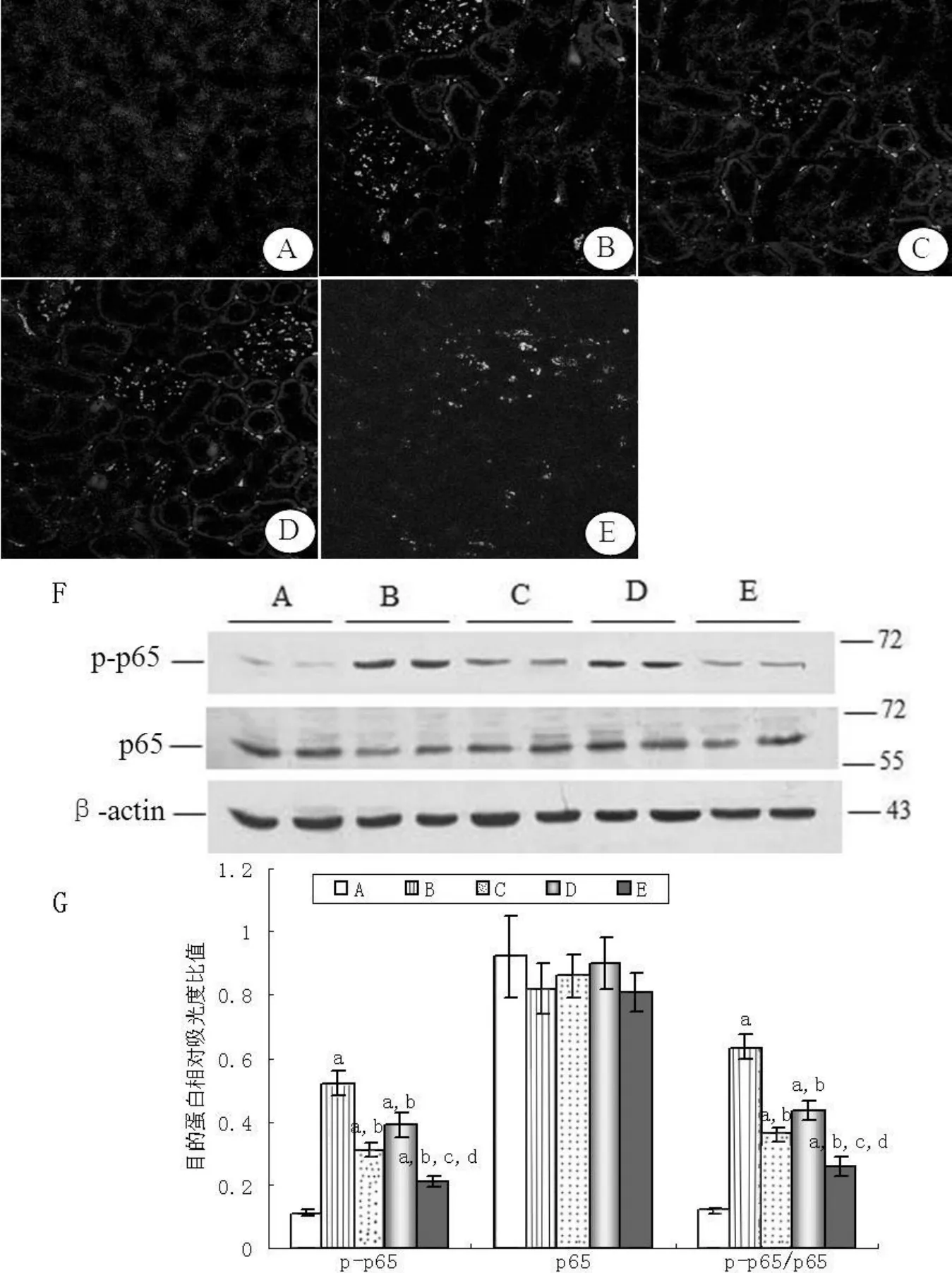
图 2 免疫荧光和Western blot共同检测NF-κB的激活变化 (免疫荧光×200)Figur e 2 The activation of NF-κBdetected by immunofluorescence and western blot
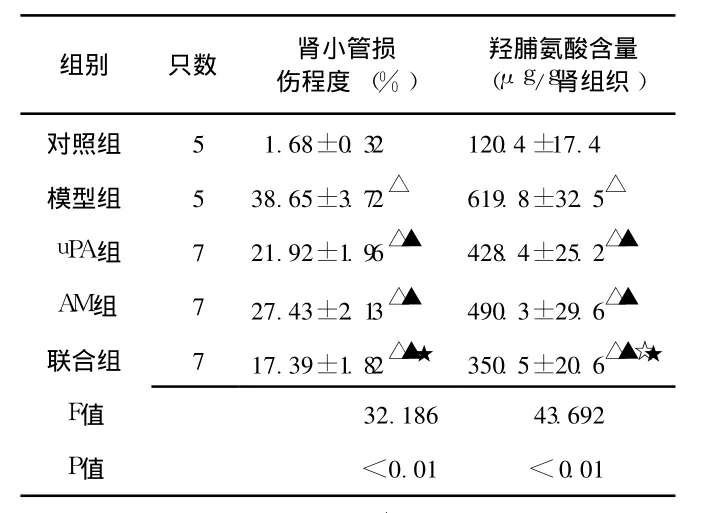
表 1 各组大鼠肾小管损伤程度及肾组织羟脯氨酸的含量比较Table 1 The degree of renal tubular injury and the content of hydroxyproline in renal tissue in five groups
2.3 NF-κB p65核转位 p65是 NF-κB的一个重要的亚单位,NF-κB活化后,p65发生磷酸化 (p-p65),且由细胞质转移至细胞核。因此,我们应用免疫荧光观察 p-p65的表达及定位,且通过Western印迹法检测 p-p65及 p65的表达水平。免疫荧光检测结果:对照组 pp65的荧光强度极弱,而模型组 p-p65的荧光强度明显增强,且 p-p65定位于肾小管上皮细胞、肾小球脏层上皮细胞及系膜细胞的胞核内。与模型组比较,uPA组、AM组及联合组 p-p65的荧光强度均减弱 (见图 2:A~E)。Western印迹结果:主带 p65表达各组间无差异。对照组 p-p65有基础量表达,而模型组 pp65表达增强 〔(0.52±0.04)%vs(0.11±0.01)%,P<0.05〕。各治疗组 p-p65表达均较模型组减低 (P<0.05),并且联合组 p-p65表达较 uPA组和 AM组低 (P<0.05,见图 2:F、G)。
2.4 肾组织中 IκBα和 IκBβ的降解 为进一步证实 NF-κBp65核转位是由于 NF-κB的抑制因子 IκB发生磷酸化及降解,本研究应用 Western印迹法检测细胞内IκBα和 IκBβ的水平。对照组 IκBα呈高表达,而模型组 IκBα表达减低 〔 (0.09±0.01)%vs(0.63±0.05)%,P<0.05〕。各治疗组 IκBα表达均较模型组高,且联合组高于 uPA组和 AM组 (P<0.05)。IκBβ的表达各组间差异无统计学意义 (P>0.05,见图 3)。
3 讨论
肾小管间质纤维化是多种慢性肾脏疾病发展到终末期肾衰竭的共同途径,其病理过程主要包括炎症通路的激活、肾小管上皮细胞 -间充质细胞转分化 (EMT)、细胞外基质 (ECM)合成与降解异常等[4]。本研究病理结果显示,CsA大鼠肾组织出现肾小管上皮细胞萎缩、消失,肾间质区增宽伴炎症细胞浸润,提示 CsA大鼠肾脏发生了炎症反应的病理改变。模型组羟脯氨酸的含量明显高于对照组,表明 CsA大鼠肾组织纤维化加重。Satoshi等[5]研究证实,CsA可引起大鼠肾组织的炎症反应和纤维化的病理改变,并且肾间质炎症反应先于间质纤维化形成。本研究结果与此相一致。在此基础上,我们发现AM及 uPA治疗对 CsA大鼠肾脏病理改变及纤维化程度均有不同程度的改善,且二者联合治疗的效果更佳。
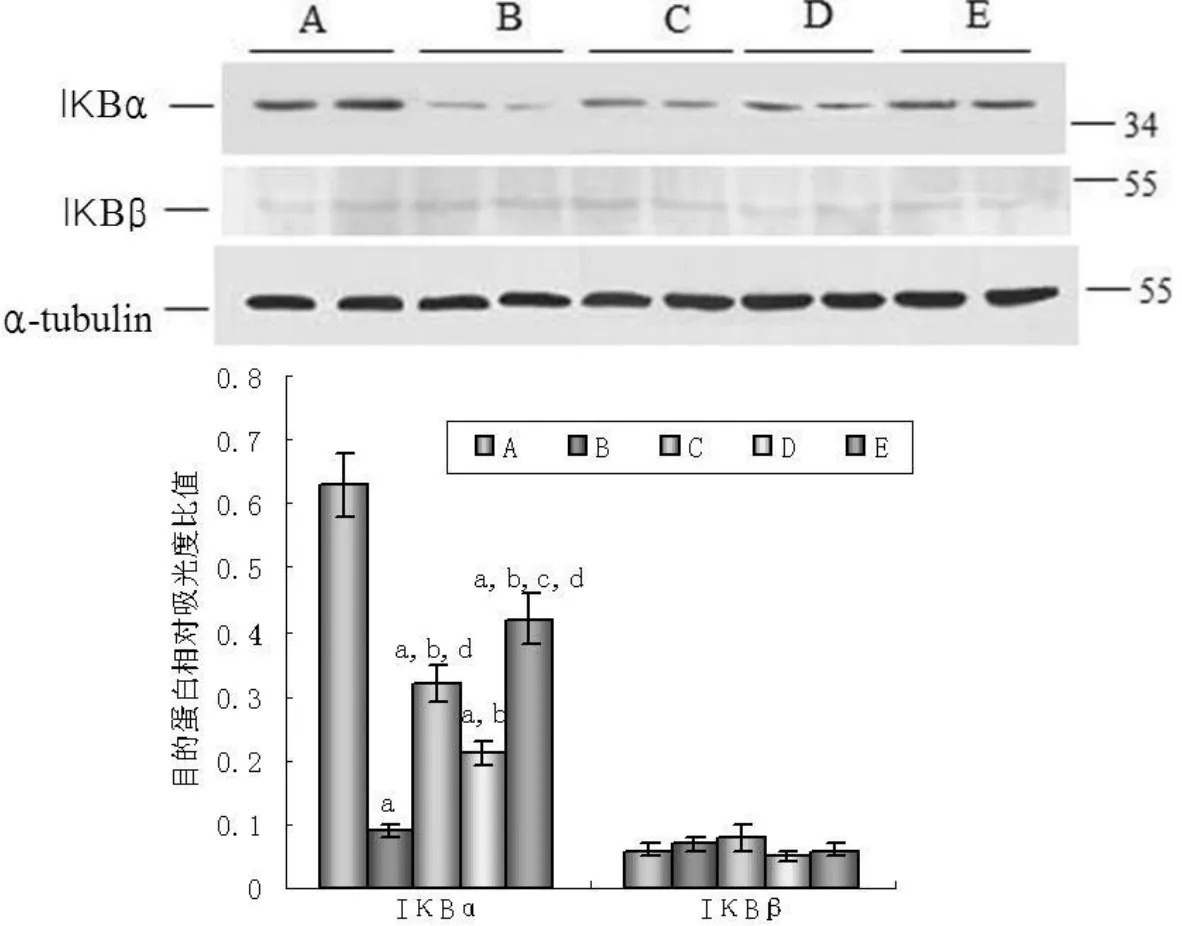
图 3 各组大鼠肾组织中 IκBα和 IκBβ的降解Figure 3 The degradation of IκBαand IκBβin renal tissue in five groups
NF-κB在炎症反应、细胞分化、细胞凋亡等的病理生理过程中发挥重要作用[5]。NF-κB被激活后发生磷酸化而移位入核,并与 DNA结合启动靶基因转录,而 IκB与之解离并被降解[6]。我们检测 p-p65及总的 p65水平,以评价各组 NF-κB的激活程度。本研究中,免疫荧光检测结果表明,各组大鼠肾组织有 pp65表达,且定位于肾小管上皮细胞、肾小球脏层上皮细胞及系膜细胞的胞核内,提示 NF-κB被激活。同时 Western印迹蛋白定量的结果显示,各组总的 p65水平无明显差异,而 p-p65在模型组表达最高,治疗组的 p-p65蛋白水平介于模型组与对照组之间,且较模型组有显著的差异,说明 AM及 uPA能抑制 NF-κB的激活,联合组 p-p65蛋白水平均低于其他各组,进一步提示及 uPA联合治疗对 NF-κB激活的抑制作用更强。
IκB是细胞内 NF-κB的主要抑制因子,NF-κB激活的同时伴有 IκB的降解。因此,本研究还检测了 IκB的两个亚基 IκBα和 IκBβ的蛋白水平,结果显示,对照组 IκBα蛋白表达最高,而模型组IκBα蛋白明显减少,而其 p-p65的表达显著高于对照组,表明 NF-κB p65发生磷酸化并核转位是由于 NF-κB的抑制因子 IκBα降解所致。AM及 uPA治疗的各组 IκBα均明显高于模型组,且联合组IκBα明显高于 uPA组及 AM组,这充分证实联合治疗能更好地抑制 NF-κB激活。IκBβ的降解各组间无明显差异,说明 uPA及 AM对 IκBβ的降解无明显作用,也进一步表明它们是通过调控 IκBα的降解发挥作用。
肾脏 NF-κB通路激活直接参与纤维化的发生、发展[7],NF-κB通路激活,可释放炎性递质 〔(IL-1、肿瘤坏死因子 -α(TNF-α)等〕,它们浸润肾间质区的成纤维细胞,产生炎性反应,进一步产生并释放一系列致肾毒性细胞因子和生长因子 (PDGF、TGF-β等),这些因子可导致肾小管上皮细胞的表型发生转化,形成肌成纤维细胞,开始大量分泌、合成一系列胶原纤维蛋白,即 ECM。本研究中,联合组 NF-κB激活较低,且该组的羟脯氨酸含量也较低,即纤维化程度较轻,这可能是黄芪及尿激酶对 NF-κB抑制的结果。新近研究表明,NF-κB通路激活可上调表达 Snail蛋白[8],而 Snail是重要的触发 EMT的信号分子[9],可加重肾脏纤维化。
研究发现,AM通过促进 HGF生成,下调 TGF-β1表达,抑制肌成纤维细胞的激活,从而发挥抗肾纤维化的作用[10]。本研究证实,单用 AM也可抑制 NF-κB,进一步认识了其抗纤维化的作用机制。uPA可将无活性的纤溶酶原激活为纤溶酶,发挥降解 ECM的作用[11]。由此可见,uPA不仅可直接降解 ECM,还可能通过抑制 NF-κB的活性从而减少 ECM的生成。本研究通过建立 CsA慢性肾病模型,发现 NF-κB通路能介导肾脏纤维化的发生、发展,而 AM联合 uPA治疗能通过抑制 NF-κB的激活,从而发挥抑制肾脏纤维化的作用,为慢性肾纤维化的防治提供新的途径。
1 Wynn TA.Cellular and molecular mechanisms of fibrosis[J].J Pathol,2008,214(2):199-210.
2 Elsharkawy AM,Mann DA.Nuclear factorkappaB and the hepatic inflammation-fibrosis-cancer axis[J].Hepatology,2007,46(2):590-597.
3 王寅,马骊,童俊容,等 .尿激酶对环孢素 A慢性肾病大鼠肾间质炎症的干预作用[J].南方医科大学学报,2008,28(5):835-838.
4 Tamada S,Asai T,Kuwabara N,et al.Molecular mechanismsand therapeutic strategiesof chronic renal injury:the role of nuclear factor kappaB activation in the development of renal fibrosis[J].J Pharmacol Sci,2006,100(1):17-21.
5 Tamadal S,Asail T,Kuwabaral N,et al.Molecular mechanisms and therapeutic strategies of chronic renal injury:the roleof nuclear factorκB activation in the development of renal Fibrosis[J].J Pharmacol Sci,2006,100:17-22.
6 Luo JL,Kamata H,Karin M.IKK/NF-κB signaling:balancing life and death-a new approach to cancer therapy[J].J Clin Invest,2005,115:2625-2632.
7 König HG,Kögel D,Rami A,et al.TGF-beta 1 activates two distinct type I receptors in neurons:implications for neuronal NF-kappa B signaling[J].J Cell Biol,2005,168(7):1077-1086.
8 Wu Y,Deng J,Rychahou PG,et al.Stabilization of snail by NF-κB is required for inflammation-induced cell migration and invasion[J].Cancer Cell,2009,15(5):355-7.
9 Boutet A,Esteban MA,Maxwell PH,et al.Reactivation of Snail genes in renal fibrosis and carcinomas:a process of reversed embryogenesis[J].Cell Cycle,2007,6(6):638-42.
10 Zuo C,Xie XS,Qiu HY,et al.Astragalus mongholicus ameliorates renal fibrosis by modulating HGF and TGF-beta in rats with unilateral ureteral obstruction[J].J Zhejiang Univ Sci B,2009,10(5):380-390.
11 Jin T,Bokarewa M,Tarkowski A,et al.Urokinase-type plasminogen activator,an endogenous antibiotic[J].J Infect Dis,2005,192(3):429-437.

