快速电场起搏对心房肌细胞电生理特性的实验研究*
王 伟,肖颖彬,程 伟
(第三军医大学附属新桥医院全军心血管外科中心,重庆400037)
心房纤颤(房颤)是临床常见的心律失常,是很多心血管疾病出现的一种表现,其发病率较高。目前对于房颤的病理生理机制尚不完全清楚,导致对于房颤的治疗效果欠佳。在房颤的相关研究中,动物模型或临床病例标本具有诸多局限性[1],所以建立房颤的细胞模型有重要的意义。本研究旨在探索原代心房肌细胞体外培养方法和快速电场起搏模型的建立,并对快速电场起搏后心房肌的电生理特性进行初步的研究。
1 材料与方法
1.1 实验动物 选择1周左右的Wistar乳鼠,雌雄不拘,由第三军医大学实验动物中心提供。
1.2 主要仪器 BL-420生物机能实验系统(成都泰盟科技有限公司),CO2孵箱,倒置显微镜;微电极拉制仪;玻璃微电极:内径1.6 mm,有芯,长10 cm;阻抗 3~5 MΩ;膜片钳放大器;心肌细胞灌流及封接监视系统:自制单细胞灌流槽,电视监视系统观察细胞及指导封接过程;微电极操纵器;分析软件(德国HEKA公司)。
1.3 主要试剂 DM EM 培养基、胎牛血清、D-hank′s液(Hyclone公司);Ⅱ型胶原酶及5-溴脱氧尿核苷(Brdu,Sigma公司);小鼠抗大鼠Sarcomerie actin单抗(博士德公司);FITC标记山羊抗小鼠IgG(中山金桥公司);用于记录动作电位的正常细胞外液组成为(mM):137 NaCl,5.4 KCl,1 MgCl2,10 glucose,10 HEPES,以NaOH调pH至7.40;电极内液的组成为(mM):150 KCl,1 M gCl2,5 HEPES,10 EGTA,5 Na2ATP,以KOH调pH至7.20。
1.4 心房肌细胞分离和培养 参考Benardeau等[2]的原代心房肌细胞培养方法并加以改良。消毒后开胸,迅速切除心脏并置于D-hank′s液中清洗、去血,取左、右心房,在手术用放大镜下仔细去除血管、心房及结缔组织,用无血清培养基洗涤,无菌条件下用眼科剪将右心耳修剪成直径约1 mm大小的组织块。在组织块中加入0.08%胰酶,37℃水浴5 min,轻柔吹打,留取上清液加入冷的含15%小牛血清的DMEM中中止消化,反复消化3次。之后向剩余组织中加入0.08%Ⅱ型胶原酶,35~36℃水浴中消化20 min,吹打收集上清液于冷的含15%小牛血清的DMEM中。再重复此步骤2~3次。将每次收集的细胞悬液移入离心管中,4℃1 000 r/min离心5 min,弃上清液,再用 DM EM培养液洗细胞 1次,离心,弃上清液。加入DMEM培养液(含10%胎牛血清),打散细胞团为单细胞悬液。接种于培养瓶中,置培养箱(5%CO2、37℃)中培养45 min后,上清液再培养45 min,用2次差速贴壁法去除成纤维细胞。贴壁后的上清液用台盼蓝染色法计数活细胞数,将其调成细胞浓度为5×105个/mL之后,加入Brdu使其终浓度为0.1 mM,并继续培养接种于细胞培养瓶内,置 CO2培养箱(5%CO2、37℃)中培养。24 h后换液,加不含 Brdu的DMEM培养液,并用倒置显微镜观察。
1.5 快速刺激心房肌细胞模型建立 采用铜电极片,厚度0.3 mm,长15 cm,宽10 cm,电极间距为10.0 cm,两电极平行放置,用绝缘体固定,防止两电极间导电。倒置显微镜观察细胞贴壁80%左右时,在37℃、5%CO2孵箱中将培养板置于电场中用BL-420生物机能实验系统给予刺激,刺激频率10 Hz,强度 1.5 V/cm,分别进行电场刺激 6、12、24、48 h。
1.6 心房肌细胞纯度的鉴定 用4%多聚甲醛固定20 min,分别做荧光免疫组化。取待用细胞片,0.01 mol/L PBS液洗3次,每次5 min,吹干。以0.1%BSA封闭非特异性反应(37℃水浴30 min),3%H2O2封闭(37℃水浴30 min),细胞片加小鼠抗大鼠Sarcomerie actin(4℃过夜),PBS液洗5 min×3次,加大鼠抗小鼠IgG-FITC(37℃,1 h),荧光显微镜下观察并摄片。阳性细胞率=阳性细胞数/细胞总数×100%。
1.7 全细胞膜片钳记录 在全细胞膜片钳记录中,采用电压钳模式(voltage-clamp mode)记录离子通道电流;采用电流钳模式(current-clamp mode)记录动作电位。取细胞爬片置于倒置显微镜工作台上的1 mL的灌流槽中,以95%O2与CO2混合气体饱和的细胞外液室温下灌流,流速1~2 mL/min。于倒置显微镜下选择边缘整齐、表面无小泡及颗粒、横纹清晰、无收缩的细胞,在25℃下进行实验。采用标准细胞贴附式方法,形成高阻封接后,以脉冲负压破膜。补偿电极电容。在电流钳模式下,以1.5倍的阈上去极化电流刺激引发动作电位,刺激间隔为1 s。连续刺激后,AP形状较为稳定,连续记录10个AP,取叠加平均图形,测量其动作电位复极 50%和 90%时间(APD50and APD90)及有效不应期(ERP)。数据的采集及分析处理由Pulse Pulsefit软件完成。
2 结 果
2.1 心房肌细胞培养及鉴定 培养72 h,倒置相差显微镜观察见心房肌细胞呈多种形态,以梭状、杆状、三角形和不规则形态为主。多数细胞开始出现规律搏动。经免疫细胞化学鉴定,90%以上的细胞Sarcomerie actin染色阳性,细胞纯度符合实验要求。
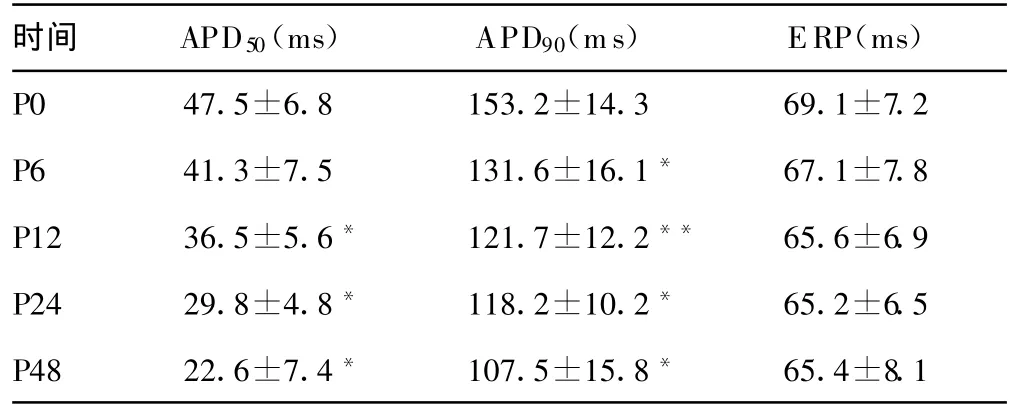
表1 快速起搏后心房肌细胞动作电位周期和有效不应期的变化(n=6)
2.2 动作电位周期和有效不应期的变化 快速电场起搏6 h后心房肌细胞的APD50和ERP较起搏前无显著变化,APD90较起搏前显著缩短(P<0.05)。快速电场起搏12、24和 48 h后心房肌细胞的APD 和APD 均较起搏前显著缩短(P<0.05),ERP较起搏前无显著变化。结果见表1。
3 讨 论
目前对房颤的研究大多是在临床心肌标本和房颤动物模型上进行,虽然取得了良好效果,但也存在一定的局限性,比如无法进行精确干预、影响因素众多以及伦理学问题等。随着心房肌细胞培养技术的成熟与完善,原代培养的心房肌细胞可以作为心肌模型进行心脏疾病病理生理学研究。直接在心房肌细胞上进行研究的结果可靠,所以建立房颤的细胞模型有重大意义[2]。
房颤的发生和维持是一种复杂的病理生理过程,虽然近年来对房颤电重构的离子通道改变进行了深入研究,但学术界仍然对一些现象和理论存在分歧。在目前的研究中,公认心房电重构在房颤的发生发展和维持中具有重要的作用。心房电重构的概念由Wijffels等[3]在1995年提出,指在AF或快速心房率的影响下引起心房肌发生电生理功能改变,并进而促使AF的发生和维持(心房颤动诱发心房颤动)。心房电重构主要表现为心房肌有效不应期和动作电位时程呈进行性缩短,传导速度减慢,心房肌不应期离散度增加,以及频率适应性减退等。AF时引起的心房电重构主要与心房肌细胞离子通道、缝隙连接蛋白和肾素、血管紧张素系统的改变有关[4-7]。
本研究利用原代培养的心房肌细胞建立了快速起搏的房颤细胞模型,对快速起搏后的电生理改变进行了初步的研究。结果表明:在快速起搏的 12、24和48 h,心房肌细胞的动作电位周期均较起搏前显著缩短,提示心房肌细胞发生了电生理变化,与临床研究和动物实验取得的结果类似,有效不应期无显著变化,可能与起搏时间受限有关。分析其电生理变化发生的原因,可能与 L一型钙通道[8-9]、钾通道KV4.3等离子通道[10-11]和缝隙连接蛋白[12-13]等的表达改变有关[8],在房颤的电重构过程中,早期主要是由于离子通道自身功能性的反馈调节引起动作电位周期和有效不应期的缩短,后期则通过一系列信号传导引起L一型钙通道、钾通道KV4.3等离子通道基因转录和表达下调,导致结构的改变,最终成为维持动作电位周期和有效不应期缩短的物质基础[14-15]。然而房颤的离子通道基因表达调控机制仍不明确,尚需要进一步的深入研究。
综上所述,快速电场起搏的原代房肌细胞,电生理改变符合房颤电重构的特点,因此可作为较为理想的房颤实验研究模型,利用原代培养的心房肌细胞(心房肌细胞或心室肌细胞)建立快速起搏模型,可以得到与快速起搏动物模型相似的效果,但细胞模型更利于进行电生理研究以及进行更精确的药物干预和分子生物学操作,为房颤的深入研究奠定了基础。
[1]Bianca B,Harm K,Robert H.Calpain inhibition prevents pacing-induced cellular remodeling in a HL-1 myocyte model for atrial fibrillation[J].Cardiovasc Res,2004,62(3):521.
[2]Benardeau A,Hatem SN,Rucker-Martin C,et al.Primary culture of human atrial myocytes is associated with the appearance of structural and functional characteristics of immature myocardium[J].J Mol Cell Cardiol,1997,29:1307.
[3]Wijffels MC,Kirchhof CJ,Dorland R,et a1.Atrialfibrillation begets atrial fibrillation.A study in awake chronically instrumented goats[J].Circulation,1995,92(7):1954.
[4]Vicente C,Francisco M,Luis M,et al.Influence of electrical cardioversion on inflammation and indexes of structural remodeling,in persistent atrial fibrillation[J].Int J Cardiol,2009,132(2):227.
[5]Hans-Ruprecht N,Ulrich S,Yuri B,et al.Chronic atrial dilation,electrical remodeling,and atrial fibrillation in the goat[J].J Am Coll Cardiol,2006,47(3):644.
[6]Grace CV,Bernard JG,Teresa SM,et al.Structural and functional remodeling of the left atrium:clinical and therapeutic implications for atrial fibrillation[J].J Am Coll Cardiol,2008,51(1):1.
[7]Antony W,Kathleen K,Andrew R.Cellular bases for human atrial fibrillation[J].Heart Rhythm,2008,5(6):S1.
[8]Manuel M,Shamil Y,Graeme W,et al.Combined metabolomic and proteomic analysis of human atrial fibrillation[J].J Am Coll Cardiol,2008,51(5):585.
[9]Natig G,Mathias B,Guido M,et al.Angiotensin II-induced changes of calcium sparks and ionic currents in human atrial myocytes:Potential role for early remodeling in atrial fibrillation[J].Cell Calcium,2006,39(2):175.
[10]Emanuel F,David R,Kevin D.Information learned from animal models of atrial fibrillation[J].Cardiol Clin,2006,27(1):45.
[11]Hiroshi W,Daniel K,Seiko M,et al.ACE I/D polymorphism associated with abnormal atrial and atrioventricular conduction in lone atrial fibrillation and structural heart disease:Implications for electrical remodeling[J].Heart Rhythm,2009,6(9):1327.
[12]Jyhming J,Yi-Rong C,Chia-Ti T,et al.The association of human connexin 40 genetic polymorphisms with atrial fibrillation[J].Int J Cardiol,2007,116(1):107.
[13]Stefan D,Lioudmila P,Aida S,et al.Pharmacological modulation and differential regulation of the cardiac gap junction proteins connexin 43 and connexin 40[J].Biol Cell,2002,94(7):409.
[14]马瑞彦,肖颖彬,陈劲进.快速心房起搏对家兔心房肌细胞内钙离子浓度及L-型钙通道表达的影响[J].中华医学杂志,2006,86(27):1926.
[15]Zhao QY,Huang CX,Jiang H,et al.The research of molecular and ionic mechanisms in vagally mediated atrial fibrillation in canine[J].Int J Cardiol,2007,117(3):425.

