脂质体介导的 VEGF-C反义寡核苷酸对肺癌微淋巴管生成的影响
丁成智 钱永跃 郭旭峰 徐中华 徐忠恒
(苏州大学附属第二医院胸心外科,江苏 苏州 215004)
非小细胞肺癌(NSCLC)约占肺癌 80%,随着对综合治疗和个体化治疗的认识不断加深和推广,NSCLC的治疗已经有了很大提高,但目前 5年生存率仍低于 15%〔1〕。一般认为,肿瘤细胞的侵袭性和转移性是决定肿瘤类型和患者死亡的主要原因,因此明确肿瘤细胞转移和肿瘤细胞之间相互作用的分子机制对肿瘤的治疗有重要意义。目前认为,抗肿瘤的血管生成和淋巴管生成是有效治疗肿瘤的主要途径之一〔2〕。我们前期研究结果已经证实,肺癌细胞通过高表达血管内皮生长因子 C(VEGF-C)与淋巴管内皮细胞 VEGFR-3特异性结合刺激肺癌新生淋巴管生成〔3〕。本研究通过建立肺癌裸鼠皮下种植瘤模型,研究脂质体介导的 VEGF-C反义寡核苷酸对肺癌细胞VEGF-C表达水平和种植瘤内微淋巴管生成的影响,来寻找肺癌基因治疗新方法。
1 材料与方法
1.1 材料
1.1.1 细胞及动物 肺癌 A549细胞株由山东大学齐鲁医院胸外科胡国强教授惠赠,生长特性为贴壁生长,传代培养。4~6周龄雌性 BALB/C系裸鼠 30只,购自上海斯莱克实验动物有限公司。
1.1.2 主要试剂 RPMI1640培养基购自 GIBCO公司,胎牛血清系杭州四季青产品。全硫代磷酸化修饰的寡核苷酸均由上海生工公司合成,VEGF-C反义寡核苷酸序列为 5′-CCCACATCTGTAGAGGGAGGACTC-3′, 正 义 寡 核 苷 酸 序 列 为 5′-TACGTAGTATGGTGTACGATC-3′;RT-PCR试剂购自 Promega公司。 VEGF-C上游引物序列为 5′-CATGTACGAACCGCCAG-3′,下游引物序列为 5′-TTGGCTGTTTGGTCATTGGC-3′,扩增产物320 bp,β-actin上游引物序列为 5′-ACGTCTGCTGGAAGGTGGAC-3′,下 游引物 序列为 5′-GGTACCACCATGTACCCAGG-3′,扩增产物 163 bp,由上海生工公司合成。兔抗人多克隆抗体VEGF-C、VEGFR-3及免疫组织化学试剂盒 PV-9000均购自北京中山生物技术公司。
1.2 实验方法
1.2.1 人肺腺癌细胞株A 549裸鼠皮下种植瘤模型建立和分组 取对数生长期A 549细胞,经 2.5 g/L胰酶+0.2g/L EDTA消化液消化后,PBS洗涤 2次,离心 5 min(1 500 r/min),弃上清,加生理盐水制成单细胞悬液,细胞密度为 1×106个/ml,以0.2ml/只接种于 BALB/C小鼠右腋皮下。建模 1 w后,随机分为磷酸盐缓冲液对照组(PBS组)、正义和反义寡核苷酸对照组(SODN组和 AODN组),每组各 10只。
1.2.2 脂质体(Lip)+ODN复合物的制备和作用 FuGENE 6 Lip由阳离子脂质 DOTMA和中性磷脂 DOPE按 1∶1(W/W)比例在膜过滤生理盐水中合成,每毫升含 1 mg。按 1μg∶2μl的比例将AODN和SODN及脂质体轻柔混匀,室温下静置30 min,制成 Lip+ODN复合物。
1.2.3 干预方法和动物取材 寡核苷酸用量为每次 10 mg/kg体重,隔日 1次,每周 3次,共 3 w,分别抽取 0.2 ml浓度为8 mg/μl的正义和反义 VEGF-C寡核苷酸 PBS溶液给 SODN和AODN组小鼠注射,PBS组仅注射 0.2 ml PBS。第 4周末时所有动物模型均存活,颈椎脱臼法处死裸鼠,立即剖出肿瘤,置入10%中性甲醛常规固定标本石蜡包埋,行HE染色。
1.2.4 种植瘤内 VEGF-C mRNA和蛋白表达量检测 按照Trizol试剂盒说明提取种植瘤中总RNA,用引物 Oligo dT反转录 (RT)合成 cDNA链,RT反应产物用作PCR的模板DNA,使用特异性引物进行 PCR,β-actin作为内参照。取 10μl PCR产物在 2%琼脂凝胶电泳,紫外灯下观察电泳带,应用Smart View凝胶成像分析系统及其分析软件,以VEGF-C带峰面积与内参照β-actin带峰面积的比值表示VEGF-C mRNA水平。Western印迹检测 VEGF-C蛋白的表达。主要步骤包括:细胞总蛋白的提取,SDS-PAGE电泳,蛋白质转印及抗体染色,Ecl试剂检测、X-光电曝光及显影。
1.2.5 免疫组织化学染色计数微淋巴管密度 采用免疫组化Wax Envision多聚复合物酶标法,具体步骤按照试剂盒说明书进行。阴性对照采用 0.01 mol/L PBS代替一抗。VEGFR-3蛋白阳性表达产物定位于微淋巴管内皮细胞,呈棕红色颗粒。肿瘤微脉管计数方法:判定标准为由内皮细胞形成条状、隙状等孤立或簇状结构棕红染色及有管腔者,先在低倍光镜(×40)视野下寻找癌周组织微脉管最密集区即“热点”(hot spot),然后在高倍镜(×200)下观察,以 4个高倍镜视野脉管的平均数表示脉管数。
1.3 统计学方法 数据以 x±s表示,应用 SPSS l3.0软件包单因素方差分析和 q检验。
2 结 果
2.1 VEGF-C反义寡核苷酸对种植瘤内 VEGF-C mRNA和蛋白表达的影响 PBS组、SODN组和 AODN组种植瘤 VEGF-C mRNA表达量分别为 24.13±3.34、20.74±3.59和 4.61±1.57。AODN组种植瘤 VEGF-CmRNA表达显著减少,与对照组比较差异显著 (P<0.05),见图 1。Western印迹检测结果显示 AODN组种植瘤 VEGF-C蛋白表达量亦明显减少,见图 2。
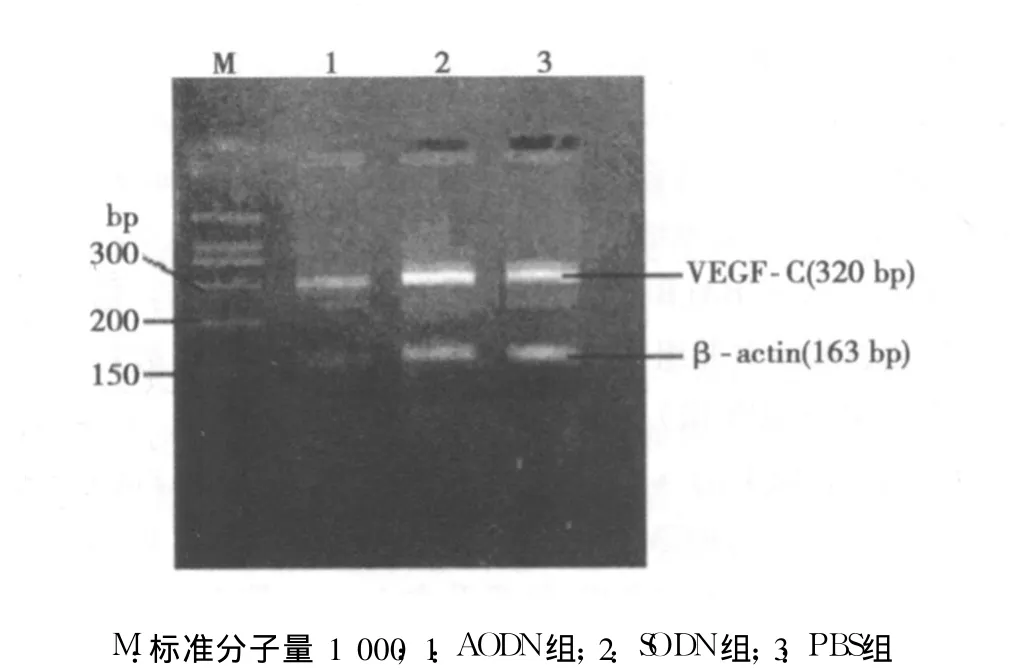
图1 VEGF-C mRNA RT-PCR结果

图2 各组瘤组织VEGF-C Western印迹检测结果
2.2 VEGF-C反义寡核苷酸对种植瘤微淋巴管生成的影响PBS组、SODN组和 AODN组种植瘤内微淋巴管密度分别为43.4±2.3、32.4±2.1和 3.2±1.7,AODN组种植瘤内微淋巴管密度显著减少,与对照组比较差异显著 (P<0.01),见图 3。
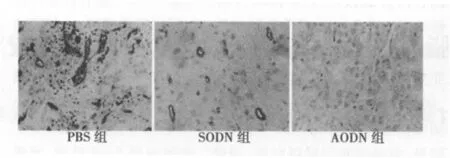
图3 转染后各瘤组织中微淋巴管免疫组化检测结果(DAB,×400)
3 讨 论
肿瘤细胞的血性和淋巴转移是影响患者生存的重要因素。而肺癌患者早期即可发生淋巴转移,这是长时间困扰临床医生的一个难题。有研究报道,肺癌前哨淋巴结转移往往预示着临床结果的高危性〔3〕。因此,研究清除淋巴转移的分子机制及有效抑制肿瘤细胞的淋巴转移显得十分必要。
肿瘤的淋巴管生成是指在肿瘤原位形成新的毛细淋巴管,它仅由单层淋巴内皮细胞组成、基底膜不完整、管壁薄、流速缓慢、剪切力低且淋巴与组织间液的组成基本相同,因而有利于肿瘤细胞进入淋巴管道,进而形成淋巴转移和远处转移〔4~7〕。研究发现 VEGF在肿瘤的生长和血管和淋巴管转移中发挥重要的作用,特别是VEGF-C是作为特异性淋巴管内皮细胞刺激因子,可通过诱导微淋巴管的生成使得肿瘤“淋巴管生成”失调控,并影响淋巴管内皮的通透性,从而促进肿瘤转移〔5~7〕。Zip等〔8〕通过建立动物肿瘤转移模型,研究 VEGF-C的促淋巴管生成机制,结果提示抑制 VEGF和 VEGFR的表达能显著增加肿瘤对治疗的敏感性。Miyata等〔9〕研究发现 VEGF-C在肿瘤淋巴管生成中起决定作用。Maekawa等〔10〕研究发现在 T1肺腺癌中 VEGF-CmRNA和蛋白质水平在 T1期肺腺癌中有淋巴结转移和无转移淋巴结之间无明显差异,但 5年生存率优于转移淋巴结的 T1期肺腺癌。因此,进一步探讨肺癌中 VEGF-C介导的淋巴管生成机制及其干预措施对于寻找有效的肺癌抗淋巴管生成治疗方法具有重要的实验和临床意义。
本研究通过建立肺癌裸鼠皮下种植瘤模型,应用反义核酸技术,根据核酸碱基互补配对的规律设计出能与靶基因特定区域结合的干扰 DNA,从而影响靶基因的表达。寡核苷酸干预后,RT-PCR和 Western印迹检测结果显示 AODN组种植瘤VEGF-C mRNA和蛋白表达量明显为低,与 PBS和 SODN组比较差异显著。分别从基因和蛋白质水平上证实了 VEGF-C反义寡核苷酸可明显抑制肺癌细胞 VEGF-C基因的表达,表明VEGF-C可能在促进肺癌淋巴管生成方面扮演着重要角色,同时也表明,VEGF-C反义寡核苷酸在抑制肺癌淋巴管生成中发挥了重要作用。
淋巴管密度是评价肿瘤淋巴管生成的重要指标。本研究中,AODN组种植瘤内微淋巴管密度显著低于两对照组,提示VEGF-C反义寡核苷酸靶向抑制肺癌 A 549细胞 VEGF-C蛋白的表达,从而减少了VEGF-C与肿瘤淋巴管内皮细胞上特异性受体 VEGFR-3的结合,进而降低肺癌淋巴管内皮细胞有丝分裂和迁移游走的能力,抑制肺癌微淋巴管的生成。如此,将可能阻断肺癌细胞通过新生淋巴管转移至远处淋巴结的通道,有效防止淋巴结远处转移。
综上所述,我们认为VEGF-C反义寡核苷酸能有效抑制肺癌细胞 VEGF-C的微淋巴管基因表达,进而抑制肺癌细胞的增殖和淋巴转移,可作为一种抗肺癌淋巴管生成治疗方法。
1 Molina JR,Adjei AA,Jett JR.Advances in chemotherapy of non-small cell lung cancer〔J〕.Chest,2006;30(4):1211-9.
2 Hirakawa S,Brown LF,Kodama S,et al.VEGF-C induced lymphangiogenesis in sentinel lymph nodes promotes tumor metastasis to distant sites〔J〕.Blood,2007;09(3):1010-7.
3 郭旭峰,胡国强,尹秋伟,等.PTTG、VEGF-C基因过表达与非小细胞肺癌发生、发展的关系及其临床意义〔J〕.山东大学学报(医学版),2006;4(11):1175-9.
4 Zwaans BM,Bielenberg DR.Potential therapeutic strategies for lymphatic metastasis〔J〕.Microvascular Res,2007;74(2-3):145-58.
5 Karkkainen MJ,Haiko P,Sainio K,et al.Vascular endothelial growth factor Cis required for sproutingof the first lymphatic vessels from embryonic veins〔J〕.Nature Immunol,2004;5(1):74-80.
6 Rinderknecht M,Detmar M.Tumor lymphangiogenesis and melanomametastasis〔J〕.J Cell Physiol,2008;216(2):347-54.
7 Tobler NE,Detmar M.Tumor and lymph node lymphangiogenesis-impact on cancer metastasis〔J〕.J Leukoc Biol,2006;80(4):691-6.
8 Zips D,Krause M,Hessel F,et al.Experimental study on different combination schedulesof VEGFR inhibitor PTK 787/ZK222584 and fractionated irradiation〔J〕.Anticancer Res,2003;23(5):3869-76.
9 Miyata Y,Kanda S,Ohba K,et al.Lymphangiogenesis and angiogenesis in bladder cancer:prognostic implications and regulation by vascular endothelial growth factors-A,-C,and-D〔J〕.Clin Cancer Res,2006;12(3):800-6.
10 Maekawa S,Iwasaki A,Shirakusa T,et al.Correlation between lymph node metastasisand the expression of VEGF-C,VEGF-D and VEGFR-3 in T1 lung adenocarcinoma〔J〕.Anticancer Res,2007;27(6A):3735-41.

