COX-2基因在大肠癌的表达及其意义
王淑强 李秀娟 李 鹏 武 欣 王琳冬
(河北北方学院病理教研室,河北 张家口 075000)
近年来研究表明,环氧合酶(COX)-2在多种肿瘤中均呈高表达,在肿瘤发生、发展、分化、转移中起重要作用。在细胞癌变过程中,Wnt通路异常变化可能具有重要作用,COX-2是 Wnt通路的靶基因,可通过增强 MMPs的表达,促进肿瘤的转移〔1〕。本研究采用流式细胞术检测大肠癌及大肠远端正常黏膜中COX-2的表达情况,探讨COX-2在大肠癌发生、发展和转移中的作用,为预测大肠癌浸润和转移提供理论依据。
1 材料与方法
1.1 一般资料 收集手术切除的大肠癌标本 58例,男 28例,女 30例,年龄 30~78岁(平均 58.3岁)。病变部位:结肠癌 22例,直肠癌 36例;分化程度:高分化腺癌 26例,中分化腺癌 20例,低分化腺癌 6例,黏液腺癌 6例;转移情况:有淋巴结转移31例,无淋巴结转移 27例。同时选取大肠癌远端正常黏膜组织 10例。
1.2 方法
1.2.1 试剂 兔抗人 COX-2单克隆抗体(Santa Crus Biotechonlogy,INC),羊抗兔IgG-FITC,DAB显示剂,均购自北京中杉金桥生物技术有限公司。
1.2.2 实验步骤 单细胞悬液的制备:石蜡包埋组织 HE染色,切成 40μm厚的组织片 5片,放入 10ml的试管中,加入二甲苯 8 ml,在室温下脱蜡 2d,其间更换 2次二甲苯,石蜡脱净后,弃去二甲苯;依次加入 100%、95%、70%、50%梯度乙醇5 ml,每步 10 min,加入蒸馏水 5 ml,10 min后弃之。加入2 ml 0.5%胰蛋白酶 (pH1.5)消化液,置 37℃恒温水浴中消化30 min,在消化期间,每隔 10 min用振荡器振荡 1次,消化30 min后,立即加生理盐水终止消化,经 300目尼龙网过滤,未消化好的组织可做第二次消化。收集细胞悬液,以1 500 r/min离心沉淀 5 min,再用生理盐水漂洗 2次,以800r/min离心沉淀 5 min,去碎片。细胞的免疫荧光标记:取单细胞悬液 1×106/ml,加入兔抗人COX-2单克隆抗体工作液0.1ml室温孵育 30 min,加入 PBS 10 ml洗涤 1次,弃上清,加入羊抗兔 FITC-IgG二抗工作液 10 ml,避光室温孵育30 min,加入 PBS 10ml,800 r/min离心沉淀 5min,弃上清除去未结合的荧光二抗,上机检测并加入PBS 0.1 ml经 500目铜网过滤后上机检测。蛋白免疫荧光标记物测定设一抗或二抗的本底对照和阴性对照。检测条件及参数采用美国 Beckman Coulter公司生产的 Epics-XLII型流式细胞仪,应用 Expo32ADC软件分析数据。测定前以Flow check标准微球调整仪器的 CV值在 2%以内。
1.2.3 结果判定 根据流式细胞仪分析软件测定出的平均荧光强度(Mode值)计算荧光指数(FI),并以 FI表示 COX-2基因蛋白表达的强弱。FI=(样品基因蛋白的表达荧光强度 -正常样品的荧光强度)/正常样品的荧光强度。
1.3 统计学处理 数据分析采用 SPSS11.0统计软件进行统计分析。数据用 x±s表示,采用单因素方差分析。
2 结 果
2.1 COX-2基因在正常黏膜和不同分化组中的表达 COX-2表达平均 FI值正常黏膜组为 1.00±0.28,高、中、低分化及黏液腺癌组分别为 2.47±1.41、2.70±1.08、3.16±1.34和2.01±1.43,高、中、低分化及黏液腺癌组 COX-2表达均明显高于正常黏膜组(P<0.01)。
2.2 COX-2基因在大肠的表达与临床病理特征的关系 见表1。大肠癌COX-2基因表达在有淋巴结转移组显著高于无淋巴结转移组(P<0.05),与大肠癌患者的年龄、性别、肿瘤的发生部位等无关。
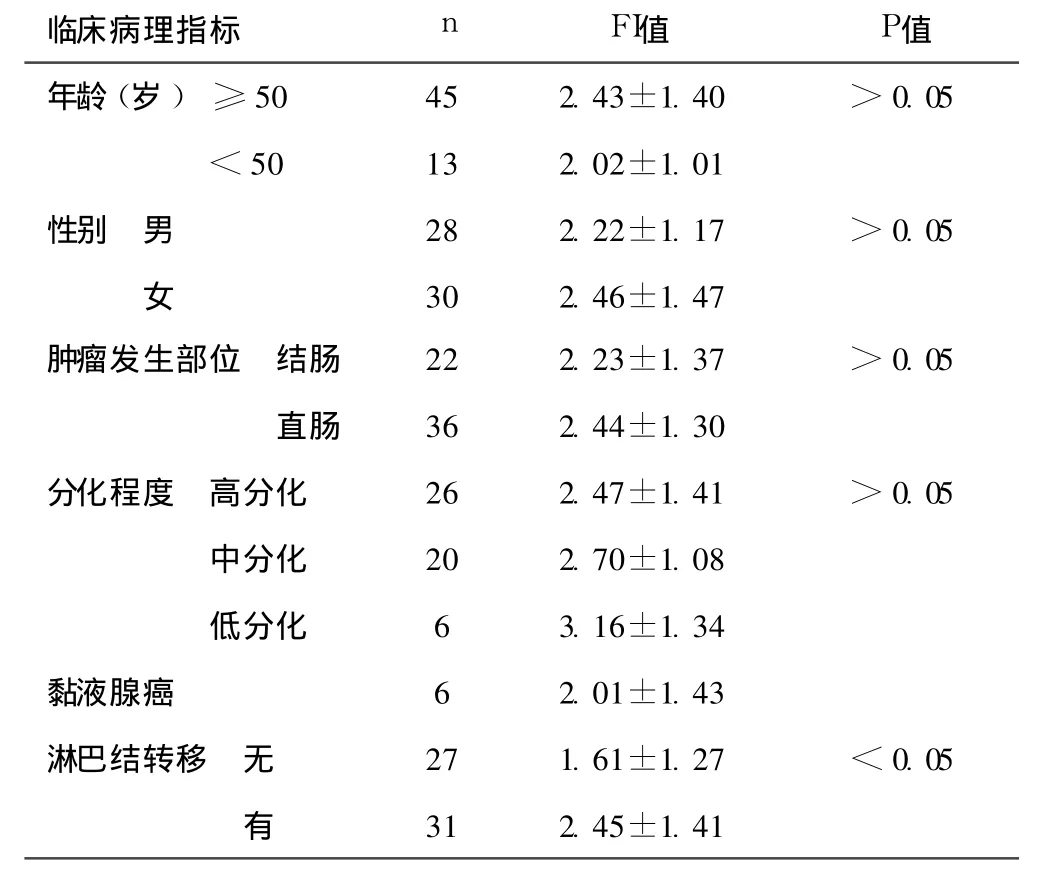
表1 COX-2基因在大肠癌中的表达与临床病理特征的关系(x±s)
3 讨 论
人的 COX-2基因定位于第一号染色体 1q25.2-25.3,长约8.3kb,其 mRNA约 4.5 kb,由 10个外显子和 9个内含子构成;COX-2基因的 3URT区域包含 1.5 kb的 22个 AUUUA基因序列,与 mRNA不稳定有关〔2〕。 COX-2基因编码 604个氨基酸,含 17个氨基酸残基的信号肽。COX是一种与生物膜相结合的花生四烯酸转化为前列腺素过程中发挥作用的限速酶。COX-2基因为诱导型蛋白,被认为是“快速反应基因”,静息时不表达,当细胞受到各种刺激时则迅速合成,表达增加癌症的发生是原癌基因激活和抑癌基因失活为基础的多步骤、多阶段过程,通常其表达产物作用于细胞生长、分化及代谢过程,最终导致癌变。COX-2在多种肿瘤如食管癌、肾癌、胰腺癌等组织中均有表达,研究表明,它在肿瘤的增殖、凋亡及转移中发挥重要作用。COX-2促进肿瘤的发生和肿瘤的恶性表型转换的可能机制〔3〕:(1)对细胞凋亡的抑制:可通过减弱和抑制 NO信号途径来抑制细胞凋亡。(2)促进肿瘤血管的发生:血管内皮细胞通常不会增生,除非受到某些刺激,肿瘤血管的形成是针对不同因子的刺激而发生。VEGF作用于血管内皮细胞,通过增高血管内皮细胞渗透性和促进内皮细胞变形、迁徙等促进肿瘤血管生成〔4〕。研究证实,COX-2表达与 VEGF的表达呈正相关〔5~7〕。(3)促进肿瘤细胞的侵袭和转移:COX-2高表达还常导致一种浸润抑制因子 E-cadherin在细胞中缺失,E-cadherin缺失有利于肿瘤细胞的侵袭转移。(4)调节免疫抑制功能。(5)导致原癌基因的激活和抑癌基因的缺失或突变:COX-2在正常大肠黏膜中检测不到,而在 80%的大肠癌中呈过表达。Lambropoulou等〔8〕发现,在子宫内膜癌中 COX-2的表达与肌层浸润深度密切相关,提示 COX-2表达与肿瘤的局部扩散有关。姚楠〔9〕研究显示,COX-2在大肠腺癌的发展过程中其表达呈增高趋势,提示COX-2在大肠腺癌的发展过程中起着重要作用。本研究显示,正常黏膜组 COX-2表达平均 FI值明显低于高、中、低分化组,提示 COX-2可能在大肠癌的发生、发展过程中发挥着重要作用。同时还显示,淋巴结转移组 COX-2表达平均FI值显著高于无淋巴结转移组,提示 COX-2的高表达预示着大肠癌患者有较高的淋巴结转移率,而淋巴结转移是影响大肠癌患者预后的重要指标,但COX-2的表达与患者的年龄、性别、发生部位、分化程度等无关。
1 青 轶,王 欣.酪蛋白酶 1在 Wnt通路和生物节律中的研究进展〔J〕.医学分子生物学杂志,2005;2(4):274-7.
2 王勤章.环氧化酶-2及其在泌尿系肿瘤中的研究进展〔J〕.国外医学◦泌尿系统杂志,2002;22(5):274-7.
3 Demplce W,Rie I,Grothey A,et al.Cycbooxygenase-2:a novel target for cancer chemotherapy〔J〕.Cancer Res Clin Oncol,2001;127(7):411-7.
4 Krysan K,Reckamp KL,Dalwadi H,et al.Prostaglandin E2 activates mitogen-activated protein Kinase/Erk pathway signaling and cell proliferation in non-small cell lung cancer cells in an epidermal growth factor receptor-independent manner〔J〕.Cancer Res,2005;65:6275-81.
5 Timoshenko AV,Chakraborty C,Wangner GF,et al.COX-2 mediated stimulation of the lymphangiogenic factor VEGF-Cin human breast cancer〔J〕.Br JCance,2006;94:1154-63.
6 Soumaoro LT,Uetake H,Takagi Y,et al.Coexpression of VEGF-C and COX-2 in human colorectal cancer and its association with lymph node metastasis〔J〕.Dis Cobn Rectum,2006;49(3):392-8.
7 Kyzas PA,Stefanou D,Agnantis NJ.COX-2 expression correlates with VEGF-Cand lymph node metastasis in patients with head neck squamous cell carcinoma〔J〕.Mod Pathol,2005;18(1):153-6.
8 Lambropoulou M,Alexiadis G,Limberis V,et al.Chinicopathologic and prognostic significance of cyclooxygenase-2 expression in endometrial carcinoma〔J〕.Histopathology,2005;20(3):753-9.
9 姚 楠,李俊刚,高 倩,等.环氧化酶-2在大肠癌中的表达特点及其与淋巴结转移的关系〔J〕.昆明医学院学报,2006;27(5):55-9.

